Аденозиндифосфат
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Аденозин 5′-(тригидроген дифосфат) | |
| Систематическое название ИЮПАК [(2 R ,3 S ,4 R ,5 R )-5-(6-амино-9 H -пурин-9-ил)-3,4-дигидроксиоксолан-2-ил]метилтригидрогендифосфат | |
| Другие имена Аденозин 5′-дифосфат; Аденозин 5′-пирофосфат; Аденозинпирофосфат | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ХЭБИ | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Информационная карта ECHA | 100.000.356 |
| Номер ЕС |
|
| |
| КЕГГ | |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С10Н15Н5О10П2 | |
| Молярная масса | 427,201 г/моль |
| Плотность | 2,49 г/мл |
| лог P | -2.640 |
| Опасности | |
| Паспорт безопасности (SDS) | ПБМ |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Аденозиндифосфат ( АДФ ), также известный как аденозинпирофосфат ( АПП ), является важным органическим соединением в метаболизме и необходим для потока энергии в живых клетках . АДФ состоит из трех важных структурных компонентов: сахарного остова, прикрепленного к аденину , и двух фосфатных групп, связанных с 5-м атомом углерода рибозы . Дифосфатная группа АДФ прикреплена к 5'-углероду сахарного остова, в то время как аденин прикреплен к 1'-углероду. [1]
АДФ может быть взаимопревращен в аденозинтрифосфат (АТФ) и аденозинмонофосфат (АМФ). АТФ содержит на одну фосфатную группу больше, чем АДФ, в то время как АМФ содержит на одну фосфатную группу меньше. Передача энергии, используемая всеми живыми существами, является результатом дефосфорилирования АТФ ферментами, известными как АТФазы . Расщепление фосфатной группы от АТФ приводит к связыванию энергии с метаболическими реакциями и побочным продуктом АДФ. [1] АТФ непрерывно реформируется из низкоэнергетических видов АДФ и АМФ. Биосинтез АТФ достигается посредством таких процессов, как фосфорилирование на уровне субстрата , окислительное фосфорилирование и фотофосфорилирование , каждый из которых облегчает добавление фосфатной группы к АДФ.
Биоэнергетика
Цикл АДФ обеспечивает энергию, необходимую для выполнения работы в биологической системе, термодинамический процесс передачи энергии от одного источника к другому. Существует два типа энергии: потенциальная энергия и кинетическая энергия . Потенциальную энергию можно рассматривать как запасенную энергию или полезную энергию, которая доступна для выполнения работы. Кинетическая энергия — это энергия объекта в результате его движения. Значение АТФ заключается в его способности хранить потенциальную энергию в фосфатных связях. Энергия, запасенная между этими связями, затем может быть передана для выполнения работы. Например, передача энергии от АТФ к белку миозину вызывает конформационное изменение при соединении с актином во время сокращения мышцы . [1]
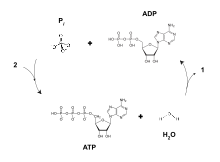
Для эффективного производства одного мышечного сокращения требуется несколько реакций между миозином и актином, и, следовательно, для производства каждого мышечного сокращения требуется наличие большого количества АТФ. По этой причине биологические процессы эволюционировали, чтобы производить эффективные способы пополнения потенциальной энергии АТФ из АДФ. [2]
Разрыв одной из фосфорных связей АТФ генерирует приблизительно 30,5 килоджоулей на моль АТФ (7,3 ккал ). [3] АДФ может быть преобразован или преобразован обратно в АТФ посредством процесса высвобождения химической энергии, содержащейся в пище; у людей это постоянно происходит посредством аэробного дыхания в митохондриях . [2] Растения используют фотосинтетические пути для преобразования и хранения энергии солнечного света, а также преобразования АДФ в АТФ. [3] Животные используют энергию, высвобождаемую при расщеплении глюкозы и других молекул, для преобразования АДФ в АТФ, которая затем может использоваться для обеспечения необходимого роста и поддержания клеток. [2]
Клеточное дыхание
Катаболизм
Десятишаговый катаболический путь гликолиза является начальной фазой высвобождения свободной энергии при расщеплении глюкозы и может быть разделен на две фазы: подготовительную фазу и фазу выплаты. АДФ и фосфат необходимы в качестве предшественников для синтеза АТФ в реакциях выплаты цикла трикарбоновых кислот и механизма окислительного фосфорилирования . [4] Во время фазы выплаты гликолиза ферменты фосфоглицераткиназа и пируваткиназа облегчают добавление фосфатной группы к АДФ путем фосфорилирования на уровне субстрата . [5]
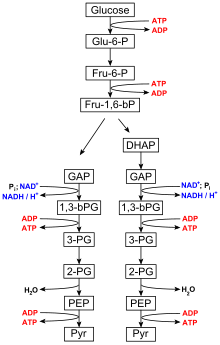
Гликолиз
Гликолиз осуществляется всеми живыми организмами и состоит из 10 этапов. Чистая реакция для всего процесса гликолиза : [6]
- Глюкоза + 2 НАД+ + 2 ПИ + 2 АДФ → 2 пируват + 2 АТФ + 2 НАДН + 2 Н2О
Шаги 1 и 3 требуют ввода энергии, полученной в результате гидролиза АТФ до АДФ и Pi ( неорганического фосфата), тогда как шаги 7 и 10 требуют ввода АДФ, каждый из которых дает АТФ. [7] Ферменты , необходимые для расщепления глюкозы, находятся в цитоплазме , вязкой жидкости, которая заполняет живые клетки, где происходят гликолитические реакции. [1]
Цикл лимонной кислоты
Цикл лимонной кислоты , также известный как цикл Кребса или цикл TCA (трикарбоновых кислот), представляет собой 8-шаговый процесс, в котором пируват, образующийся в результате гликолиза, преобразуется в 4 НАДН, ФАДН2 и ГТФ, которые затем преобразуются в АТФ. [8] Только на 5-м этапе, где ГТФ генерируется сукцинил-КоА-синтетазой, а затем преобразуется в АТФ, используется АДФ (ГТФ + АДФ → ГДФ + АТФ). [9]
Окислительное фосфорилирование
Окислительное фосфорилирование производит 26 из 30 эквивалентов АТФ, образующихся при клеточном дыхании путем переноса электронов от НАДН или ФАДН2 к О2 через переносчики электронов. [10] Энергия, высвобождаемая при переносе электронов от НАДН или ФАДН2 с более высокой энергией к О2 с более низкой энергией, необходима для фосфорилирования АДФ и повторного образования АТФ. [11] Именно это энергетическое соединение и фосфорилирование АДФ до АТФ дает цепи переноса электронов название окислительное фосфорилирование. [1]
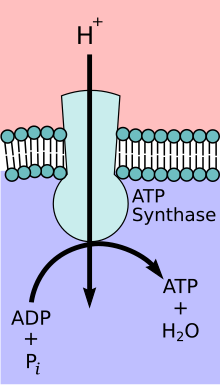
Митохондриальный комплекс АТФ-синтазы
Во время начальных фаз гликолиза и цикла TCA такие кофакторы , как NAD+, отдают и принимают электроны [12] , что способствует способности цепи переноса электронов создавать градиент протонов через внутреннюю мембрану митохондрий. [13] Комплекс АТФ-синтазы существует внутри мембраны митохондрий (часть F O ) и выступает в матрикс (часть F 1 ). Энергия, полученная в результате химического градиента, затем используется для синтеза АТФ путем сопряжения реакции неорганического фосфата с АДФ в активном центре фермента АТФ-синтазы ; уравнение для этого можно записать как АДФ + P i → АТФ. [ необходима цитата ]
Активация тромбоцитов в крови
В нормальных условиях небольшие дискообразные тромбоциты циркулируют в крови свободно и не взаимодействуя друг с другом. АДФ хранится в плотных телах внутри тромбоцитов и высвобождается при активации тромбоцитов. АДФ взаимодействует с семейством рецепторов АДФ, обнаруженных на тромбоцитах (P2Y1, P2Y12 и P2X1), что приводит к активации тромбоцитов. [14]
- Рецепторы P2Y1 инициируют агрегацию тромбоцитов и изменение их формы в результате взаимодействия с АДФ.
- Рецепторы P2Y12 дополнительно усиливают реакцию на АДФ и ускоряют завершение агрегации.
АДФ в крови преобразуется в аденозин под действием экто-АДФаз , ингибируя дальнейшую активацию тромбоцитов через аденозиновые рецепторы . [ необходима ссылка ]
Смотрите также
Ссылки
- ^ abcde Кокс, Майкл; Нельсон, Дэвид Р.; Ленингер, Альберт Л. (2008). Принципы биохимии Ленингера . Сан-Франциско: WH Freeman. ISBN 978-0-7167-7108-1.
- ^ abc Nave, CR (2005). "Аденозинтрифосфат". Hyper Physics [сериал в Интернете] . Университет штата Джорджия.
- ^ ab Farabee, MJ (2002). "Природа АТФ". АТФ и биологическая энергия [сериал в Интернете] . Архивировано из оригинала 2007-12-01.
- ^ Jensen TE, Richter EA (март 2012). «Регуляция метаболизма глюкозы и гликогена во время и после упражнений». J. Physiol . 590 (Pt 5): 1069–76 . doi :10.1113/jphysiol.2011.224972. PMC 3381815. PMID 22199166 .
- ^ Liapounova NA, Hampl V, Gordon PM, Sensen CW, Gedamu L, Dacks JB (декабрь 2006 г.). «Реконструкция мозаичного гликолитического пути анаэробного эукариота Monocercomonoides». Eukaryotic Cell . 5 (12): 2138– 46. doi :10.1128/EC.00258-06. PMC 1694820. PMID 17071828 .
- ^ Medh, JD "Glycolysis" (PDF) . CSUN.Edu. Архивировано (PDF) из оригинала 2022-10-09 . Получено 3 апреля 2013 .
- ^ Бейли, Регина. "10 шагов гликолиза". Архивировано из оригинала 2013-05-15 . Получено 2013-05-10 .
- ^ "Цикл лимонной кислоты" (PDF) . Примечание Такусагавы. Архивировано из оригинала (PDF) 24 марта 2012 г. Получено 4 апреля 2013 г.
- ^ "Биохимия" (PDF) . UCCS.edu. Архивировано из оригинала (PDF) 2013-02-28.
- ^ "Окислительное фосфорилирование". WH Freeman, 2002. Получено 4 апреля 2013 .
- ^ Medh, JD "Electron Transport Chain (Overview)" (PDF) . CSUN.edu. Архивировано (PDF) из оригинала 2022-10-09 . Получено 4 апреля 2013 .
- ^ Беленький П., Боган КЛ., Бреннер К. (январь 2007 г.). «Метаболизм НАД+ в здоровье и болезни». Trends Biochem. Sci . 32 (1): 12– 9. doi :10.1016/j.tibs.2006.11.006. PMID 17161604.
- ^ Мюррей, Роберт Ф. (2003). Иллюстрированная биохимия Харпера . Нью-Йорк: McGraw-Hill. ISBN 0-07-121766-5.
- ^ Murugappa S, Kunapuli SP (2006). «Роль рецепторов АДФ в функции тромбоцитов». Front. Biosci . 11 : 1977–86 . doi : 10.2741/1939 . PMID 16368572.


