2-пиридон
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Пиридин-2(1 H )-он | |||
| Другие имена 2(1 H )-Пиридинон 2(1 H )-Пиридон 1 H -Пиридин-2-он 2-Пиридон 1,2-Дигидро-2-оксопиридин 1 H -2-Пиридона 2-Оксопиридон 2-Пиридинол 2-Гидроксипиридин | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.005.019 | ||
| Номер ЕС |
| ||
| КЕГГ |
| ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С 5 Н 5 Н О | |||
| Молярная масса | 95,101 г·моль −1 | ||
| Появление | Бесцветное кристаллическое вещество. | ||
| Плотность | 1,39 г/см 3 | ||
| Температура плавления | 107,8 °C (226,0 °F; 380,9 К) | ||
| Точка кипения | 280 °C (536 °F; 553 K) разл. | ||
| Растворимость в других растворителях | Растворим в воде , метаноле , ацетоне | ||
| Кислотность ( pK a ) | 11.65 | ||
| УФ-видимый (λ макс ) | 293 нм (ε 5900, раствор H 2 O) | ||
| Структура | |||
| Орторомбический | |||
| плоский | |||
| 4.26 Д | |||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | раздражающий | ||
| Маркировка СГС : | |||
  | |||
| Опасность | |||
| Н301 , Н315 , Н319 , Н335 | |||
| Р261 , Р264 , Р270 , Р271 , Р280 , Р301+Р310 , Р302+Р352 , Р304+Р340 , Р305+Р351+Р338 , Р312 , Р321 , Р330 , Р332+Р313 , Р337+Р313 , Р362 , Р403+Р233 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 210 °C (410 °F; 483 К) | ||
| Родственные соединения | |||
Другие анионы | 2-пиридинолат | ||
Другие катионы | 2-гидроксипиридиний-ион | ||
Связанные функциональные группы | спирт , лактам , лактим , пиридин , кетон | ||
Родственные соединения | пиридин , тимин , цитозин , урацил , бензол | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
2-Пиридон — органическое соединение с формулой C
5ЧАС
4NH(O) . Это бесцветное твердое вещество. Хорошо известно, что оно образует водородно-связанные димеры, и это также классический случай соединения, которое существует в виде таутомеров .
Таутомерия

Второй таутомер — 2-гидроксипиридин. Этот лактам- лактимный таутомеризм может также проявляться во многих родственных соединениях. [1]
Таутомерия в твердом состоянии
Амидная группа может участвовать в образовании водородных связей с другими азот- и кислородсодержащими соединениями .
Преобладающей формой твердого состояния является 2-пиридон. Это было подтверждено рентгеновской кристаллографией , которая показывает, что водород в твердом состоянии ближе к азоту, чем к кислороду (из-за низкой электронной плотности у водорода точное позиционирование затруднено), и ИК-спектроскопией , которая показывает, что продольная частота C=O присутствует, тогда как частоты OH отсутствуют. [2] [3] [4] [5]
Таутомерия в растворе
Таутомеризация была тщательно изучена. Разница в энергии, по-видимому, очень мала. Неполярные растворители благоприятствуют 2-гидроксипиридину, тогда как полярные растворители, такие как спирты и вода , благоприятствуют 2-пиридону. [1] [6] [7]
Разница энергии для двух таутомеров в газовой фазе была измерена с помощью ИК-спектроскопии и составила от 2,43 до 3,3 кДж / моль для твердого состояния и 8,95 кДж/моль и 8,83 кДж/моль для жидкого состояния. [8] [9] [10]
Механизм таутомеризации А
Единичная молекулярная таутомеризация имеет запрещенное 1-3 супрафациальное переходное состояние и, следовательно, имеет высокий энергетический барьер для этой таутомеризации , который был рассчитан теоретическими методами как 125 или 210 кДж/моль. Прямая таутомеризация энергетически невыгодна. Существуют и другие возможные механизмы для этой таутомеризации. [10]
Димеризация
2-Пиридон и 2-гидроксипиридин могут образовывать димеры с двумя водородными связями. [11]
Агрегация в твердом состоянии
В твердом состоянии димерная форма отсутствует; 2-пиридоны образуют спиральную структуру по водородным связям. Некоторые замещенные 2-пиридоны образуют димер в твердом состоянии, например, 5-метил-3-карбонитрил-2-пиридон. Определение всех этих структур было проведено с помощью рентгеновской кристаллографии . В твердом состоянии водород расположен ближе к азоту, поэтому можно считать правильным называть бесцветные кристаллы в колбе 2-пиридоном. [1] [2] [3] [4] [5]
Агрегация в растворе
В растворе присутствует димерная форма; соотношение димеризации сильно зависит от полярности растворителя. Полярные и протонные растворители взаимодействуют с водородными связями , и образуется больше мономера . Гидрофобные эффекты в неполярных растворителях приводят к преобладанию димера. Соотношение таутомерных форм также зависит от растворителя. Все возможные таутомеры и димеры могут присутствовать и образовывать равновесие, а точное измерение всех констант равновесия в системе крайне затруднительно. [11] [12] [13] [14] [15] [16] [17] [18] [19] [20]
( ЯМР-спектроскопия — медленный метод, ИК-спектроскопия высокого разрешения в растворителе затруднена, широкое поглощение в УФ-спектроскопии затрудняет различение 3 и более очень похожих молекул ).
Некоторые публикации фокусируются только на одной из двух возможных моделей и пренебрегают влиянием другой. Например, расчет разницы энергий двух таутомеров в неполярном растворе приведет к неверному результату, если большое количество вещества находится на стороне димера в равновесии.
Механизм таутомеризации B
Прямая таутомеризация энергетически невыгодна, но димеризация с последующим двойным переносом протона и диссоциацией димера является самокаталитическим путем от одного таутомера к другому. Протонные растворители также опосредуют перенос протона во время таутомеризации.
Синтез
2-Пирон можно получить реакцией циклизации и преобразовать в 2-пиридон посредством реакции обмена с аммиаком :
Пиридин образует N -оксид с некоторыми окислителями, такими как перекись водорода . Этот пиридин- N -оксид подвергается реакции перегруппировки в 2-пиридон в уксусном ангидриде : [21] [22] [23]
В конденсации Гуарески-Торпа цианоацетамид реагирует с 1,3-дикетоном с образованием 2-пиридона . [12] [13] Реакция названа в честь Исилио Гуарески и Джоселин Филд Торп . [14] [15]
Химические свойства
Каталитическая активность
2-пиридон катализирует множество протонзависимых реакций, например, аминолиз эфиров. В некоторых случаях расплавленный 2-пиридон используется в качестве растворителя. 2-пиридон оказывает большое влияние на реакцию активированных эфиров с аминами в неполярном растворителе , что объясняется его таутомеризацией и полезностью в качестве дитопного рецептора. Перенос протона от 2-пиридона и его таутомера был исследован с помощью изотопной маркировки , кинетики и квантово-химических методов. [16] [17] [24]
Координационная химия
2-Пиридон и некоторые производные служат лигандами в координационной химии, обычно как 1,3-мостиковый лиганд, родственный карбоксилату . [18]
В природе
2-пиридон не встречается в природе, но его производное было выделено в качестве кофактора в некоторых гидрогеназах . [19]
Поведение в окружающей среде
2-пиридон быстро разлагается микроорганизмами в почвенной среде, с периодом полураспада менее одной недели. [20] Организмы, способные расти на 2-пиридоне как единственном источнике углерода, азота и энергии, были выделены рядом исследователей. Наиболее широко изученным разрушителем 2-пиридона является грамположительная бактерия Arthrobacter crystallopoietes , [25] член типа Actinomycetota , который включает многочисленные родственные организмы, которые, как было показано, разлагают пиридин или один или несколько алкил-, карбоксил- или гидроксилзамещенных пиридинов. Разложение 2-пиридона обычно инициируется атакой монооксигеназы, в результате чего образуется диол, такой как 2,5-дигидроксипиридин, который метаболизируется через малеаматный путь. Расщепление кольца происходит под действием 2,5-дигидроксипиридинмонооксигеназы, которая также участвует в метаболизме никотиновой кислоты через малеаматный путь. В случае Arthrobacter crystallopoietes по крайней мере часть пути деградации передается через плазмиду. [26] Пиридиндиолы подвергаются химическому преобразованию в растворе с образованием интенсивно окрашенных пигментов. Аналогичные пигменты наблюдались при деградации хинолина , [27] также вследствие преобразования метаболитов, однако желтые пигменты, часто сообщаемые при деградации многих пиридиновых растворителей, таких как незамещенный пиридин или пиколин , обычно являются результатом перепроизводства рибофлавина в присутствии этих растворителей. [28] Вообще говоря, деградация пиридонов, дигидроксипиридинов и пиридинкарбоновых кислот обычно опосредуется оксигеназами, тогда как деградация пиридиновых растворителей часто не опосредована и в некоторых случаях может включать начальный восстановительный этап. [26]
Аналитические данные
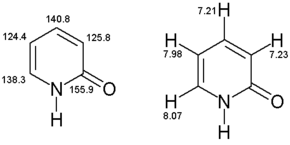
1ЯМР-спектроскопия Н
1 H-ЯМР (400 МГц, CD 3 OD): /ρ = 8,07 (dd, 3 J = 2,5 Гц, 4 J = 1,1 Гц, 1H, C-6), 7,98 (dd, 3 J = 4,0 Гц, 3 J = 2,0 Гц, 1H, C-3), 7,23 (dd, 3 J = 2,5 Гц, 3 J = 2,0 Гц, 1H, C-5), 7,21 (dd, 3 J = 4,0 Гц, 4 J = 1,0 Гц, 1H, C-4).
13С-ЯМР
(100,57 МГц, CD 3 ОД): ρ = 155,9 (С-2), 140,8 (С-4), 138,3 (С-6), 125,8 (С-3), 124,4 (С-5)
(MeOH):ν max (lgε) = 226,2 (0,44), 297,6 (0,30).
(KBr): ν = 3440 см − 1 –1 (ш, м), 3119 (ср), 3072 (ср), 2986 (ср), 1682 (с), 1649 (остр.), 1609 (остр.), 1578 (остр.), 1540 (с), 1456 (ср), 1433 (ср), 1364 (сл), 1243 (ср), 1156 (ср), 1098 (ср), 983 (ср), 926 (сл), 781 (с), 730 (сл), 612 (сл), 560 (сл), 554 (сл), 526 (ср), 476 (ср), 451 (сл).
ЭУ-МС (70 эВ): m/z (%) = 95 (100) [M + ], 67 (35) [M + - CO], 51 (4) [C 4 H 3 + ].
- Если не указано иное, данные относятся к стандартной температуре и давлению .
- Общее примечание о надежности данных .
Ссылки
- Cox RH, Bothner-By AA (1969). "Протонные магнитно-резонансные спектры таутомерных замещенных пиридинов и их сопряженных кислот". Журнал физической химии . 73 (8): 2465. doi :10.1021/j100842a001.
- DW Aksnes (1972). «Эффекты заместителя и растворителя в спектрах протонного магнитного резонанса (ПМР) шести 2-замещенных пиридинов» (PDF) . Acta Chemica Scandinavica . 26 : 2255– 2266. doi :10.3891/acta.chem.scand.26-2255.
- Брюгель В. (1962). «Кернрезонансный спектр пиридина». Zeitschrift für Elektrochemie, Berichte der Bunsengesellschaft für Physikalische Chemie . 66 (2): 159–177 . doi :10.1002/bbpc.19620660211. S2CID 98754100.
- Робертс Дж. Д., Фон Оствальден П. В. (1971). «Спектроскопия ядерного магнитного резонанса. Протонные спектры 2-пиридонов». Журнал органической химии . 36 (24): 3792. doi :10.1021/jo00823a029.
Смотрите также
- 2-пирон
- 4-пиридон
- 5-метил-2-пиридон используется для производства пирфенидона .
Ссылки
- ^ abc Форлани Л., Кристони Г., Бога К., Тодеско П.Е., Дель Веккьо Э., Сельва С., Монари М. (2002). «Повторное исследование таутомерии некоторых замещенных 2-гидроксипиридинов». Аркивок . XI (11): 198–215 . doi : 10.3998/ark.5550190.0003.b18 . hdl : 2027/spo.5550190.0003.b18 .
- ^ ab Yang HW, Craven BM (1998). "Плотность заряда 2-пиридона". Acta Crystallogr. B . 54 (6): 912– 920. doi :10.1107/S0108768198006545. PMID 9880899. S2CID 9505447.
- ^ ab Penfold BR (1953). "Распределение электронов в кристаллическом альфа-пиридоне". Acta Crystallogr . 6 (7): 591– 600. Bibcode :1953AcCry...6..591P. doi : 10.1107/S0365110X5300168X .
- ^ ab Ohms U., Guth H., Heller E., Dannöhl H., Schweig A. (1984). "Сравнение наблюдаемой и расчетной электронной плотности 2-пиридона, C 5 H 5 NO, уточнение кристаллической структуры при 295 К и 120 К, экспериментальные и теоретические исследования плотности деформации". Z. Kristallogr . 169 : 185–200 . doi :10.1524/zkri.1984.169.14.185. S2CID 97575334.
- ^ ab Almlöf J., Kvick A., Olovsson I. (1971). «Исследования водородной связи кристаллической структуры межмолекулярного комплекса 2-пиридон-6-хлор-2-гидроксипиридина». Acta Crystallogr. B . 27 (6): 1201– 1208. doi :10.1107/S0567740871003753.
- ^ Aue DH, Betowski LD, Davidson WR, Bower MT, Beak P (1979). «Основность амидов и имидатов в газовой фазе — оценка констант протомерного равновесия методом основности в газовой фазе». Журнал Американского химического общества . 101 (6): 1361– 1368. doi :10.1021/ja00500a001.
- ^ Фрэнк Дж., Алан Р. Катритцки (1976). «Таутомерные пиридины. XV. Пиридон-гидроксипиридиновые равновесия в растворителях различной полярности». J Chem Soc Perkin Trans 2 (12): 1428– 1431. doi :10.1039/p29760001428.
- ^ Браун RS, Це А., Ведерас Дж. К. (1980). «Фотоэлектрически определяемые энергии связывания ядра и прогнозируемые основности газовой фазы для системы 2-гидроксипиридин-2-пиридон». Журнал Американского химического общества . 102 (3): 1174– 1176. doi :10.1021/ja00523a050.
- ^ Бик П. (1977). «Энергии и алкилирование таутомерных гетероциклических соединений — старые проблемы, новые ответы». Acc. Chem. Res. 10 (5): 186– 192. doi :10.1021/ar50113a006.
- ^ ab Abdulla HI, El-Bermani MF (2001). "Инфракрасные исследования таутомерии в 2-гидроксипиридине, 2-тиопиридине и 2-аминопиридине". Spectrochimica Acta Часть A: Молекулярная и биомолекулярная спектроскопия . 57 (13): 2659– 2671. Bibcode :2001AcSpA..57.2659A. doi :10.1016/S1386-1425(01)00455-3. PMID 11765793.
- ^ ab Hammes GG, Lillford PJ (1970). «Кинетическое и равновесное исследование димеризации водородных связей 2-пиридона в растворителе водородных связей». J. Am. Chem. Soc. 92 (26): 7578– 7585. doi :10.1021/ja00729a012.
- ^ ab Gilchrist, TL (1997). Гетероциклическая химия ISBN 0-470-20481-8
- ^ ab Рыбаков ВР, Буш АА, Бабаев ЭБ, Асланов ЛА (2004). "3-Циано-4,6-диметил-2-пиридон (Пиридон Гуарески)". Acta Crystallogr E. 6 ( 2): o160 – o161 . Bibcode : 2004AcCrE..60O.160R. doi : 10.1107/S1600536803029295.
- ^ аб И. Гуарески (1896). "Mem. Reale Accad. Sci. Torino II".
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ ab Baron, H., Remfry, FGP, Thorpe, JF (1904). "CLXXV.-Образование и реакции имино-соединений. Часть I. Конденсация этилцианоацетата с его натриевым производным". J. Chem. Soc., Trans . 85 : 1726– 1761. doi :10.1039/ct9048501726. Архивировано из оригинала 2020-09-14 . Получено 2020-06-05 .
- ^ ab Fischer CB, Steininger H., Stephenson DS, Zipse H. (2005). «Катализ аминолиза 4-нитрофенилацетата 2-пиридоном». Журнал физической органической химии . 18 (9): 901– 907. doi :10.1002/poc.914.
- ^ ab L.-H. Wang, H. Zipse (1996). "Бифункциональный катализ аминолиза эфиров - вычислительное и экспериментальное исследование". Liebigs Ann . 1996 (10): 1501– 1509. doi :10.1002/jlac.199619961003. Архивировано из оригинала 2021-09-01 . Получено 2021-09-01 .
- ^ ab Rawson JM, Winpenny REP (1995). «Координационная химия 2-пиридонов и их производных». Coordination Chemistry Reviews . 139 (139): 313– 374. doi :10.1016/0010-8545(94)01117-T.
- ^ ab Shima, S.; Lyon, EJ; Sordel-Klippert, M.; Kauss, M.; Kahnt, J.; Thauer, RK; Steinbach, K.; Xie, X.; Verdier, L. и Griesinger, C., «Выяснение структуры: кофактор гидрогеназы Hmd, свободной от кластеров железа и серы: структура продукта инактивации светом», Angew. Chem. Int. Ed., 2004, 43, 2547-2551.
- ^ ab Sims, Gerald K., S (1985). "Degradation of Pyridine Derivatives in Soil". Journal of Environmental Quality . 14 (4): 580– 584. Bibcode :1985JEnvQ..14..580S. doi :10.2134/jeq1985.00472425001400040022x. Архивировано из оригинала 2008-08-30.
- ^ «Пиридин-N-оксид と酸無水物との反應» [Реакция между пиридин-N-оксидом и ангидридом кислоты]. Якугаку Дзасси (на японском языке). 67 ( 3–4 ): 51–52 . 1947. doi : 10.1248/yakushi1947.67.3-4_51 .
- ^ Ochiai E (1953). «Недавние японские работы по химии пиридин 1-оксида и родственных соединений». Журнал органической химии . 18 (5): 534–551 . doi :10.1021/jo01133a010.
- ^ Boekelheide V, Lehn WL (1961). «Перегруппировка замещенных N-оксидов пиридина с уксусным ангидридом1.2». Журнал органической химии . 26 (2): 428– 430. doi :10.1021/jo01061a037.
- ^ Fischer CB, Polborn K., Steininger H., Zipse H. (2004). "Synthesis and Solid-State Structures of Alkyl-Substituted 3-Cyano-2-pyridones" (PDF) . Zeitschrift für Naturforschung . 59 (59b): 1121– 1131. doi :10.1515/znb-2004-1008. S2CID 98273691. Архивировано из оригинала (требуется подписка) 2008-10-30 . Получено 2006-11-07 .
- ^ Ensign JC, Rittenberg SC (1963). «Кристаллический пигмент, полученный из 2-гидроксипиридина с помощью arthrobacter crystallopoietes n.sp». Архив микробиологии . 47 (2): 137– 153. doi :10.1007/BF00422519. PMID 14106078. S2CID 6389661.
- ^ ab Sims GK, O'Loughlin E, Crawford R (1989). "Деградация пиридинов в окружающей среде" (PDF) . CRC Critical Reviews in Environmental Control . 19 (4): 309– 340. Bibcode :1989CRvEC..19..309S. doi :10.1080/10643388909388372. Архивировано из оригинала (PDF) 27.05.2010.
- ^ Oloughlin E, Kehrmeyer S, Sims G (1996). «Изоляция, характеристика и использование субстрата бактерией, разрушающей хинолин». International Biodegraderation & Biodegradation . 38 (2): 107– 118. Bibcode :1996IBiBi..38..107O. doi :10.1016/S0964-8305(96)00032-7.
- ^ Sims, Gerald K., O (1992). «Производство рибофлавина во время роста Micrococcus luteus на пиридине». Прикладная и экологическая микробиология . 58 (10): 3423– 3425. Bibcode :1992ApEnM..58.3423S. doi :10.1128/AEM.58.10.3423-3425.1992. PMC 183117. PMID 16348793 .
Дальнейшее чтение
Общий
- Энгдаль К., Альберг П. (1977). Журнал химических исследований : 340–341 .
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - Bensaude O, Chevrier M, Dubois J (1978). «Лактим-лактамное таутомерное равновесие 2-гидроксипиридинов. 1. Механизм связывания катионов, димеризации и взаимопревращения в апротонных растворителях. Спектроскопическое и температурно-скачковое кинетическое исследование». J. Am. Chem. Soc. 100 (22): 7055– 7066. doi :10.1021/ja00490a046.
- Bensaude O, Dreyfus G, Dodin G, Dubois J (1977). «Внутримолекулярный недиссоциативный перенос протона в водных растворах таутомерных гетероциклов: исследование кинетики температурного скачка». J. Am. Chem. Soc. 99 (13): 4438– 4446. doi :10.1021/ja00455a037.
- Bensaude O, Chevrier M, Dubois J (1978). «Влияние гидратации на таутомерное равновесие». Tetrahedron Lett. 19 (25): 2221– 2224. doi :10.1016/S0040-4039(01)86850-7.
- Hammes GG, Park AC (1969). «Кинетические и термодинамические исследования водородных связей». J. Am. Chem. Soc. 91 (4): 956– 961. doi :10.1021/ja01032a028.
- Hammes GG, Spivey HO (1966). «Кинетическое исследование димеризации водородной связи 2-пиридона». J. Am. Chem. Soc. 88 (8): 1621– 1625. doi :10.1021/ja00960a006. PMID 5942979.
- Бик П., Ковингтон Дж. Б., Смит С. Г. (1976). «Структурные исследования таутомерных систем: важность ассоциации для 2-гидроксипиридин-2-пиридона и 2-меркаптопиридин-2-тиопиридона». J. Am. Chem. Soc. 98 (25): 8284– 8286. doi :10.1021/ja00441a079.
- Бик П., Ковингтон Дж. Б., Уайт Дж. М. (1980). «Количественная модель эффектов растворителя на равновесия гидроксипиридин-пиридон и меркаптопиридин-тиопиридон: корреляция с эффектами поля реакции и водородной связи». J. Org. Chem. 45 (8): 1347– 1353. doi :10.1021/jo01296a001.
- Бик П., Ковингтон Дж. Б., Смит С. Г., Уайт Дж. М., Зейглер Дж. М. (1980). «Смещение протомерных равновесий путем самоассоциации: пары изомеров гидроксипиридин-пиридон и меркаптопиридин-тиопиридон». J. Org. Chem. 45 (8): 1354– 1362. doi :10.1021/jo01296a002.
Таутомерия
- Vögeli U., von Philipsborn W. (1973). "Исследования структуры N-метил-3-пиридона и 3-гидроксипиридина с помощью спектроскопии C-13 и H-1". Org Magn Reson . 5 (12): 551– 559. doi :10.1002/mrc.1270051202.
- Specker H., Gawrosch H. (1942). «Ультрафиолетовое поглощение бензтриаксола, приридона и его солей». Chem. Ber. (75): 1338– 1348. doi :10.1002/cber.19420751115.
- Leis DG, Curran BC (1945). «Электрические моменты некоторых гамма-замещенных пиридинов». Журнал Американского химического общества . 67 (1): 79– 81. doi :10.1021/ja01217a028.
- Альберт А., Филлипс Дж. Н. (1956). «Константы ионизации гетероциклических веществ, гидроксипроизводных азотистых шестичленных кольцевых соединений». J. Chem. Soc. : 1294– 1304. doi :10.1039/jr9560001294.
- Cox RH, Bothner-By A. A (1969). «Протонные магнитно-резонансные спектры таутомерных замещенных пиридинов и их сопряженных кислот». J. Phys. Chem . 73 (8): 2465– 2468. doi :10.1021/j100842a001.
- Aksnes DW, Kryvi, Kryvi H, Samuelson O, Sjöstrand E, Svensson S (1972). "Эффекты заместителя и растворителя в спектрах протонного магнитного резонанса (ПМР) 6 2-замещенных пиридинов". Acta Chem. Scand . 26 (26): 2255– 2266. doi : 10.3891/acta.chem.scand.26-2255 .