Перегруппировка Вольфа
| Перегруппировка Вольфа | |
|---|---|
| Назван в честь | Людвиг Вольф |
| Тип реакции | Реакция перегруппировки |
| Идентификаторы | |
| Портал органической химии | перегруппировка вольфа |
| Идентификатор онтологии RSC | Номер заказа:0000051 |
Перегруппировка Вольфа — это реакция в органической химии , в которой α-диазокарбонильное соединение превращается в кетен путем потери диазота с сопутствующей 1,2-перегруппировкой . Перегруппировка Вольфа дает кетен в качестве промежуточного продукта, который может подвергаться нуклеофильной атаке со слабокислыми нуклеофилами, такими как вода , спирты и амины , для получения производных карбоновых кислот или подвергаться реакциям циклоприсоединения [2+2] с образованием четырехчленных колец. [1] Механизм перегруппировки Вольфа был предметом дискуссий с момента ее первого использования. Ни один единый механизм не описывает реакцию в достаточной степени, и часто существуют конкурирующие согласованные и опосредованные карбеном пути; для простоты ниже показан только учебник, согласованный механизм. [2] Реакция была открыта Людвигом Вольфом в 1902 году. [3] Перегруппировка Вольфа имеет большую синтетическую полезность из-за доступности α-диазокарбонильных соединений, разнообразия реакций с промежуточным кетеном и стереохимического удержания мигрирующей группы. [2] Однако перегруппировка Вольфа имеет ограничения из-за высокореакционной природы α-диазокарбонильных соединений, которые могут подвергаться различным конкурирующим реакциям. [1]

Перегруппировка Вольфа может быть вызвана посредством термолиза [3] , фотолиза [4] или катализа переходными металлами [3] . В последнем случае реакция чувствительна к переходному металлу; оксид серебра (I) или другие катализаторы Ag(I) работают хорошо и обычно используются. Перегруппировка Вольфа использовалась во многих полных синтезах ; наиболее распространенным применением является улавливание промежуточного кетена нуклеофилами для образования производных карбоновой кислоты. Гомологация Арндта-Эйстерта является конкретным примером этого использования, в котором карбоновая кислота может быть удлинена метиленовой единицей. Другое распространенное применение - методы сокращения кольца ; если α-диазокетон является циклическим , перегруппировка Вольфа приводит к сокращению кольца продукта. Перегруппировка Вольфа хорошо работает при создании систем с кольцевым напряжением, где другие реакции могут потерпеть неудачу.
История
В 1902 году Вольф обнаружил, что обработка диазоацетофенона оксидом серебра (I) и водой приводит к образованию фенилуксусной кислоты . Аналогично, обработка оксидом серебра (I) и аммиаком приводит к образованию фенилацетамида. [3] Несколько лет спустя, в независимом исследовании, Шрётер наблюдал похожие результаты. [5] Реакцию иногда называют перегруппировкой Вольфа-Шрётера. [2] Перегруппировка Вольфа не использовалась широко в течение 20 лет после ее открытия, поскольку простой синтез диазокетонов был неизвестен до 1930-х годов. [2] Реакция оказалась полезной в синтетической органической химии, и было опубликовано множество обзоров. [1] [2]

Механизм
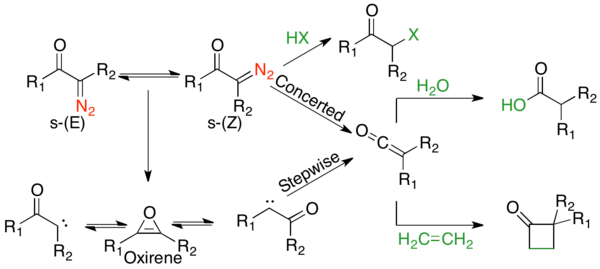
Механистический путь перегруппировки Вольфа был предметом многочисленных споров, поскольку часто существуют конкурирующие согласованные и ступенчатые механизмы. [2] Однако можно согласиться с двумя аспектами механизма. Во-первых, α-диазокарбонильные соединения находятся в равновесии s- цис и s- транс -конформеров, распределение которых может влиять на механизм реакции. Как правило, при фотолизе соединения в s- цис -конформации реагируют согласованным образом из-за антиперипланарной связи между уходящими и мигрирующими группами, тогда как соединения в s- транс -конформации реагируют ступенчато через карбеновый промежуточный продукт или не перегруппировываются. Во-вторых, независимо от механизма реакции, перегруппировка дает кетеновый промежуточный продукт, который может быть захвачен слабокислотным нуклеофилом, таким как спирт или амин , с образованием соответствующего эфира или амида, или олефина с образованием аддукта циклоприсоединения [2+2]. Сильные кислоты не перегруппировываются, а протонируют α-углерод и дают продукты S N 2 .

Стереохимия α-диазокетонов
Понимание стереохимии α-диазокетонов необходимо для выяснения механизма перегруппировки Вольфа. α-диазокарбонильные соединения, как правило, локально плоские, с большими вращательными барьерами (55–65 кДж/моль) из-за характера олефина CC между карбонилом и α-углеродом , что проиллюстрировано в самой правой резонансной структуре. [6] Такой большой барьер достаточно замедляет молекулярные вращения, чтобы привести к равновесию между двумя конформерами, s- транс и s- цис -конформером. s- цис -конформеры электронно предпочтительны из-за кулоновского притяжения между кислородом с частичным отрицательным зарядом и катионным азотом, как показано в самой правой резонансной структуре. [1] Если R 1 большой, а R 2 — водород, s- цис стерически предпочтительны. Если R 1 и R 2 большие, s- транс стерически предпочтительны; если оба заместителя достаточно велики, стерическое отталкивание может перевесить кулоновское притяжение, что приводит к предпочтению s- транс . Малые и средние циклические субстраты ограничены в s- цис -конформации.

Согласованный механизм
Когда α-диазокетон находится в s- цис -конформации, уходящая группа (N 2 ) и мигрирующая группа (R 1 ) являются антиперипланарными, что благоприятствует согласованному механизму, в котором вытеснение азота происходит одновременно с 1,2-алкильным сдвигом. Имеются доказательства того, что этот механизм происходит как в термолитических, так и в фотолитических методах, когда s- цис -конформер является сильно предпочтительным. [7]

Исследования CIDNP показывают, что фотохимическая перегруппировка диазоацетона, которая в основном существует в s- цис -конформере, является согласованной. [8] Соотношения продуктов прямого и триплет-сенсибилизированного фотолиза использовались в качестве доказательства для предложений, которые утверждают, что согласованные продукты возникают из s- цис -конформера, а ступенчатые продукты происходят через s- транс -конформер. [9]
Пошаговый механизм
s- транс -α-Диазокетоны не имеют антиперипланарной связи между уходящей и мигрирующей группой, и поэтому, как полагают, обычно перестраиваются ступенчато. Поэтапный механизм начинается с экструзии азота, образуя α-кетокарбен. α-кетокарбен может либо претерпевать 1,2-алкильный сдвиг, давая кетеновый продукт, либо может претерпевать 4π электроциклическое замыкание кольца, образуя антиароматический оксирен. Этот оксирен может повторно открываться двумя способами, либо в α-кетокарбен, который затем может образовывать кетеновый продукт.

Существует два основных аргумента в пользу ступенчатых механизмов. Первый заключается в том, что константы скорости перегруппировок Вольфа зависят от стабильности образовавшегося карбена, а не от миграционной способности мигрирующей группы. [10] Наиболее четким доказательством является изотопное перемешивание кетена, как предсказывает промежуточный оксирен, которое может происходить только в ступенчатом пути. На схеме ниже красный углерод помечен 13 C. Симметричный промежуточный оксирен может открываться в любом направлении, перемешивая метку 13 C. Если заместители R 1 и R 2 одинаковы, можно количественно определить соотношение продуктов, вытекающих из согласованного и ступенчатого механизмов; если заместители различны, оксирен будет иметь предпочтение в направлении, в котором он открывается, и соотношение не может быть количественно определено, но любое перемешивание указывает на то, что какой-то реагент проходит через ступенчатый механизм. [1] При фотолизе диазоацетальдегида 8% метки перемешаны, что указывает на то, что 16% продукта образуется через оксиреновый интермедиат. [11] При фотолизе бифенильный (R 1 =R 2 =фенил) субстрат показывает 20–30% миграции метки, что означает, что 40–60% продукта проходит через оксиреновый интермедиат. [12] α-диазоциклогексанон не показывает перестановки метки в условиях фотолиза, так как он полностью s- cis , и, таким образом, весь субстрат проходит через согласованный механизм, избегая оксиренового интермедиата. [13]

Исследования изотопной маркировки широко использовались для измерения соотношения продукта, вытекающего из согласованного механизма, по сравнению с ступенчатым механизмом. [14] Эти исследования подтверждают, что реагенты, которые предпочитают s- транс -конформации, как правило, подвергаются ступенчатой реакции. Степень перемешивания также зависит от стабильности карбена, миграционной способности и нуклеофильности растворителя. Наблюдение, что миграционная способность заместителя обратно пропорциональна количеству образованного карбена, указывает на то, что при фотолизе существуют конкурирующие пути для многих реакций Вольфа. [14] Единственные перегруппировки Вольфа, которые не показывают перемешивания, — это s -цис- ограниченные циклические α-диазокетоны. [13]
Механистический вывод
Как в термолитических, так и в фотолитических условиях существуют конкурирующие согласованные и пошаговые механизмы. Было проведено множество механистических исследований, включая конформационные, сенсибилизационные, кинетические и изотопные скремблирующие исследования. Все они указывают на конкурирующие механизмы с общими тенденциями. α-Диазокетоны, которые существуют в s- цис -конформации, как правило, подвергаются согласованному механизму, тогда как те, которые находятся в s- транс -конформации, подвергаются ступенчатому механизму. [1] α-Диазокетоны с лучшими миграционными группами предпочитают согласованный механизм. [1] Однако для всех субстратов, за исключением циклических α-диазокетонов, которые существуют исключительно в s- цис -конформации, продукты получаются из комбинации обоих путей. [1] Реакции, опосредованные переходными металлами, довольно разнообразны; однако они, как правило, предпочитают образование промежуточного соединения металл-карбен. [2] Полный механизм при фотолизе можно аппроксимировать на следующем рисунке:
Миграционные тенденции
Механизм перегруппировки Вольфа зависит от способности мигрирующей группы. Миграционные способности были определены с помощью исследований конкуренции. В целом, водород мигрирует быстрее всего, а алкильные и арильные группы мигрируют примерно с одинаковой скоростью, причем алкильные миграции предпочтительны при фотолизе, а арильные миграции предпочтительны при термолизе. [15] Влияние заместителей на арильные группы незначительно, за исключением NO 2 , который является плохим мигрантом. [15] В исследованиях конкуренции электронодефицитные алкильные, арильные и карбонильные группы не могут конкурировать с другими мигрирующими группами, но все еще компетентны. [16] [17] [18] Гетероатомы, в целом, являются плохими мигрирующими группами, поскольку их способность отдавать электронную плотность со своих p-орбиталей в связь π* C=O снижает миграционную способность. [1] Тенденция выглядит следующим образом: [1]
Фотохимические реакции: H > алкил ≥ арил >> SR > OR ≥ NR2
Термические реакции H > арил ≥ алкил (гетероатомы не мигрируют)
Получение α-диазокарбонильных соединений
Хотя перегруппировка Вольфа известна с 1902 года, она не стала синтетически полезной до начала 1930-х годов, когда стали доступны эффективные методы синтеза α-диазокарбонильных соединений. Основными способами получения этих субстратов сегодня являются процедура Арндта-Эйстерта, модификация Францена в реакцию Дейкина-Уэста и методы диазопереноса .
Процедура Арндта-Эйстерта
Реакция Арндта -Эйстерта [19] включает ацилирование диазометана хлоридом кислоты , чтобы получить первичный α-диазокетон. Углеродный конец диазометана присоединяется к карбонилу, чтобы создать тетраэдрический промежуточный продукт, который устраняет хлорид. Затем хлорид депротонирует промежуточный продукт, чтобы получить продукт α-диазокетон.

Эти α-диазокетоны нестабильны в кислых условиях, поскольку α-углерод может протонироваться HCl , а замещение азота S N 2 может происходить под действием хлорида.

Модификация Франзена для реакции Дейкина-Уэста
Реакция Дейкина–Уэста представляет собой реакцию аминокислоты с ангидридом кислоты в присутствии основания с образованием кетоамидов. Модификация Францена [20] реакции Дейкина–Уэста [21] является более эффективным способом получения вторичных α-диазокетонов. Модификация Францена нитрозирует кетоамид с помощью N 2 O 3 в уксусной кислоте , и полученный продукт реагирует с метоксидом в метаноле с образованием вторичного α-диазокетона.

Реакции диазопереноса
Реакции диазопереноса являются широко используемыми методами, в которых органический азид , обычно тосилазид, и активированный метилен (т. е. метилен с двумя отщепляющими группами) реагируют в присутствии основания, образуя α-диазо-1,3-дикетон. [22] Основание депротонирует метилен, образуя енолят , который реагирует с тосилазидом и затем разлагается в присутствии слабой кислоты, образуя α-диазо-1,3-дикетон.

Необходимое требование двух электроноакцепторных групп делает эту реакцию одной из реакций с ограниченным охватом. Охват может быть расширен до субстратов, содержащих одну электроноакцепторную группу, путем формилирования кетона через конденсацию Клайзена с последующим диазопереносом и деформилирующим переносом группы. [23]

Одним из самых больших преимуществ этого метода является его совместимость с ненасыщенными кетонами. Однако для достижения кинетической региоселективности в образовании енолята и большей совместимости с ненасыщенными карбонилами можно вызвать образование енолята с помощью гексаметилдисилазида лития и затем трифторацилировать, а не формилировать. [24]

Методы индуцирования перегруппировки
Перегруппировки Вольфа могут быть вызваны в термолитических [3] , фотолитических [4] условиях и в условиях, катализируемых переходными металлами [3] .
Термические условия для индуцирования перегруппировки требуют нагревания до относительно высоких температур, 180 ˚C, и, таким образом, имеют ограниченное применение. [3] Многие продукты перегруппировки Вольфа являются кольцевыми напряженными и подвержены раскрытию кольца при высоких температурах. Кроме того, замещение S N 2 диазогруппы у α-углерода может происходить при более низких температурах, чем перегруппировка, что приводит к побочным продуктам. Наибольшее применение термических перегруппировок Вольфа — это образование аналогов карбоновых кислот путем перехвата кетена с помощью высококипящих растворителей, таких как анилин и фенол . [3]
Переходные металлы значительно снижают температуру перегруппировок Вольфа, стабилизируя промежуточное соединение металл-карбен . Однако эти карбены могут быть настолько стабильны, что не подвергаются перегруппировке. Карбены родия , меди и палладия слишком стабильны и дают не-Вольфовские продукты (в первую очередь продукты внедрения карбена ). [2] Наиболее часто используемым металлическим катализатором является оксид серебра(I), хотя бензоат серебра также распространен. Эти реакции обычно проводятся в присутствии слабого основания, такого как карбонат натрия или третичные амины. [2]
В то время как термические и металлопосредованные перегруппировки Вольфа датируются 1902 годом, [3] фотолитические методы несколько новее, и первый пример фотолитической перегруппировки Вольфа был описан в 1951 году. [4] α-диазокетоны имеют две полосы поглощения, разрешенный переход π→π* при 240–270 нм и формально запрещенный переход π→σ* при 270–310 нм. [4] Ртутные дуговые лампы среднего или низкого давления могут возбуждать эти соответствующие переходы. Триплетные сенсибилизаторы приводят к образованию побочных продуктов, не являющихся карбенами Вольфа, и, таким образом, бесполезны в синтетических применениях перегруппировки Вольфа. [2] Однако они использовались для исследования механизма перегруппировки Вольфа.
Синтетическое использование
Перегруппировка Вольфа имеет несколько ретронов , в зависимости от реакции из промежуточного кетена. Производное карбоновой кислоты с α-метиленовой группой является ретроном для гомологизации типа Арндта-Эйстерта. Кислота, в которой α-углерод принадлежит кольцу, является ретроном для сокращения кольца перегруппировки Вольфа.

Реакции гомологизации
В реакции гомологизации Арндта-Эйстерта карбоновая кислота и тионилхлорид реагируют, образуя хлорангидрид. Затем хлорангидрид реагирует с диазометаном (R 2 = H) или иногда с диазоалкилом по методике Арндта-Эйстерта, образуя α-диазокетон, который подвергается катализируемой металлом или фотолизируемой перегруппировке Вольфа, образуя кетен. Кетен можно захватить любой слабой кислотой, такой как спирт или амин, с образованием эфира или амида. Однако наиболее распространенной формой является захват водой с образованием кислоты.

В самой базовой форме, где R 2 = H, RXH=H 2 O, реакция удлиняет алкильную цепь карбоновой кислоты метиленом. Однако существует большая синтетическая полезность в разнообразии реакций, которые можно проводить, варьируя диазоалкил и слабую кислоту. Мигрирующая группа, R 1 мигрирует с полным сохранением. [2] Очень полезное применение гомологизации Арндта-Эйстерта образует гомологированный альдегид либо путем улавливания кетена N-метиланилином и восстановления литийалюминийгидридом , либо путем улавливания кетена этантиолом и восстановления никелем Ренея . [25] [26]

В литературе существует много сотен примеров гомологизации Арндта-Эйстерта. [27] Известные примеры в общем синтезе природных продуктов включают синтезы (−)-индолизидина и (+)-макбецина. [28] [29] Недавний пример гомологизации Арндта-Эйстерта является шагом на средней стадии синтеза Сары Рейсман (+)-сальвилеукалина B. [30]

Кольцевые сокращения
Если реагентом является циклический α-диазокетон, то продукты перегруппировки Вольфа будут представлять собой продукт с одноуглеродным кольцом. Эти реакции обычно согласованы из-за s- цис -конформации и фотокатализируются. Реакция ниже показывает согласованный механизм для сокращения кольца α-диазоциклогексанона с последующим захватом кетена слабокислотным нуклеофилом.

Первым известным примером является продукт перегруппировки Вольфа с сокращенным кольцом α-диазокамфоры и последующая кинетическая гидратация кетена из более стерически доступной «эндо»-грани с образованием экзо -1,5,5-триметилбицикло[2.1.1]гексан-6-карбоновой кислоты. [31]

Сокращение колец широко использовалось для создания напряженных кольцевых систем, поскольку размер кольца не препятствует перегруппировке Вольфа, но часто препятствует другим реакциям. Существует много примеров, когда перегруппировка Вольфа используется для сжатия циклопентанона в циклобутан. [32] Перегруппировка обычно используется для образования напряженных бициклических и конденсированных с кольцом систем. Существует несколько примеров сокращения колец от циклобутанонов до циклопропанов. [33] Перегруппировка Вольфа способна сокращать циклогексаноны до циклопентанов, но используется для этого нечасто, поскольку перегруппировка Фаворского осуществляет это преобразование, а предшественник Вольфа часто сложнее синтезировать. [2] Однако примером сокращения циклогексанонового кольца с использованием деформилирующего диазопереноса, за которым следует перегруппировка Вольфа, является синтез (±)-∆ 9(12) -капнеллена, выполненный Кейитиро Фукумото. [34]

Реакции циклоприсоединения
Кетеновые промежуточные соединения, полученные посредством перегруппировки Вольфа, как хорошо известно, подвергаются [2 + 2] термическим циклоприсоединениям с олефинами с образованием четырехчленных колец как в межмолекулярных, так и в внутримолекулярных реакциях, примеры обоих приведены ниже. [35] [36] [37] Кетены способны подвергаться тому, что обычно считается запрещенной реакцией [2 + 2] циклоприсоединения, поскольку кетен действует антарафактическим образом, что приводит к разрешенному Вудвордом-Хоффманном [π s 2 + π a 2 ] циклоприсоединению. [36] Кетеновые [2 + 2] циклоприсоединения могут быть сложными реакциями и давать плохие выходы из-за конкурирующих процессов. Высокоэнергетический альдокетен очень реакционноспособен и будет циклизоваться с исходным материалом диазокетона с образованием бутенолидов и пиразолов . [2]
![Межмолекулярные и внутримолекулярные кетеновые [2+2] циклоприсоединения](http://upload.wikimedia.org/wikipedia/commons/thumb/2/22/WolffF23.png/500px-WolffF23.png)
Реакции циклоприсоединения кетена [2 + 2] использовались во многих полных синтезах с тех пор, как Кори использовал циклизацию [2 + 2] при синтезе простагландинов. [35] Синтез (±)-афидиколина Робертом Айрлендом использует перегруппировку Вольфа для выполнения тандемного сокращения кольца и циклоприсоединения [2 + 2]. [38]

Бензаннуляция Данхайзера фотолизует α-диазокетоны и захватывает алкин, который подвергается перициклическому каскаду, в конечном итоге образуя универсально замещенные фенолы. [39] Первым шагом в бензаннуляции является фотолиз α-диазокетона с образованием винилкетена. Затем винилкетен подвергается [2 + 2] циклоприсоединению с алкином с образованием 2-винилциклобутенона, который осуществляет 4π электроциклическое раскрытие кольца с образованием диенилкетена. Затем диенилкетен подвергается 6π электроциклическому закрытию кольца с последующей таутомеризацией с образованием фенольного бензаннулированного продукта.

Виниловые перегруппировки Вольфа
Виниловая перегруппировка Вольфа состоит из β,γ-ненасыщенного диазокетона, подвергающегося перегруппировке Вольфа, и формального 1,3-сдвига группы CH 2 CO 2 R. Виниловая перегруппировка Вольфа дает производное γ,δ-ненасыщенной карбоновой кислоты, которое является тем же ретроном, что и для перегруппировки Кляйзена . Вариант был обнаружен, когда было замечено, что термолиз 1-диазо-3,3,3-триарилпропан-2-онов дает неожиданные изомерные продукты. [40]

Соли меди (II) и родия (II) имеют тенденцию давать винилогичные продукты перегруппировки Вольфа, а CuSO 4 и Rh 2 (OAc) 4 являются наиболее часто используемыми катализаторами. [41] Это связано с тем, что они способствуют образованию металлического карбена, который может присоединяться к олефину с образованием циклопропана, который может снова открываться через ретро [2 + 2] с образованием формально 1,3-смещенного кетена (по сравнению с обычным перегруппированным кетеном Вольфа), который может быть захвачен нуклеофилом с образованием винилогичного продукта Вольфа. [42]

Смотрите также
Ссылки
- ^ abcdefghij Kirmse, W. (2002). "100 лет перегруппировке Вольфа". Eur. J. Org. Chem . 2002 (14): 2193. doi :10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D.
- ^ abcdefghijklm Gill, GB (1991) «Перегруппировка Вольфа». в Trost, BM Flemming, I. (ред.) Comp. Org. Synth. Oxford: Pergamon. 3:887. doi :10.1016/B978-0-08-052349-1.00085-8. ISBN 978-0-08-052349-1
- ^ abcdefghi Вольф, Л. (1902). «Уэбер Диазоангидрид». Юстус Либигс Энн. Хим . 325 (2): 129–195. дои : 10.1002/jlac.19023250202.
- ^ abcd Хорнер, Л. Спитшка, Э. Гросс, AW (1951). «Zur Kenntnis der Umlagerungsvorgänge bei Diazo-ketonen, o-Chinondiaziden und Säureaziden». Юстус Либигс Энн. Хим . 573 : 17–30. дои : 10.1002/jlac.19515730103.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Шретер, Г. (1909). «Über die Hofmann-Curtiussche, die Beckmannsche und die Benzilsäure-Umlagerung». хим. Бер . 42 (2): 2336–2349. дои : 10.1002/cber.190904202131.
- ^ Pecile, C. Foffani, F. Chersetti, S. (1964). «Взаимодействие диазокарбонильных соединений с гидроксильными растворителями». Tetrahedron . 20 (4): 823–829. doi :10.1016/S0040-4020(01)98414-5.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Каплан, Ф. Мелой, ГК (1966). «Структура диазокетонов. Исследование затрудненного внутреннего вращения1,2». J. Am. Chem. Soc . 88 (5): 950–956. doi :10.1021/ja00957a017.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Рот, HD Манион, ML (1976). «Фотохимия раствора диазоацетона. Перегруппировка Вольфа и ацетилметилен». J. Am. Chem. Soc . 98 (11): 3392–3393. doi :10.1021/ja00427a067.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Томиока, Х. Окуно, Х. Кондо, С. Идзава, И. (1980). «Прямые доказательства взаимопревращения кетокарбен-кетокарбен». J. Am. Chem. Soc . 102 (23): 7123–7125. doi :10.1021/ja00543a050.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Регитц, М.В., Барц. (1970). «Untersuchungen an Diazoverbindungen, VII. Vergleichende kinetische Untersuchungen zur thermischen Stabilität aliphatischer Diazoverbindungen». хим. Бер . 103 (5): 1477–1485. дои : 10.1002/cber.19701030519.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Целлер, КП (1977). «Zur formylcarben-oxiren-isomerisierung». Буквы тетраэдра . 18 (8): 707–708. дои : 10.1016/S0040-4039(01)92732-7.
- ^ Целлер, К.П. Мейер, Х. Колсхорн, Х. Мюллер, Э. (1972). «Zum Mechanismus der Wolff-Umlagerung». хим. Бер . 105 (6): 1875–1886. дои : 10.1002/cber.19721050610.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ аб Тимм, У. Зеллер, К. П. Мейер, Х. (1977). «Фотолиз 2-оксо-[2-13 c ]-1-диазоциклогексана. Ein beitrag zum оксирен-проблема». Тетраэдр . 33 (4): 453–455. дои : 10.1016/0040-4020(77)80104-X.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ ab Fenwick, J. Frater, G. Ogi, K. Strausz, OP (1973). "Механизм перегруппировки Вольфа. IV. Роль оксирена в фотолизе .альфа.-диазокетонов и кетенов". J. Am. Chem. Soc . 95 : 124–132. doi :10.1021/ja00782a021.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Аб Зеллер, К. П. Мейер, Х. Мюллер, Э. (1972). «Untersuchungen zur Wolff-Umlagerung — II». Тетраэдр . 28 (23): 5831–5838. дои : 10.1016/S0040-4020(01)88926-2.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Уайлдс, А. Л. Мидер, А. Л. (1948). «Использование высших диазоуглеводородов в синтезе Арндта-Эйстерта». J. Org. Chem . 13 (5): 763–79. doi :10.1021/jo01163a024. PMID 18884425.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Галлуччи, Р. Р. Джонс, М. младший (1985). «Фотолиз метил 3-диазо-2-оксопропионата. Миграция Вольфа карбометоксигруппы». J. Org. Chem . 50 (22): 4404–4405. doi :10.1021/jo00222a047.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Вейганд, Ф. Дворшак, Х. Кох, К. Констас, С. (1961). «Реакции трифторацетил-карбатокси-карбенов II. Mitteilung». Энджью. Хим . 73 (11): 409. Бибкод : 1961АнгЧ..73..409W. дои : 10.1002/ange.19610731116.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Арндт, Ф. Эйстерт, Б. Партале, В. (1927). «Диазо-метан ундо-Nitroverbindungen, II.:N-окси-изоатин аусо-нитробензоилхлорид». хим. Бер . 60 (6): 1364–1370. дои : 10.1002/cber.19270600616.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Франзен, В. (1957). «Eine neue Methode zur Darstellung α,β-ungesättiger Ketone. Zerfall der Diazoketone R—CO—CN 2 —CH 2 —R’». Юстус Либигс Аннален дер Хими . 602 : 199. doi : 10.1002/jlac.19576020116.
- ^ Дейкин, HD Уэст, Р. (1928). «Общая реакция аминокислот». J. Biol. Chem . 78 : 91–104. doi : 10.1016/S0021-9258(18)84021-2 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Регитц, М. Лидхегенер, А. (1966). «Reaktionen aktiver Mmethylenverbindungen mit Aziden, XII. Синтез диацил-диазометана в диазогруппах». хим. Бер . 99 (10): 3128–3147. дои : 10.1002/cber.19660991010.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Регитц, М. Рютер (1968). «Reaktionen CH-aktiver Verbindungen mit Aziden, XVIII. Синтез 2-оксо-1-диазо-циклоалканов в условиях диазогруппы-Übertragung». Дж. Хим. Бер . 101 (4): 1263–1270. дои : 10.1002/cber.19681010419.
- ^ Данхайзер, Р. Л .; Миллер, Р. Ф.; Брисбуа, Р. Г.; Парк, С. З. (1990). «Улучшенный метод синтеза .альфа.-диазокетонов». J Org Chem . 55 (6): 1959. doi :10.1021/jo00293a053.
- ^ Вейганд, Ф. Бестманн, HJ (1960). «Neuere präparative Methoden der Organischen Chemie III. Synthesen unter Verwendung von Diazoketonen». Энджью. Хим . 72 (16): 535–554. Бибкод : 1960AngCh..72..535W. дои : 10.1002/ange.19600721602.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Вейганд, Ф. Бестманн, HJ (1959). «Гомолог альдегида из карбонсаурена». хим. Бер . 92 (3): 528–529. дои : 10.1002/cber.19590920303.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Тао, И. МакКерви, МА (1994). «Органический синтез с .альфа.-диазокарбонильными соединениями». Chem. Rev. 94 ( 4): 1091–1160. doi :10.1021/cr00028a010.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Джеффорд, CW Тан, Q. Заслона, A. (1991). «Короткие энантиогенные синтезы (−)-индолизидина 167B и (+)-мономорина». J. Am. Chem. Soc . 113 (9): 3513–3518. doi :10.1021/ja00009a043.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Эванс, ДА Миллер, СДЖ Эннис, МД (1993). «Асимметричный синтез бензохиноидных ансамициновых противоопухолевых антибиотиков: полный синтез (+)-макбецина». J. Org. Chem . 58 (2): 471–485. doi :10.1021/jo00054a035.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Левин, С. Нани, Р. Р. Рейсман, С. Э. (2011). «Энантиоселективный полный синтез (+)-сальвилеукалина B» (PDF) . J. Am. Chem. Soc . 133 (4): 774–6. doi :10.1021/ja110192b. PMID 21174417.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Хорнер, Л. Спитшка, Э. (1955). «Über Lichtreaktionen IV 1) : Производное бицикло-[1.1.2]-гексана как Ergebnis der Umlagerung des Diazocamphers im Licht». хим. Бер . 88 (7): 934–939. дои : 10.1002/cber.19550880705.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Лоу, Г. Ридли, Д. Д. (1973). «Синтез α-лактамов фотолитической перегруппировкой Вольфа». J. Chem. Soc., Chem. Commun . 17 (10): 328–329. doi :10.1039/c39730000328. PMID 4799188.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ueda, K. Toda, F. (1975). «Перегруппировка Вольфа 2-диазо-3,4-бис(дифенилметилен)циклобутмона в 1,2-бис(дифенилметилен)циклопропмы». Chem. Lett . 4 (7): 779–780. doi :10.1246/cl.1975.779.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ихара, М. Сузуки, Т. Катоги, М. Танигучи, Н. Фукумото, К. (1991). "Стереоселективный полный синтез (±)-Δ 9(12) -капнеллена с помощью внутримолекулярного подхода Дильса–Альдера". J. Chem. Soc. Chem. Commun. (9): 646–647. doi :10.1039/c39910000646.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ ab Corey, EJ Arnold, Z. Hutton, J. (1970). "Полный синтез простагландинов E2 и F2α () через трикарбоциклический промежуточный продукт". Tetrahedron Lett . 11 (4): 307–310. doi :10.1016/S0040-4039(00)61815-4. PMID 5414677.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ ab DoMinh, T. Strausz, OP (1970). «Циклическое присоединение этоксикетена к олефинам». J. Am. Chem. Soc . 92 (6): 1766–1768. doi :10.1021/ja00709a062.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Беккер, Д. Бирнбаум, Д. (1980). «Внутримолекулярное фотоприсоединение кетенов к сопряженным циклоалкенонам». J. Org. Chem . 45 (4): 570–578. doi :10.1021/jo01292a004.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ирландия, RE Dow, WC Godfrey, JD Thaisrivongs, S. (1984). "Полный синтез (.+-.)-афидиколина и (.+-.)-.beta.-chamigrene". J. Org. Chem . 49 (6): 1001–1013. doi :10.1021/jo00180a010.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Danheiser, RL Brisbois, RG Kowalczyk, JJ Miller, RF (1990). «Метод аннелирования для синтеза высокозамещенных полициклических ароматических и гетероароматических соединений». J. Am. Chem. Soc . 112 (8): 3093–3100. doi :10.1021/ja00164a033.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Уайлдс, А. Л. ван ден Берге, Дж. Уайнсток, К. Х. фон Требра, Р. Л. Вулси, Н. Ф. (1962). «Аномальные кислоты из синтеза Арндта-Эйстерта». Дж. Ам. хим. Соц . 84 (8): 1503–1504. дои : 10.1021/ja00867a044.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Смит, AB III, Тодер, Б.Х., Бранка, SJ (1984). «Винологическая перегруппировка Вольфа. 4. Общая реакция бета, гамма-ненасыщенных альфа'-диазокетонов». Дж. Ам. хим. Соц . 106 (14): 3995–4001. дои : 10.1021/ja00326a018.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Циммерман, Х. Э. Литтл, Р. Д. (1974). «Механистическая и исследовательская органическая фотохимия. LXXXVII. Фотохимическая перегруппировка 4-арилзамещенных циклопентенонов. Низкотемпературная фотохимия и прямое наблюдение промежуточных продуктов реакции». J. Am. Chem. Soc . 96 (14): 4623–4630. doi :10.1021/ja00821a044.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )