Септин
| Белок, связывающий деление клеток/ГТФ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Cell_Div_GTP_bd | ||||||||
| Пфам | ПФ00735 | ||||||||
| Клан ПФАМ | CL0023 | ||||||||
| ИнтерПро | IPR000038 | ||||||||
| |||||||||
Септины представляют собой группу ГТФ - связывающих белков, экспрессируемых во всех эукариотических клетках , за исключением растений . [1] [2] [3] Различные септины образуют белковые комплексы друг с другом. Эти комплексы могут далее собираться в нити, кольца и сетки. Собранные таким образом, септины функционируют в клетках, локализуя другие белки , либо предоставляя каркас, к которому могут прикрепляться белки, либо образуя барьер, препятствующий диффузии молекул из одного отсека клетки в другой, [2] [3] [4] [5] или в коре клетки в качестве барьера для диффузии мембраносвязанных белков. [6]
Септины участвуют в локализации клеточных процессов в месте деления клетки и в клеточной мембране в местах, где специализированные структуры, такие как реснички или жгутики, прикреплены к телу клетки. [4] В дрожжевых клетках они разделяют части клетки и строят каркас для обеспечения структурной поддержки во время деления клетки в перегородке , от которой они и получили свое название. [3] Исследования на человеческих клетках показывают, что септины строят клетки вокруг патогенных бактерий , которые иммобилизуют и не дают им проникать в другие клетки. [7]
Как белки, образующие филаменты, септины можно считать частью цитоскелета . [ 4] Помимо формирования неполярных филаментов, септины связываются с клеточными мембранами , клеточным кортексом, актиновыми филаментами и микротрубочками . [4] [6]
Структура
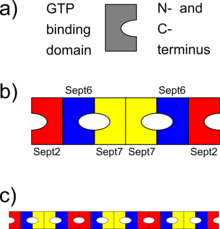
b) схема гетерогексамерного комплекса септинов (человеческих септинов), где различные септины связываются друг с другом через свои домены связывания ГТФ или через N и C концы. Обратите внимание на симметрию комплекса
c) схема того, как комплексы септинов могут выстраиваться, образуя септиновые нити
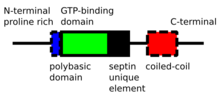
Септины — это белки P-Loop -NTPase , масса которых варьируется от 30 до 65 кДа. Септины высококонсервативны у разных видов эукариот. Они состоят из N-конца переменной длины, богатого пролином , с основным мотивом связывания фосфоинозитида, важным для мембранной ассоциации, домена связывания GTP , высококонсервативного домена уникального элемента септина и C-концевого расширения, включающего домен спиральной спирали различной длины. [4]
Септины взаимодействуют либо через соответствующие им домены связывания ГТФ, либо через оба своих N- и C-конца. Различные организмы экспрессируют разное количество септинов, и из них образуются симметричные олигомеры. Например, у дрожжей образуется октамерный комплекс Cdc11-Cdc12-Cdc3-Cdc10-Cdc10-Cdc3-Cdc12-Cdc11. [8] У людей возможны гексамерные или октамерные комплексы. Первоначально было указано, что человеческий комплекс был Sept7-Sept6-Sept2-Sept2-Sept6-Sept7; [9] но недавно этот порядок был пересмотрен на Sept2-Sept6-Sept7-Sept7-Sept6-Sept2 [10] (или Sept2-Sept6-Sept7-Sept3-Sept3-Sept7-Sept6-Sept2 [11] в случае октамерных гетероолигомеров). Затем эти комплексы объединяются, образуя неполярные нити, пучки нитей, клетки или кольцевые структуры в клетках. [4]
Происшествие
Септины обнаружены у грибов , животных и некоторых эукариотических водорослей , но не обнаружены у растений. [1]
| Разновидность | Группа ( филогенетическая ) | Гены септина | |
|---|---|---|---|
| Грибы | Сахаромицеты cerevisiae | Cdc3 | Cdc3 |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, Shs1, Spr28 | ||
| Cdc12 | Cdc12, Spr3 | ||
| Schizosaccharomyces pombe | Спн1 | Спн1 | |
| Спн2 | Спн2 | ||
| Спн3 | Спн3, Спн5, Спн7 | ||
| Спн4 | Спн4, Спн6 | ||
| Кандида альбиканс | Cdc3 | Cdc3 | |
| Cdc10 | Cdc10 | ||
| Cdc11 | Cdc11, 7 сентября, 28 апреля | ||
| Cdc12 | Cdc12, Spr3 | ||
| Аспергиллы нидуланс | АспД | АспД | |
| АспБ | АспБ | ||
| АспА | АспА | ||
| АспС | АспС | ||
| АСПЕ | АСПЕ | ||
| Животные | Люди | 2 сентября | 1 сентября, 2 сентября, 4 сентября, 5 сентября |
| 3 сентября | 3 сентября, 9 сентября, 12 сентября | ||
| 6 сентября | 6 сентября, 8 сентября, 10 сентября, 11 сентября, 14 сентября | ||
| 7 сентября | Sept7 (Sept13 как псевдоген) [4] | ||
| Caenorhabditis elegans | UNC-59 | UNC-59 | |
| UNC-61 | UNC-61 |
В дрожжах

• Зеленый: септины ( AgSEP7- GFP )
• Красный: контур клетки ( фазовый контраст )
• Масштабная линейка: 10 мкм
В Saccharomyces cerevisiae существует семь различных септинов . Пять из них участвуют в митозе, а два (Spr3 и Spr28) специфичны для споруляции . [2] [3] Митотические септины (Cdc3, Cdc10, Cdc11, Cdc12, Shs1) образуют кольцевую структуру на шейке почки во время деления клетки . [2] [4] Они участвуют в выборе места почки, позиционировании митотического веретена , поляризованном росте и цитокинезе . Спорулирующие септины (Spr3, Spr28) локализуются вместе с Cdc3 и Cdc11 на краях мембран проспор. [2]
Организация
Септины образуют специализированную область в коре клетки, известную как септиновый кортекс. [12] Септиновый кортекс претерпевает несколько изменений на протяжении клеточного цикла : Первая видимая септиновая структура представляет собой отчетливое кольцо, которое появляется примерно за 15 минут до появления почки . После появления почки кольцо расширяется, принимая форму песочных часов вокруг шейки материнской почки. Во время цитокинеза септиновый кортекс разделяется на двойное кольцо, которое в конечном итоге исчезает. Как септиновый кортекс может претерпевать такие драматические изменения, хотя некоторые из его функций могут требовать, чтобы он был стабильной структурой? Анализ FRAP показал, что оборот септинов в шейке претерпевает множественные изменения на протяжении клеточного цикла . Преобладающая функциональная конформация характеризуется низкой скоростью оборота (замороженное состояние), во время которого септины фосфорилируются . Структурные изменения требуют дестабилизации септинового кортекса (жидкое состояние), вызванной дефосфорилированием до появления почек , расщепления кольца и разделения клеток . [3]
Состав септиновой коры меняется не только на протяжении клеточного цикла , но и вдоль оси мать-почка. Эта полярность септиновой сети позволяет концентрировать некоторые белки в первую очередь на материнской стороне шейки, некоторые в центре, а другие в месте почки .
Функции
Строительные леса
Септины действуют как каркас, привлекая множество белков . Эти белковые комплексы участвуют в цитокинезе , отложении хитина , полярности клеток , образовании спор , в контрольной точке морфогенеза , контрольной точке выравнивания веретена и выборе места почки.
Цитокинез
Цитокинез почкующихся дрожжей осуществляется посредством двух зависимых от септина избыточных процессов: рекрутирование и сокращение актомиозинового кольца и образование перегородки путем слияния везикул с плазматической мембраной . В отличие от мутантов септинов , нарушение одного единственного пути приводит только к задержке цитокинеза , а не к полному отказу от деления клеток . Следовательно, предполагается, что септины действуют на самом верхнем уровне цитокинеза .
Полярность клеток
После изотропно - апикального переключения в почкующихся дрожжах кортикальные компоненты, предположительно экзоцисты и полярисомы, делокализованы от апикального полюса ко всей плазматической мембране почки, но не материнской клетки. Септиновое кольцо на шейке служит кортикальным барьером, который предотвращает мембранную диффузию этих факторов между двумя отсеками. Это асимметричное распределение отменяется у мутантов септина .
Некоторые условные мутанты септинов не образуют почки в их нормальном осевом положении. Более того, типичная локализация некоторых факторов выбора места почки в двойном кольце на шейке у этих мутантов утрачена или нарушена . Это указывает на то, что септины могут служить местом закрепления для таких факторов в аксиально почковавшихся клетках.
У нитчатых грибов
С момента их открытия в S. cerevisiae гомологи септинов были обнаружены в других эукариотических видах, включая нитчатые грибы . Септины в нитчатых грибах демонстрируют множество различных форм в пределах отдельных клеток , где они контролируют аспекты нитчатой морфологии . [13] [14]
Кандида альбиканс
Геном C. albicans кодирует гомологи всех септинов S. cerevisiae . Без генов Cdc3 и Cdc12 Candida albicans не может размножаться, другие септины влияют на морфологию и отложение хитина , но не являются необходимыми. Candida albicans может демонстрировать различные морфологии вегетативного роста, которые определяют появление септовых структур. Вновь образующиеся гифы образуют септиновое кольцо у основания, двойные кольца образуются в местах гифальной септизации, а септиновый колпачок образуется на кончиках гиф. Удлиненные септиновые нити окружают сферические хламидоспоры . Двойные кольца септинов в месте септизации также несут полярность роста, при этом растущее верхушечное кольцо разбирается, в то время как базальное кольцо остается нетронутым. [13]
Аспергиллы нидуланс
Пять септинов обнаружены в A. nidulans (AnAspAp, AnAspBp, AnAspCp, AnAspDp, AnAspEp). AnAspBp образует одиночные кольца в местах септирования, которые в конечном итоге разделяются на двойные кольца. Кроме того, AnAspBp образует кольцо в местах появления ветвей, которое расширяется в полосу по мере роста ветви. Как и в C. albicans , двойные кольца отражают полярность гифы . В случае Aspergillus nidulans полярность передается путем разборки более базального кольца (кольца, расположенного дальше от кончика роста гифы), оставляя апикальное кольцо нетронутым, потенциально как сигнал направления роста. [2] [13]
Ashbya gossypii

• Красный: контур клетки ( фазовый контраст )
• Вкладка: 3D-реконструкция прерывистого септинового кольца
• Масштабные линейки: 10 мкм
Аскомицет A. gossypii обладает гомологами всех септинов S. cerevisiae , один из которых дублируется ( AgCDC3, AgCDC10, AgCDC11A, AgCDC11B, AgCDC12, AgSEP7 ). Исследования AgSep7p- GFP in vivo показали, что септины собираются в прерывистые гифальные кольца вблизи растущих кончиков и мест формирования ветвей [2] и в асимметричные структуры у основания точек ветвления. Кольца состоят из нитей , которые длинные и диффузные вблизи растущих кончиков и короткие и компактные дальше от кончика. Во время формирования септы септиновое кольцо разделяется на два, образуя двойное кольцо. Мутанты делеции Agcdc3Δ, Agcdc10Δ и Agcdc12Δ демонстрируют аберрантную морфологию и дефектны в образовании актинового кольца, хитинового кольца и споруляции . Из-за отсутствия септ мутанты делеции септинов очень чувствительны, и повреждение одной гифы может привести к полному лизису молодого мицелия .
У животных
В отличие от септинов в дрожжах и в отличие от других компонентов цитоскелета животных, септины не образуют непрерывную сеть в клетках, а несколько рассеянных в цитоплазме клеточного кортекса . Они интегрированы с актиновыми пучками и микротрубочками . Например, связывающий актин белок анилин необходим для правильного пространственного контроля организации септинов. [5] В сперматозоидах млекопитающих септины образуют стабильное кольцо, называемое кольцом , в хвосте. У мышей (и, возможно, также у людей) дефектное образование кольца приводит к мужскому бесплодию. [4] [5]
Человек
У людей септины участвуют в цитокинезе , формировании ресничек и нейрогенезе посредством способности привлекать другие белки или служить барьером диффузии. Существует 13 различных человеческих генов, кодирующих септины. Септины-белки, продуцируемые этими генами, сгруппированы в четыре подсемейства, каждое из которых названо в честь своего основателя: (i) SEPT2 ( SEPT1 , SEPT4 , SEPT5 ), (ii) SEPT3 ( SEPT9 , SEPT12 ), (iii) SEPT6 ( SEPT8 , SEPT10 , SEPT11 , SEPT14 ) и (iv) SEPT7 . Комплексы белков септинов собираются с образованием либо гетерогексамеров ( включающих мономеры, выбранные из трех различных групп, и мономер из каждой группы присутствует в двух копиях; 3 x 2 = 6), либо гетерооктамеров ( мономеры из четырех различных групп, каждый мономер присутствует в двух копиях; 4 x 2 = 8). Эти гетероолигомеры в свою очередь образуют структуры более высокого порядка, такие как нити и кольца. [4] [5] [1]
Септины образуют клетки-подобные структуры вокруг бактериальных патогенов , обездвиживая вредных микробов и не давая им проникать в здоровые клетки. Эта клеточная система защиты потенциально может быть использована для создания методов лечения дизентерии и других заболеваний . Например, Shigella — это бактерия , вызывающая смертельную диарею у людей. Для распространения от клетки к клетке бактерии Shigella вырабатывают актин - полимерные «хвосты», которые продвигают микробы и позволяют им проникать в соседние клетки-хозяева. В рамках иммунного ответа клетки человека вырабатывают сигнальный белок клетки, называемый TNF-α , который запускает толстые пучки септиновых нитей, чтобы окружить микробов внутри инфицированной клетки-хозяина. [15] Микробы, которые попадают в эти септиновые клетки, разрушаются путем аутофагии . [16] Нарушения в септинах и мутации в генах , которые их кодируют, могут быть связаны с возникновением лейкемии , рака толстой кишки и нейродегенеративных заболеваний, таких как болезнь Паркинсона и болезнь Альцгеймера . Потенциальные методы лечения этих заболеваний, а также бактериальных заболеваний, таких как дизентерия, вызванная Shigella , могут усилить иммунную систему организма с помощью препаратов , которые имитируют поведение TNF-α и позволяют клеткам септинов размножаться. [7]
Caenorhabditis elegans
У нематодного червя Caenorhabditis elegans есть два гена, кодирующих септины, и комплексы септинов содержат два разных септина в тетрамерном комплексе UNC59-UNC61-UNC61-UNC59. Септины у C.elegans концентрируются в борозде деления и срединном теле веретена во время деления клетки . Септины также участвуют в миграции клеток и управлении аксонами у C.elegans . [2]
В митохондриях
Септин, локализованный в митохондриях, называется митохондриальным септином (М-септином). Он был идентифицирован как белок, взаимодействующий с CRMP /CRAM в развивающемся мозге крысы. [17]
История
Септины были открыты в 1970 году Леландом Х. Хартвеллом и коллегами в скрининге температурно-чувствительных мутантов, влияющих на деление клеток (мутанты cdc) у дрожжей ( Saccharomyces cerevisiae ). Скрининг выявил четыре мутанта, которые предотвращали цитокинез при ограничительной температуре. Соответствующие гены представляют четыре исходных септина, ScCDC3, ScCDC10, ScCDC11 и ScCDC12 . [3] [4] Несмотря на нарушенный цитокинез, клетки продолжали почковаться , синтез ДНК и ядерное деление , что приводило к образованию крупных многоядерных клеток с множественными удлиненными почками. В 1976 году анализ электронных микрофотографий выявил ~20 равномерно расположенных полос из 10-нм нитей вокруг шейки материнской почки в клетках дикого типа, но не в клетках с мутантным септином. [3] [4] [13] Исследования иммунофлуоресценции показали, что белки септинов колокализованы в септиновое кольцо в области шейки. [4] [13] Локализация всех четырех септинов нарушена в условных мутантах Sccdc3 и Sccdc12 , что указывает на взаимозависимость белков септинов. Серьезное подтверждение этому выводу было получено в ходе биохимических исследований: четыре исходных септина были совместно очищены на аффинных колонках вместе с пятым белком септинов, кодируемым ScSEP7 или ScSHS1 . Очищенные септины из почкующихся дрожжей, Drosophila , Xenopus и клеток млекопитающих способны самоассоциироваться in vitro с образованием нитей. [13] То, как септины взаимодействуют in vitro с образованием гетероолигомеров , которые собираются в нити, было подробно изучено на S. cerevisiae .
Микрофотографии очищенных нитей выявили возможность того, что септины организованы параллельно оси материнского почка. 10-нм полосы, видимые на электронных микрофотографиях, могут быть результатом латерального взаимодействия между нитями. Мутантные штаммы, лишенные факторов, важных для организации септинов, подтверждают эту точку зрения. Вместо непрерывных колец септины образуют полосы, ориентированные вдоль оси материнского почка в делеционных мутантах ScGIN4, ScNAP1 и ScCLA4 .
Ссылки
- ^ abc Neubauer, K; Zieger, B (2017). "The Mammalian Septin Interactome". Frontiers in Cell and Developmental Biology . 5 : 3. doi : 10.3389/fcell.2017.00003 . PMC 5293755. PMID 28224124.
- ^ abcdefghi Weirich CS, Erzberger JP, Barral Y (2008). «Семейство септинов ГТФаз: архитектура и динамика». Nat. Rev. Mol. Cell Biol . 9 (6): 478– 89. doi :10.1038/nrm2407. PMID 18478031. S2CID 2640351.
- ^ abcdefg Douglas LM, Alvarez FJ, McCreary C, Konopka JB (2005). "Функция септинов в модельных системах дрожжей и патогенных грибах". Eukaryotic Cell . 4 (9): 1503– 12. doi :10.1128/EC.4.9.1503-1512.2005. PMC 1214204. PMID 16151244 .
- ^ abcdefghijklm Mostowy S, Cossart P (2012). «Септины: четвертый компонент цитоскелета». Nat. Rev. Mol. Cell Biol . 13 (3): 183–94 . doi :10.1038/nrm3284. PMID 22314400. S2CID 2418522.
- ^ abcd Киносита М (2006). «Разнообразие септиновых каркасов». Curr. Opin. Cell Biol . 18 (1): 54– 60. doi :10.1016/j.ceb.2005.12.005. PMID 16356703.
- ^ ab Bridges, AA; Gladfelter, AS (10 июля 2015 г.). «Форма и функция септина в коре клетки». Журнал биологической химии . 290 (28): 17173– 80. doi : 10.1074/jbc.R114.634444 . PMC 4498057. PMID 25957401 .
- ^ ab Mascarelli A (декабрь 2011 г.). «Септиновые белки берут в плен бактерий: клеточная защита от микробных патогенов имеет терапевтический потенциал». Nature . doi : 10.1038/nature.2011.9540 . S2CID 85080734.
- ^ Bertin, A.; McMurray, MA; Grob, P.; Park, S.-S.; Garcia, G.; Patanwala, I.; Ng, H.-l.; Alber, T.; Thorner, J.; Nogales, E. (2008-06-12). "Септины Saccharomyces cerevisiae: супрамолекулярная организация гетероолигомеров и механизм сборки филаментов". Труды Национальной академии наук . 105 (24): 8274– 8279. Bibcode : 2008PNAS..105.8274B. doi : 10.1073/pnas.0803330105 . ISSN 0027-8424. PMC 2426963 . PMID 18550837.
- ^ Сираджуддин, Минхаджуддин; Фаркасовски, Мариан; Хауэр, Флориан; Кюльманн, Дороти; Макара, Ян Г.; Вейанд, Майкл; Старк, Хольгер; Виттингхофер, Альфред (18 июля 2007 г.). «Структурное понимание формирования филаментов септинов млекопитающих». Nature . 449 (7160): 311– 315. Bibcode :2007Natur.449..311S. doi :10.1038/nature06052. ISSN 0028-0836. PMID 17637674.
- ^ Мендонса, Дебора К.; Маседо, Джочи Н.; Гимарайнш, Сэмюэл Л.; Баррозу да Силва, Фернандо Л.; Кассаго, Александр; Гарратт, Ричард К.; Португалия, Родриго В.; Араужо, Ана П.У. (сентябрь 2019 г.). «Пересмотренный порядок субъединиц в септиновых комплексах млекопитающих». Цитоскелет . 76 ( 9–10 ): 457–466 . doi : 10,1002/см.21569. ISSN 1949-3584. PMID 31608568. S2CID 204536675.
- ^ Soroor, Forooz; Kim, Moshe S.; Palander, Oliva; Balachandran, Yadu; Collins, Richard; Benlekbir, Samir; Rubinstein, John; Trimble, William S. (2019-03-07). "Revised subunit order of infantian septin complexs Explains their in vitro polymerization properties". bioRxiv : 569871. doi :10.1101/569871. hdl : 1807/109120 . S2CID 92158262 . Получено 2021-03-19 .
- ^ Гладфелтер, А.С.; Прингл, Дж.Р.; Лью, Д.Дж. (декабрь 2001 г.). «Септиновый кортекс в шейке материнской почки дрожжей». Current Opinion in Microbiology . 4 (6): 681– 9. doi :10.1016/s1369-5274(01)00269-7. PMID 11731320.
- ^ abcdef Гладфелтер AS (2006). «Контроль формы клеток нитчатых грибов септами и форминами». Nat. Rev. Microbiol . 4 (3): 223– 9. doi :10.1038/nrmicro1345. PMID 16429163. S2CID 40080522.
- ^ Харрис, SD (2006). Полярность клеток у нитчатых грибов: формирование формы . Международный обзор цитологии. Т. 251. С. 41–77 . doi :10.1016/S0074-7696(06)51002-2. ISBN 9780123646552. PMID 16939777.
- ^ Mostowy S, Bonazzi M, Hamon MA, Tham TN, Mallet A, Lelek M, Gouin E, Demangel C, Brosch R, Zimmer C, Sartori A, Kinoshita M, Lecuit M, Cossart P (2010). «Захват интрацитозольных бактерий с помощью септиновых структур, подобных клеткам». Cell Host Microbe . 8 (5): 433– 44. doi : 10.1016/j.chom.2010.10.009 . PMID 21075354.
- ^ Mostowy S, Sancho-Shimizu V , Hamon MA, Simeone R, Brosch R, Johansen T, Cossart P (2011). «белки p62 и NDP52 направляют интрацитозольные шигеллы и листерии на различные пути аутофагии». J. Biol. Chem . 286 (30): 26987– 95. doi : 10.1074/jbc.M111.223610 . PMC 3143657 . PMID 21646350.
- ^ Takahashi S, Inatome R, Yamamura H, Yanagi S (февраль 2003 г.). «Выделение и экспрессия нового митохондриального септина, взаимодействующего с CRMP/CRAM в развивающихся нейронах». Genes Cells . 8 (2): 81– 93. doi : 10.1046/j.1365-2443.2003.00617.x . PMID 12581152.
Дальнейшее чтение
- Güler GÖ, Mostowy S (март 2023 г.). «Септиновый цитоскелет: состав гетеромера определяет функцию филамента». Журнал клеточной биологии . 222 (3): e202302010. doi : 10.1083/jcb.202302010 . PMC 9998967. PMID 36821087 .
- Longtine MS, DeMarini DJ, Valencik ML, Al-Awar OS, Fares H, De Virgilio C, Pringle JR (февраль 1996 г.). «Септины: роль в цитокинезе и других процессах». Curr. Opin. Cell Biol . 8 (1): 106–19 . doi : 10.1016/S0955-0674(96)80054-8 . PMID 8791410.
- Faty M, Fink M, Barral Y (июнь 2002 г.). «Септины: кольцо для разлучения матери и дочери». Curr. Genet . 41 (3): 123– 31. doi :10.1007/s00294-002-0304-0. PMID 12111093. S2CID 22744214.
- Versele M, Gullbrand B, Shulewitz MJ, Cid VJ, Bahmanyar S, Chen RE, Barth P, Alber T, Thorner J (октябрь 2004 г.). "Взаимодействия белок-белок, регулирующие сборку гетеропентамера септина и организацию филаментов септина в Saccharomyces cerevisiae". Mol. Biol. Cell . 15 (10): 4568– 83. doi :10.1091/mbc.E04-04-0330. PMC 519150. PMID 15282341 .
- Douglas LM, Alvarez FJ, McCreary C, Konopka JB (сентябрь 2005 г.). "Функция септинов в модельных системах дрожжей и патогенных грибах". Eukaryotic Cell . 4 (9): 1503– 12. doi :10.1128/EC.4.9.1503-1512.2005. PMC 1214204. PMID 16151244 .
- Gladfelter AS (март 2006 г.). «Контроль формы клеток нитчатых грибов септами и форминами». Nat. Rev. Microbiol . 4 (3): 223– 9. doi :10.1038/nrmicro1345. PMID 16429163. S2CID 40080522.
- Кастро-Линарес Г (2023). Цирк септин: незабываемое шоу клеточной хореографии (Диссертация). Делфт: ТУ Делфта. п. 302. ИСБН 978-94-6384-491-8.
- Холл PA; Рассел SEH; Прингл JR (2008). Септины . Оксфорд: John Wiley-Blackwell. стр. 370. ISBN 978-0-470-51969-1.
- Gonzalez-Novo A; Vázquez de Aldana CR; Jimenez J (2009). «Грибковые септины: одно кольцо, чтобы править всем?». Cent. Eur. J. Biol . 4 (3): 274– 289. doi : 10.2478/s11535-009-0032-2 . hdl : 10261/66544 .