Фикоэритрин
| Фикоэритрин, альфа/бета цепь | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Фикоэритр_аб | ||||||||
| Пфам | ПФ02972 | ||||||||
| ИнтерПро | IPR004228 | ||||||||
| СКОП2 | 1qgw / SCOPe / SUPFAM | ||||||||
| |||||||||
Фикоэритрин ( ПЭ ) — это красный белок- пигментный комплекс из семейства светособирающих фикобилипротеинов , присутствующий в цианобактериях [1] , красных водорослях [2] и криптофитах [3] , являющийся дополнением к основным пигментам хлорофилла, ответственным за фотосинтез . Красный пигмент обусловлен простетической группой, фикоэритробилином, который придает фикоэритрину красный цвет. [4]
Как и все фикобилипротеины, он состоит из белковой части, ковалентно связывающей хромофоры, называемые фикобилинами . В семействе фикоэритринов наиболее известными фикобилинами являются: фикоэритробилин , типичный акцепторный хромофор фикоэритрина. Фикоэритробилин представляет собой линейную тетрапиррольную молекулу, обнаруженную в цианобактериях, красных водорослях и криптомонадах. Вместе с другими билинами, такими как фикоцианобилин, он служит светособирающим пигментом в фотосинтетических светособирающих структурах цианобактерий, называемых фикобилисомами. [5] Фикоэритрины состоят из (αβ) мономеров, обычно организованных в виде дискообразного тримера (αβ) 3 или гексамера (αβ) 6 (второй является функциональной единицей антенных стержней ). Эти типичные комплексы также содержат третий тип субъединицы — γ-цепь. [2]
Фикобилисомы

Фикобилипротеины являются частью огромных белковых комплексов антенн, собирающих свет, называемых фикобилисомами . В красных водорослях они прикреплены к стромальной стороне тилакоидных мембран хлоропластов , тогда как в криптофитах фикобилисомы редуцированы и (молекулы фикобилипротеина 545 PE545 здесь) плотно упакованы внутри просвета тилакоидов. [3] [7]
Фикобилипротеины имеют множество практических применений, включая такие важные свойства, как гепатопротекторная, антиоксидантная, противовоспалительная и антивозрастная активность PBP, что позволяет использовать их в пищевой, косметической, фармацевтической и биомедицинской промышленности. Также было отмечено, что PBP оказывают благоприятный эффект в терапии некоторых заболеваний, таких как болезнь Альцгеймера и рак. [8]
Фикоэритрин — это вспомогательный пигмент к основным пигментам хлорофилла , ответственным за фотосинтез . Световая энергия улавливается фикоэритрином и затем передается в реакционный центр хлорофилльной пары, в большинстве случаев через фикобилипротеины фикоцианин и аллофикоцианин .
Конструктивные характеристики
Фикоэритрины, за исключением фикоэритрина 545 (PE545), состоят из (αβ) мономеров, собранных в дискообразные (αβ) 6 гексамеры или (αβ) 3 тримеры с симметрией 32 или 3 и охватывающие центральный канал. В фикобилисомах (PBS) каждый тример или гексамер содержит по крайней мере один линкерный белок, расположенный в центральном канале. B-фикоэритрин (B-PE) и R-фикоэритрин (R-PE) из красных водорослей в дополнение к α и β цепям имеют третью, γ субъединицу, которая выполняет как линкерную, так и светособирающую функции, поскольку она несет хромофоры. [2]

4.
R-фикоэритрин в основном производится красными водорослями. Белок состоит по крайней мере из трех различных субъединиц и различается в зависимости от вида водорослей, которые его производят. Структура субъединицы наиболее распространенного R-PE — (αβ) 6 γ. Субъединица α имеет два фикоэритробилина (PEB), субъединица β имеет 2 или 3 PEB и один фикоуробилин (PUB), в то время как различные гамма-субъединицы, как сообщается, имеют 3 PEB и 2 PUB (γ 1 ) или 1 или 2 PEB и 1 PUB (γ 2 ). Молекулярная масса R-PE составляет 250 000 дальтон.
Кристаллические структуры, доступные в Protein Data Bank [12], содержат в одной асимметричной единице (αβ) 2 или (αβγ) 2 различные фикоэритрины:


| Хромофор или другая небелковая молекула | Фикоэритрин | Цепь | |||
|---|---|---|---|---|---|
| ПЕ545 | Б-ПЭ | Р-ПЭ | другие типы | ||
| Билинс | 8 | 10 | 10 | 10 | α и β |
| - Фикоэритробилин (ПЭБ) | 6 | 10 | 0 или 8 | 8 | β (PE545) или α и β |
| - 15,16-дигидробиливердин ( ДБВ) | 2 | — | — | — | α (-3 и -2) |
| - Фикоцианобилин (CYC) | — | — | 8 или 7 или 0 | — | α и β |
| - Биливердин IX альфа (БЛА) | — | — | 0 или 1 | — | α |
| - Фикоуробилин (ПУБ) | — | — | 2 | 2 | β |
| 5-гидроксилизин (LYZ) | 1 или 2 | — | — | — | α (-3 или -3 и -2) |
| N-метиласпарагин (MEN) | 2 | 2 | 0 или 2 | 2 | β |
| Сульфат -ион SO 4 2− (SO4) | — | 5 или 1 | 0 или 2 | — | α или α и β |
| Ион хлора Cl − (CL) | 1 | — | — | — | β |
| Ион магния Mg 2+ (MG) | 2 | — | — | — | α-3 и β |
| проверенные файлы PDB | 1XG0 1XF6 1QGW | 3В57 3В58 | 1EYX 1LIA 1B8D | 2VJH | |
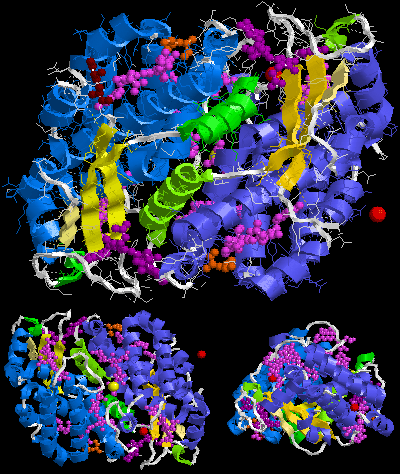
Предполагаемая биологическая молекула фикоэритрина 545 (PE545) — это (αβ) 2 или, скорее, (α 3 β)(α 2 β) . Цифры 2 и 3 после букв α во второй формуле являются здесь частью названий цепей, а не их количеством. Синоним криптофитанового названия цепи α 3 — цепь α 1 .
Самая большая сборка B-фикоэритрина (B-PE) представляет собой тример (αβ) 3 [9] [10] . Однако препараты из красных водорослей также дают гексамер (αβ) 6 [2] . В случае R-фикоэритрина (R-PE) самая большая предполагаемая биологическая молекула здесь представляет собой (αβγ) 6 , (αβγ) 3 (αβ) 3 или (αβ) 6 в зависимости от публикации, для других типов фикоэритрина (αβ) 6 . Эти γ-цепи из Protein Data Bank очень малы и состоят только из трех или шести узнаваемых аминокислот [15] [16] , тогда как описанная в начале этого раздела линкерная γ-цепь большая (например, 277 аминокислот длиной 33 кДа в случае γ 33 из красных водорослей Aglaothamnion neglectum ) [17] [2] . Это связано с тем, что электронная плотность гамма-полипептида в основном усредняется его трехкратной кристаллографической симметрией, и можно смоделировать только несколько аминокислот [15] [16] [18] [19] .
Для (αβγ) 6 , (αβ) 6 или (αβγ) 3 (αβ) 3 значения из таблицы следует просто умножить на 3, (αβ) 3 содержат промежуточные числа небелковых молекул. (это нелогичное рассуждение необходимо исправить)
В фикоэритрине PE545 выше одна α-цепь (-2 или -3) связывает одну молекулу билина, в других примерах она связывает две молекулы. β-цепь всегда связывается с тремя молекулами. Маленькая γ-цепь не связывается ни с одной.
Две молекулы N -метиласпарагина связаны с β-цепью, одна 5-гидроксилизин с α (-3 или -2), одна Mg2 + с α-3 и β, одна Cl− с β, 1–2 молекулы SO2−
4к α или β.
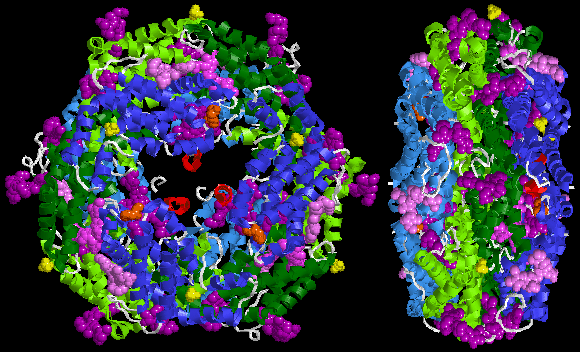
Ниже приведен образец кристаллической структуры R-фикоэритрина из Protein Data Bank :

Спектральные характеристики

Пики поглощения в спектре видимого света измеряются при 495 и 545/566 нм, в зависимости от связанных хромофоров и рассматриваемого организма. Сильный пик испускания существует при 575 ± 10 нм. (Фикоэритрин поглощает немного сине-зеленого/желтоватого света и испускает немного оранжево-желтого света.)
| Свойство | Ценить |
|---|---|
| Максимальное поглощение | 565 нм |
| Дополнительный пик поглощения | 498 нм |
| Максимальный выброс | 573 нм |
| Коэффициент экстинкции ( ε ) | 1,96 × 10 6 М −1 см −1 |
| Квантовый выход (QY) | 0,84 |
| Яркость ( ε × QY) | 1,65 × 10 6 М −1 см −1 |
Билины PEB и DBV в PE545 также поглощают в зеленой области спектра с максимумами при 545 и 569 нм соответственно. Максимум флуоресцентного излучения находится при 580 нм. [3]
Вариации R-фикоэритрина

Как упоминалось выше, фикоэритрин можно обнаружить в различных видах водорослей. Таким образом, может быть вариация в эффективности поглощения и испускания света, необходимого для облегчения фотосинтеза. Это может быть результатом глубины в толще воды, на которой обычно обитает конкретная водоросль, и последующей потребности в большей или меньшей эффективности вспомогательных пигментов.
Благодаря достижениям в области технологий визуализации и обнаружения, позволяющим избежать быстрого фотообесцвечивания, флуорофоры белков стали жизнеспособным и мощным инструментом для исследователей в таких областях, как микроскопия, анализ микрочипов и вестерн-блоттинг. В свете этого исследователям может быть полезно провести скрининг этих вариабельных R-фикоэритринов, чтобы определить, какой из них наиболее подходит для их конкретного применения. Даже небольшое увеличение эффективности флуоресценции может снизить фоновый шум и снизить частоту ложноотрицательных результатов.
Практические применения
R-фикоэритрин (также известный как PE или R-PE) полезен в лаборатории как флуоресцентный индикатор присутствия цианобактерий и для маркировки антител , чаще всего для проточной цитометрии . Он также используется в микроматричных анализах, ИФА и других приложениях, которые требуют высокой чувствительности, но не фотостабильности. [20] Его использование ограничено в иммунофлуоресцентной микроскопии из-за его быстрых характеристик фотообесцвечивания . Существуют также другие типы фикоэритринов, такие как B-фикоэритрин, которые имеют немного другие спектральные свойства. B-фикоэритрин сильно поглощает около 545 нм (слегка желтовато-зеленый) и сильно излучает при 572 нм (желтый) вместо этого и может лучше подходить для некоторых инструментов. B-фикоэритрин также может быть менее «липким», чем R-фикоэритрин, и вносит меньший вклад в фоновый сигнал из-за неспецифического связывания в определенных приложениях. [ необходима цитата ] Однако R-PE гораздо более широко доступен в виде конъюгата антител. Фикоэритрин (PE, λA max = 540–570 нм; λF max = 575–590 нм) [8]
R-фикоэритрин и B-фикоэритрин являются одними из самых ярких флуоресцентных красителей, когда-либо идентифицированных.
Ссылки
- ^ Башева Д, Мотен Д, Стоянов П, Белкинова Д, Младенов Р, Тенева И (ноябрь 2018 г.). «Содержание фикоэритрина, фикоцианина, алофикоцианина и фикоэритроцианина в некоторых штаммах цианобактерий: применение». Инженерия в науках о жизни . 18 (11): 861–866. Bibcode :2018EngLS..18..861B. doi :10.1002/elsc.201800035. PMC 6999198 . PMID 32624879.
- ^ abcde Ficner R, Huber R (ноябрь 1993 г.). «Уточненная кристаллическая структура фикоэритрина из Porphyridium cruentum при разрешении 0,23 нм и локализация гамма-субъединицы». European Journal of Biochemistry . 218 (1): 103–106. doi : 10.1111/j.1432-1033.1993.tb18356.x . PMID 8243457.
- ^ abc van der Weij-De Wit CD, Doust AB, van Stokkum IH, Dekker JP, Wilk KE, Curmi PM и др. (декабрь 2006 г.). «Как энергия перетекает из комплекса антенн фикоэритрина в фотосистему I и фотосистему II в клетках криптофита Rhodomonas CS24» (PDF) . The Journal of Physical Chemistry B. 110 ( 49): 25066–25073. doi :10.1021/jp061546w. PMID 17149931. Архивировано из оригинала (PDF) 30 октября 2013 г.
- ^ Хайн, Роберт; Мартин, Элизабет, ред. (2015). «Фикоэритрин». Биологический словарь. Oxford University Press. doi : 10.1093/acref/9780198714378.001.0001. ISBN 978-0-19-871437-8. Получено 27.11.2021 г. – через login.aurarialibrary.idm.oclc.org.
- ^ Даммейер Т., Франкенберг-Динкель Н. (сентябрь 2006 г.). «Понимание биосинтеза фикоэритробилина указывает на метаболическое каналирование». Журнал биологической химии . 281 (37): 27081–27089. doi : 10.1074/jbc.M605154200 . PMID 16857683.
- ^ Six C, Thomas JC, Garczarek L, Ostrowski M, Dufresne A, Blot N и др. (2007). «Разнообразие и эволюция фикобилисом у морских Synechococcus spp.: сравнительное геномное исследование». Genome Biology . 8 (12): R259. doi : 10.1186/gb-2007-8-12-r259 . PMC 2246261. PMID 18062815 .
- ^ Glazer AN (1985). «Сбор света фикобилисомами». Annual Review of Biophysics and Biophysical Chemistry . 14 : 47–77. doi :10.1146/annurev.bb.14.060185.000403. PMID 3924069.
- ^ ab Sonani RR, Rastogi RP, Patel R, Madamwar D (февраль 2016 г.). «Последние достижения в производстве, очистке и применении фикобилипротеинов». World Journal of Biological Chemistry . 7 (1): 100–109. doi : 10.4331/wjbc.v7.i1.100 . PMC 4768114. PMID 26981199 .
- ^ ab Camara-Artigas, A. (2011-12-16). "Кристаллическая структура B-фикоэритрина из красных водорослей Porphyridium cruentum при pH8". RCSB Protein Data Bank (PDB). doi :10.2210/pdb3v57/pdb. PDB ID: 3V57 . Получено 12 октября 2012 г.
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ ab Камара-Артигас А., Бакарисо Дж., Андухар-Санчес М., Ортис-Сальмерон Е., Меса-Валле С., Куадри С. и др. (октябрь 2012 г.). «РН-зависимые структурные конформации B-фикоэритрина из Porphyridium cruentum». Журнал ФЭБС . 279 (19): 3680–3691. дои : 10.1111/j.1742-4658.2012.08730.x. PMID 22863205. S2CID 31253970. Идентификатор PDB: 3V57.
- ^ abcd Изображение создано с помощью RasTop (программное обеспечение для молекулярной визуализации).
- ^ "Банк данных белков". Банк данных белков RCSB (PDB). Архивировано из оригинала 28 августа 2008 года . Получено 12 октября 2012 года .
- ^ Doust AB, Marai CN, Harrop SJ, Wilk KE, Curmi PM, Scholes GD (2004-09-16). "Высокоразрешающая кристаллическая структура фикоэритрина 545 из морского криптофита rhodomonas CS24". RCSB Protein Data Bank (PDB). doi :10.2210/pdb1xg0/pdb. PDB ID: 1XG0 . Получено 11 октября 2012 г.
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ Doust AB, Marai CN, Harrop SJ, Wilk KE, Curmi PM, Scholes GD (ноябрь 2004 г.). «Разработка структурно-функциональной модели для криптофитного фикоэритрина 545 с использованием кристаллографии сверхвысокого разрешения и сверхбыстрой лазерной спектроскопии». Журнал молекулярной биологии . 344 (1): 135–153. doi :10.1016/j.jmb.2004.09.044. PMID 15504407. PDB ID: 1XG0.
- ^ abcd Contreras-Martel C, Martinez-Oyanedel J, Bunster M, Legrand P, Piras C, Vernede X, Fontecilla-Camps JC (2000-05-09). "Кристаллическая структура R-фикоэритрина при 2,2 ангстремах". RCSB Protein Data Bank (PDB). doi :10.2210/pdb1eyx/pdb. PDB ID: 1EYX . Получено 11 октября 2012 г.
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ abcd Contreras-Martel C, Martinez-Oyanedel J, Bunster M, Legrand P, Piras C, Vernede X, Fontecilla-Camps JC (январь 2001 г.). «Кристаллизация и 2.2 Структура разрешения R-фикоэритрина из Gracilaria chilensis: случай идеального гемиэдрического двойникования». Acta Crystallographica. Раздел D, Биологическая кристаллография . 57 (Pt 1): 52–60. doi :10.1107/S0907444900015274. PMID 11134927. S2CID 216930. PDB ID: 1EYX.
- ^ Apt KE, Hoffman NE, Grossman AR (август 1993). «Гамма-субъединица R-фикоэритрина и ее возможный способ транспорта в пластиду красных водорослей». Журнал биологической химии . 268 (22): 16208–16215. doi : 10.1016/S0021-9258(19)85407-8 . PMID 8344905.
- ^ Риттер С., Хиллер Р.Г., Вренч П.М., Вельте В., Дидерихс К. (1999-01-29). «Кристаллическая структура фикоэритрина, содержащего фикоуробилин». doi :10.2210/pdb1b8d/pdb. Идентификатор PDB: 1B8D.
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ Ritter S, Hiller RG, Wrench PM, Welte W, Diederichs K (июнь 1999). «Кристаллическая структура фикоэритрина, содержащего фикоуробилин, при разрешении 1,90 А». Журнал структурной биологии . 126 (2): 86–97. doi :10.1006/jsbi.1999.4106. PMID 10388620. PDB ID: 1B8D.
- ^ "R-фикоэритрин (R-PE) - США". www.thermofisher.com . Получено 11.12.2021 .
Внешние ссылки
- Фикоэритрин в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)