Оксид азота
Оксид азота может относиться к бинарному соединению кислорода и азота или к смеси таких соединений :
Нейтральный заряд
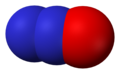
- Оксид азота (NO), оксид азота (II) или оксид азота
- Диоксид азота ( NO2 ) , оксид азота(IV)
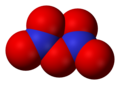
- Триоксид азота ( NO 3 ), или нитратный радикал
- Закись азота ( N 2 O ), оксид азота(0,II)
- Диоксид азота ( N 2 O 2 ), димер оксида азота(II)
- Триоксид азота ( N 2 O 3 ), оксид азота(II,IV)
- Четырехокись азота ( N 2 O 4 ), димер оксида азота (IV)
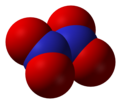
- Пятиокись азота ( N 2 O 5 ), оксид азота(V) или нитрат нитрония [NO 2 ] + [NO 3 ] −
- Нитрозилазид ( N 4 O ), оксид азота(−I,0,I,II)
- Нитрилазид ( N 4 O 2 )
- Оксатетразол ( N 4 O )
- Тринитрамид ( N(NO2 ) 3 или N4O6 ) , оксид азота(0, IV )
Анионы
| Имя | Формула |
|---|---|
| Нитроксид | О=Н − или НЕТ − |
| Нитрит | O=N−O − или НЕТ−2 |
| Нитрат | O 2 N−O − или NO−3 |
| Пероксинитрит | O=N−O−O − или НЕТ−3 |
| Пероксинитрат | O 2 N−O−O − или NO−4 |
| Ортонитрат | + Н(−О − ) 4 или НЕТ3−4 |
| Гипонитрит | − O−N=N−O − или N 2 O2−2 |
| Триоксодинатрат или гипонитрат | O=N−N(−O − ) 2 или N 2 O2−3 |
| Нитроксилат | ( − O−) 2 N−N(−O − ) 2 или N 2 O4−4 |
| Динитрамид | O 2 N−N − −NO 2 или N 3 O−4 |
Катионы
- Нитрозоний ( N≡O + или [NO] + )
- Нитроний ( O=N + =O или [NO 2 ] + )
Атмосферные науки
- NO x (или NO x ) относится к сумме NO и NO 2 . [1] [2]
- NO y (или NO y ) относится к сумме NO x и всех окисленных атмосферных нечетных видов азота ( например, сумма NO x , HNO 3 , HNO 2 и т. д.)
- НЕТ z (или НЕТ z ) = НЕТ y − НЕТ x
- Смешанные оксиды азота («СОЗ»): растворы оксида азота в тетраоксиде азота/диоксиде азота.
- Оксид азота , NO
Стабильность
Из-за относительно слабой связи N–O все оксиды азота нестабильны по отношению к N 2 и O 2 , что является принципом работы каталитического нейтрализатора и предотвращает возгорание кислорода и азота в атмосфере .
Смотрите также
- Нитрат
- Датчик оксида азота
- Нитриды серы , которые являются валентно изоэлектронными с оксидами азота
Ссылки
- ^ Закон США о чистом воздухе , 42 USC § 7602
- ^ Сайнфелд, Джон Х.; Пандис, Спирос Н. (1997), Атмосферная химия и физика: от загрязнения воздуха до изменения климата , Wiley-Interscience, ISBN 0-471-17816-0