Комплекс нитрита переходного металла
В металлоорганической химии комплексы переходных металлов с нитритами описывают семейства координационных комплексов, содержащих один или несколько лигандов нитрита ( −NO 2 ) . [2] Хотя синтетические производные представляют только научный интерес, комплексы металлов с нитритами встречаются в нескольких ферментах , которые участвуют в азотном цикле . [3]
Структура и связь

Режимы соединения
Три изомера связей обычны для лигандов нитрита: O-связанный, N-связанный и бидентатный O,O-связанный. Первые два изомера были охарактеризованы для системы пентамминкобальта(III), то есть [(NH 3 ) 5 Co−NO 2 ] 2+ и [(NH 3 ) 5 Co−ONO] 2+ , называемые N-нитрито и O-нитрито соответственно. Эти две формы иногда называют нитро и нитрито. Эти изомеры могут быть взаимопревращены в некоторых комплексах. [4]
Примером хелатирующего нитрита является [Cu(bipy) 2 ( O2N )]NO3 – « bipy » является бидентатным лигандом 2,2′-бипиридил . Этот режим связи иногда описывается как κ2O ,O - NO2 .
Сосредоточившись на подсчете электронов в монометаллических комплексах, O-связанные, N-связанные рассматриваются как 1-электронные псевдогалогениды («X-лиганд»). Бидентатный O,O-связанный является «LX-лигандом», родственным бидентатному карбоксилату.
Что касается теории HSAB , то режим связи N более распространен для более мягких металлических центров. Режимы O и O,O-бидентатные являются жесткими лигандами, обнаруживаемыми на металлических центрах с кислотностью Льюиса.
Кинетически благоприятный изомер с O-связью [(NH 3 ) 5 Co−ONO] 2+ преобразуется в [(NH 3 ) 5 Co−NO 2 ] 2+ . В своей реакции с комплексами порфиринов железа нитрит дает изомер с O-связью, Fe(porph)ONO . Добавление донорных лигандов к этому комплексу вызывает преобразование в октаэдрический низкоспиновый изомер, который теперь является мягкой кислотой Льюиса. Нитрит изомеризуется в изомер с N-связью, Fe(porph)NO 2 (L) . [5]
Изомеризация [(NH 3 ) 5 Co−ONO] 2+ в [(NH 3 ) 5 Co−NO 2 ] 2+ протекает внутримолекулярно. [6]
Гомолептические комплексы

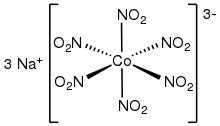
Несколько гомолептических (комплексов только с одним видом лиганда) комплексов были охарактеризованы с помощью рентгеновской кристаллографии . Инвентарь включает октаэдрические комплексы [M(NO 2 ) 6 ] 3− , где M = Co ( натрия кобальтитрит ) [7] [8] и Rh. Квадратно-плоские гомолептические комплексы также известны для Pt(II) и Pd(II). Калиевые соли [M(NO 2 ) 4 ] 2− (M = Zn, Cd) характеризуются гомолептическими комплексами с четырьмя O,O-бидентатными нитритными лигандами. [9]
Синтез нитритокомплексов
Традиционно комплексы нитритов металлов готовятся путем солевого метатезиса или реакций замещения лигандов с использованием солей нитритов щелочных металлов, таких как нитрит натрия . При нейтральном pH нитрит существует преимущественно в виде аниона, а не азотистой кислоты. [10]
Металлические нитрозильные комплексы подвергаются основному гидролизу, давая нитритные комплексы. Эта закономерность проявляется в поведении нитропруссида :
- [Fe(CN) 5 NO] 2− + 2 OH − → [Fe(CN) 5 NO 2 ] 4− + H 2 O
Реакции нитритокомплексов
Некоторые анионные нитритокомплексы подвергаются кислотно-индуцированной дезоксигенации с образованием нитрозильного комплекса . [11]
- [L n MNO 2 ] − + H + → [L n MNO] + + OH −
Реакция обратима в некоторых случаях. Таким образом, можно генерировать нитритокомплексы путем основного гидролиза электрофильных нитрозилов металлов.
Нитрокомплексы также катализируют окисление алкенов. [12]
Бионеорганическая химия
Металлические нитритокомплексы играют видную роль в азотном цикле , который описывает взаимоотношения и взаимопревращения аммиака до нитрата . Поскольку азот часто является ограничивающим питательным веществом, этот цикл важен. Сам нитрит нелегко подвергается окислительно-восстановительным реакциям, но его металлические комплексы подвергаются. [13]
Окисление до нитрата
Молибденсодержащий фермент нитритоксидоредуктаза катализирует окисление нитрита до нитрата:
- НЕТ−2+ Н2О → НЕТ−3+ 2 Н +
Снижение
Фермент нитритредуктаза на основе гема катализирует превращение нитрита в аммиак. Цикл начинается с восстановления комплекса железа-нитрита до комплекса нитрозила металла . [3]
Медьсодержащий фермент нитритредуктаза (CuNIR) катализирует 1-электронное восстановление нитрита до оксида азота. Предложенный механизм включает протонирование комплекса κ 2O,O -NO 2 -Cu(I). Это протонирование вызывает разрыв связи N–O, давая центр HO–Cu–ON, который представляет собой лиганд оксида азота, связанный O с Cu(II) (изонитрозил ) .
Родственные соединения
- NH 4 [Co(NO 2 ) 4 (NH 3 ) 2 ] , «соль Эрдмана». [14]
Ссылки
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Хитчман, Майкл А.; Роуботтом, Грэм Л. (1982). «Комплексы нитритов переходных металлов». Coordination Chemistry Reviews . 42 : 55–132 . doi :10.1016/S0010-8545(00)80527-5.
- ^ ab Timmons, AJ; Symes, MD (2015). «Преобразование между оксидами азота с использованием координационных комплексов металл–лиганд». Chemical Society Reviews . 44 (19): 6708– 6722. doi : 10.1039/C5CS00269A . PMID 26158348.
- ^ Schaniel, Dominik; Woike, Theo; Behrnd, Norwid-R.; Hauser, Jürg; Krämer, Karl W.; Todorova, Teodora; Delley, Bernard (2009). "Фотогенерация изомеров нитрозильных связей в октаэдрически координированных комплексах платины в красном спектральном диапазоне". Неорганическая химия . 48 (23): 11399– 11406. doi :10.1021/ic901392q. PMID 19863116.
- ^ Форд, Питер К. (2010). «Реакции NO и нитрита с моделями гема и белками». Неорганическая химия . 49 (14): 6226– 6239. doi :10.1021/ic902073z. PMID 20666383.
- ^ Джексон, В. Грегори; Лоуренс, Джеффри А.; Лэй, Питер А.; Сарджесон, Алан М. (1980). «Катализируемая основанием изомеризация связи нитрита с нитрокомплексами пентааммина кобальта (III), родия (III) и иридия (III)». Неорганическая химия . 19 (4): 904–910 . doi :10.1021/ic50206a022.
- ^ Бьянки, Р.; Гатти, К.; Адовасио, В.; Нарделли, М. (1996). «Теоретическое и экспериментальное (113 К) исследование электронной плотности гексанитрокобальтата (III) бис(тетраметиламмония) лития». Acta Crystallographica Раздел B: Структурная наука . 52 (3): 471– 478. doi :10.1107/S0108768195016879.
- ^ Adovasio, V.; Lina, F.; Nardelli, M.; Pelizzi, G. (1994). "Lithium bis(tetramethyllammonium) Hexanitrocobaltate(III) at 113 and 293 K". Acta Crystallographica Section C: Crystal Structure Communications . 50 (6): 871– 874. doi :10.1107/S0108270193011588.
- ^ Ohba, S.; Matsumoto, F.; Takazawa, H.; Saito, Y. (1987). «Структуры дигидрата нитрита кадмия и тетранитрита дикалия кадмия». Acta Crystallographica Раздел C: Crystal Structure Communications . 43 (2): 191– 194. doi :10.1107/S0108270187096471.
- ^ Харбулак, Эдвард П.; Альбинак, Марвин Дж. (1966). цис-динитробис(этилендиамин)кобальт(III) нитрит и нитрат . Неорганические синтезы. стр. 196–198 . doi :10.1002/9780470132395.ch51. ISBN 9780470132395.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 449. ISBN 978-0-08-037941-8.
- ^ Fairlamb, Ian JS (2015). «Окислительно-активные лиганды NO x в процессах, опосредованных палладием». Angewandte Chemie International Edition . 54 (36): 10415– 10427. doi :10.1002/anie.201411487. PMID 26211412.
- ^ Майя, Луиза Б.; Моура, Хосе Дж. Г. (2014). «Как биология обрабатывает нитрит». Chemical Reviews . 114 (10): 5273–5357 . doi : 10.1021/cr400518y . PMID 24694090.
- ^ Комияма, Ёсимити (1957). «Структуры соли Эрдмана, NH 4 [Co(NH 3 ) 2 (NO 2 ) 4 ] и некоторых других родственных комплексов нитро-аммиака-кобальта (III)». Бюллетень химического общества Японии . 30 : 13– 21. doi :10.1246/bcsj.30.13.