Neisseria gonorrhoeae
| Neisseria gonorrhoeae | |
|---|---|
 | |
| Окраска по Граму гонококкового уретрита . Обратите внимание на распределение нейтрофилов и наличие как внутриклеточных , так и внеклеточных бактерий. ( CDC ) | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Псевдомонадоты |
| Сорт: | Бетапротеобактерии |
| Заказ: | Нейссериалы |
| Семья: | Нейссериевые |
| Род: | Нейссерия |
| Разновидность: | N. гонорея |
| Биномиальное имя | |
| Neisseria gonorrhoeae | |
| Синонимы | |
Neisseria gonorrhoeae , также известная как гонококк (единственное число) или гонококки (множественное число), является видом грамотрицательных диплококковых бактерий, выделенных Альбертом Нейссером в 1879 году [3]. Она вызывает передающуюся половым путем урогенитальную инфекцию гонорею [4], а также другие формы гонококкового заболевания, включая диссеминированную гонококкемию, септический артрит и гонококковую офтальмию новорожденных.
Он оксидазоположительный и аэробный, выживает при фагоцитозе и растет внутри нейтрофилов . [4] Для его культивирования требуется добавление углекислого газа и обогащенный агар ( шоколадный агар ) с различными антибиотиками ( Тейер-Мартин ). Он проявляет антигенную изменчивость посредством генетической рекомбинации своих пилей и поверхностных белков, которые взаимодействуют с иммунной системой . [3]
Половой путь передачи — вагинальный, анальный или оральный секс. [5] Половой путь передачи можно предотвратить с помощью барьерной защиты. [6] Перинатальная передача может произойти во время родов и может быть предотвращена путем лечения матери антибиотиками до рождения и нанесения антибактериального глазного геля на глаза новорожденного. [6] После эпизода гонококковой инфекции инфицированные люди не вырабатывают иммунитет к будущим инфекциям. Повторное заражение возможно из-за способности N. gonorrhoeae уклоняться от иммунной системы, изменяя свои поверхностные белки. [7]
N. gonorrhoeae может вызывать инфекцию половых органов, горла и глаз. [8] Бессимптомная инфекция распространена как у мужчин, так и у женщин. [6] [9] Нелеченая инфекция может распространиться на остальные части тела (диссеминированная гонорея), особенно на суставы (септический артрит). Нелеченая инфекция у женщин может вызвать воспалительные заболевания органов малого таза и возможное бесплодие из-за образовавшихся рубцов. [8] Диагностика проводится с помощью посева , окраски по Граму или тестов на нуклеиновые кислоты , таких как полимеразная цепная реакция , образца мочи, мазка из уретры или мазка из шейки матки. [10] [11] Рекомендуется совместное тестирование на хламидиоз и тестирование на другие ИППП из-за высоких показателей коинфекции. [12]
Устойчивость к антибиотикам у N. gonorrhoeae становится все более серьезной проблемой общественного здравоохранения, особенно учитывая его склонность к легкому развитию устойчивости. [13] Эта способность N. gonorrhoeae быстро адаптироваться к новым методам лечения противомикробными препаратами наблюдалась несколько раз с 1930-х годов с появлением методов лечения сульфаниламидами вплоть до современных штаммов, которые начали проявлять устойчивость к текущему лечению цефтриаксоном. [14]
Микробиология

Виды Neisseria — это прихотливые , грамотрицательные кокки, которым для роста в лабораторных культурах требуются питательные добавки. Они факультативно внутриклеточные и обычно появляются парами (диплококки), напоминая по форме кофейные зерна. Представители этого рода не образуют спор, способны двигаться с помощью подергивающейся моторики и являются облигатными аэробами (требуют кислорода для роста). Из 11 видов, которые колонизируют людей, только два являются патогенными: N. gonorrhoeae и N. meningitidis , причем N. gonorrhoeaa является возбудителем гонореи, а N. meningitidis — одной из причин бактериального менингита . [15]
Культура и идентификация
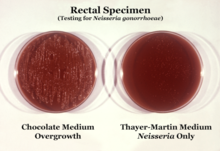

N. gonorrhoeae обычно изолируют на агаре Тайера-Мартина (или VPN) в атмосфере, обогащенной 3-7% углекислого газа. [10] Агар Тайера-Мартина представляет собой шоколадную агаровую пластину (нагретый кровяной агар), содержащую питательные вещества и противомикробные препараты ( ванкомицин , колистин , нистатин и триметоприм ). Этот препарат агара способствует росту видов Neisseria , одновременно подавляя рост загрязняющих бактерий и грибков. Агар Мартина-Льюиса и Нью-Йорк-Сити — другие типы селективного шоколадного агара, обычно используемые для роста Neisseria . [10] N. gonorrhoeae является оксидазоположительным (обладает цитохром с оксидазой) и каталазоположительным (способен преобразовывать перекись водорода в кислород). [10] При инкубации с углеводами лактозой, мальтозой , сахарозой и глюкозой N. gonorrhoeae окисляет только глюкозу. [10]
Поверхностные молекулы
На своей поверхности N. gonorrhoeae несет волосовидные пили , поверхностные белки с различными функциями и сахара, называемые липоолигосахаридами . Пили опосредуют адгезию, движение и обмен ДНК. Белки Opa взаимодействуют с иммунной системой, как и порины . Липоолигосахарид (LOS) — это эндотоксин , который вызывает иммунный ответ. Все они антигенны и все демонстрируют антигенную изменчивость (см. ниже). Пили демонстрируют наибольшую изменчивость. Пили, белки Opa, порины и даже LOS имеют механизмы для ингибирования иммунного ответа, что делает возможным бессимптомное инфицирование. [16]
Динамические полимерные белковые нити, называемые пилями типа IV, позволяют N. gonorrhoeae прилипать к поверхностям и перемещаться по ним. Чтобы проникнуть в хозяина, бактерия использует пили для прилипания к слизистым поверхностям и проникновения в них. [4] Пили являются основным фактором вирулентности для N. gonorrhoeae ; без них бактерия не способна вызвать инфекцию. [8] Для перемещения отдельные бактерии используют свои пили таким образом, который напоминает крюк для захвата: сначала они вытягиваются с поверхности клетки и прикрепляются к субстрату . Последующее втягивание пилей тянет клетку вперед. Результирующее движение называется подергивающейся подвижностью. [17] N. gonorrhoeae способна тянуть в 100 000 раз больше собственного веса, и пили, используемые для этого, являются одними из самых мощных биологических двигателей, известных на сегодняшний день, прилагая один наноньютон . [18] Белки АТФазы PilF и PilT отвечают за обеспечение расширения и ретракции пилей типа IV соответственно. [19] [20] Адгезивные функции гонококковых пилей играют роль в агрегации микроколоний и образовании биопленки . [21] Поверхностные белки, называемые белками Opa, могут использоваться для связывания с рецепторами на иммунных клетках и предотвращения иммунного ответа. Известно не менее 12 белков Opa, а многочисленные перестановки поверхностных белков затрудняют распознавание N. gonorrhoeae и создание защиты иммунными клетками. [22]
Липоолигосахарид (ЛОС) — это низкомолекулярная версия липополисахарида, присутствующая на поверхности большинства других грамотрицательных бактерий. Это боковая цепь сахара (сахарида), прикрепленная к липиду А (следовательно, «липо-») во внешней мембране, покрывающей клеточную стенку бактерий. Корень «олиго» относится к тому факту, что он на несколько сахаров короче типичного липополисахарида. [4] Как эндотоксин, ЛОС провоцирует воспаление. Выделение ЛОС бактериями ответственно за локальное повреждение, например, при воспалительных заболеваниях органов малого таза. [4] Хотя его основная функция — быть эндотоксином, ЛОС может маскироваться под сиаловую кислоту хозяина и блокировать инициацию каскада комплемента . [4]
Антигенная вариация
N. gonorrhoeae ускользает от иммунной системы с помощью процесса, называемого антигенной изменчивостью . [23] Этот процесс позволяет N. gonorrhoeae рекомбинировать свои гены и изменять антигенные детерминанты (места, где связываются антитела), такие как пили типа IV, [24], которые украшают его поверхность. [4] Проще говоря, химический состав молекул изменяется из-за изменений на генетическом уровне. [7] N. gonorrhoeae способен изменять состав своих пилей и LOS; из них пили демонстрируют наибольшую антигенную изменчивость из-за хромосомной перестройки. [8] [4] Ген PilS является примером этой способности к перестройке, поскольку его сочетание с геном PilE, как оценивается, производит более 100 вариантов белка PilE. [7] Эти изменения позволяют приспосабливаться к различиям в локальной среде в месте заражения, уклоняться от распознавания целевыми антителами и способствуют отсутствию эффективной вакцины. [7]
В дополнение к способности перестраивать гены, которые у него уже есть, он также естественным образом способен приобретать новую ДНК (через плазмиды ), через свои пили типа IV, в частности белки Pil Q и Pil T. [25] Эти процессы позволяют N. gonorrhoeae приобретать/распространять новые гены, маскироваться с помощью различных поверхностных белков и предотвращать развитие иммунологической памяти — способности, которая привела к устойчивости к антибиотикам и также препятствовала разработке вакцин. [26]
Изменение фазы
Фазовая вариация похожа на антигенную вариацию, но вместо изменений на генетическом уровне, изменяющих состав молекул, эти генетические изменения приводят к активации или деактивации гена. [7] Фазовая вариация чаще всего возникает из-за сдвига рамки в экспрессируемом гене. [7] Белки Opacity, или Opa, N. gonorrhoeae строго зависят от фазовой вариации. [7] Каждый раз, когда бактерии реплицируются, они могут включать или выключать несколько белков Opa посредством неправильного спаривания со смещенной цепью . То есть, бактерии вносят мутации сдвига рамки, которые вводят гены в рамку или выводят их из нее. В результате каждый раз транслируются разные гены Opa. [4] Пили различаются антигенной вариацией, но также и фазовой вариацией. [7] Сдвиги рамки происходят как в генах pilE , так и в генах pilC , эффективно отключая экспрессию пилей в ситуациях, когда они не нужны, например, после колонизации, когда N. gonorrhoeae выживает внутри клеток, а не на их поверхности. [7]
Выживаемость гонококков
После того, как гонококки проникают в эпителиальные клетки хозяина и трансцитируют их, они попадают в подслизистую оболочку, где нейтрофилы быстро их поглощают. [4] Пили и белки Opa на поверхности могут мешать фагоцитозу, [8] но большинство гонококков оказываются в нейтрофилах. Экссудаты инфицированных людей содержат много нейтрофилов с проглоченными гонококками. Нейтрофилы выделяют окислительный выброс активных форм кислорода в своих фагосомах, чтобы убить гонококки. [27] Однако значительная часть гонококков может противостоять убийству благодаря действию своей каталазы [4], которая расщепляет активные формы кислорода и способна размножаться внутри нейтрофильных фагосом. [28]
Stohl и Seifert показали, что бактериальный белок RecA, который опосредует восстановление повреждений ДНК, играет важную роль в выживании гонококков. [29] Michod et al. предположили, что N. gonorrhoeae может заменять ДНК, поврежденную в нейтрофильных фагосомах, ДНК соседних гонококков. [30] Процесс, в котором реципиентные гонококки интегрируют ДНК соседних гонококков в свой геном, называется трансформацией. [31]
Геном
Геномы нескольких штаммов N. gonorrhoeae были секвенированы. Большинство из них имеют размер около 2,1 Мб и кодируют от 2100 до 2600 белков (хотя большинство, по-видимому, находятся в нижнем диапазоне). [ 32] Например, штамм NCCP11945 состоит из одной кольцевой хромосомы (2 232 025 п.н.), кодирующей 2 662 предсказанных открытых рамок считывания (ORF), и одной плазмиды (4 153 п.н.), кодирующей 12 предсказанных ORF. Расчетная плотность кодирования по всему геному составляет 87%, а среднее содержание G+C составляет 52,4%, значения, которые аналогичны значениям штамма FA1090. Геном NCCP11945 кодирует 54 тРНК и четыре копии оперонов 16S-23S-5S рРНК. [33]
Горизонтальный перенос генов
Горизонтальный перенос генов, также называемый латеральным переносом генов, представляет собой обмен генетической информацией между живыми организмами. [34] Эта передача информации является движущей силой устойчивости к антибиотикам у Neisseria Gonorrhoeae. [35] [36] Исследования показали, что N. gonorrhoeae приобрела методы устойчивости к противомикробным препаратам посредством горизонтального переноса генов от других видов Neisseria, включая N. lactamica , N. macacae и N. mucosa. [37]
N. gonorrhoeae является естественно компетентным, что означает, что он имеет возможность приобретать ДНК из окружающей среды посредством трансформации и включать последовательности в свой собственный геном. [36] Трансформация у N. gonorrhoeae осуществляется пилями типа IV, где ДНК связывается и переносится в клетку, после чего следует процессинг и гомологичная рекомбинация. [38]
В 2011 году исследователи из Северо-Западного университета обнаружили доказательства наличия фрагмента человеческой ДНК в геноме N. gonorrhoeae , что стало первым примером горизонтального переноса генов от человека к бактериальному патогену. [39] [40]
Болезнь
Симптомы
Симптомы заражения N. gonorrhoeae различаются в зависимости от места заражения, и многие инфекции протекают бессимптомно независимо от пола. [41] [16] [5] Важно отметить, что в зависимости от пути передачи N. gonorrhoeae может вызывать инфекцию горла ( фарингит ) или инфекцию заднего прохода/прямой кишки ( проктит ). [42] [8]
Диссеминированные гонококковые инфекции могут возникнуть, когда N. gonorrhoeae попадает в кровоток, часто распространяясь на суставы и вызывая сыпь (синдром дерматита-артрита). [42] Синдром дерматита-артрита приводит к болям в суставах ( артрит ), воспалению сухожилий ( теносиновит ) и безболезненному незудящему (не зудящему) дерматиту . [8] Диссеминированная инфекция и воспалительные заболевания органов малого таза у женщин, как правило, начинаются после менструации из-за рефлюкса во время менструации, что облегчает распространение. [42] В редких случаях диссеминированная инфекция может вызвать инфекцию оболочек головного и спинного мозга ( менингит ) или инфекцию клапанов сердца ( эндокардит ). [42] [43]
Мужской
У мужчин с симптомами основным симптомом инфекции мочеполовой системы является уретрит — жжение при мочеиспускании ( дизурия ), учащенные позывы к мочеиспусканию и гнойные выделения из полового члена. Выделения могут иметь неприятный запах. [42] При отсутствии лечения рубцевание уретры может привести к затруднению мочеиспускания. Инфекция может распространиться из уретры в половой член на близлежащие структуры, включая яички ( эпидидимит / орхит ) или на простату ( простатит ). [42] [8] [44] У мужчин, перенесших гонорею , значительно повышен риск развития рака простаты. [45]
Женский
.jpg/440px-Neisseria_gonorrhoeae_and_pus_cells_in_a_vaginal_swab_(Gram_stain).jpg)
У женщин с симптомами основными симптомами инфекции мочеполовой системы являются повышенные выделения из влагалища, жжение при мочеиспускании ( дизурия ), повышенные позывы к мочеиспусканию, боль при половом акте или нарушения менструального цикла. Воспалительное заболевание органов малого таза возникает, если N. gonorrhoeae поднимается в брюшину малого таза (через шейку матки , эндометрий и маточные трубы ). Возникающее в результате воспаление и рубцевание маточных труб может привести к бесплодию и повышенному риску внематочной беременности. [42] Воспалительное заболевание органов малого таза развивается у 10–20 % женщин, инфицированных N. gonorrhoeae . [42]
Новорожденные (перинатальная инфекция)
При перинатальной инфекции первичным проявлением является инфекция глаза (неонатальный конъюнктивит или ophthalmia neonatorum ), когда новорожденный подвергается воздействию N. gonorrhoeae в родовых путях. Инфекция глаза может привести к рубцеванию или перфорации роговицы, что в конечном итоге приводит к слепоте. Если новорожденный подвергается воздействию во время родов, конъюнктивит возникает в течение 2–5 дней после рождения и является тяжелым. [42] [43] Гонококковая ophthalmia neonatorum, когда-то распространенная у новорожденных, предотвращается нанесением эритромицинового (антибиотического) геля на глаза младенцев при рождении в качестве меры общественного здравоохранения. Нитрат серебра больше не используется в Соединенных Штатах. [43] [42]
Передача инфекции
N. gonorrhoeae передается через вагинальный, оральный или анальный секс; неполовая передача маловероятна при инфицировании взрослых. [5] Он также может передаваться новорожденному во время прохождения через родовые пути, если у матери невылеченная инфекция мочеполовых органов. Учитывая высокий уровень бессимптомной инфекции, все беременные женщины должны быть проверены на гонорею. [5] Однако, общественные ванны, полотенца или ткань, ректальные термометры и руки лиц, осуществляющих уход, были замешаны в качестве средств передачи в педиатрической обстановке. [46] Поцелуи также были замешаны в качестве теоретического средства передачи среди мужчин-геев, на основе более новых исследований. [47] [48] [49]
Традиционно считалось, что бактерия перемещается, прикрепляясь к сперматозоидам, но эта гипотеза не объясняла передачу заболевания от женщины к мужчине. Недавнее исследование предполагает, что вместо того, чтобы «плыть» по шевелящейся сперме , бактерии N. gonorrhoeae используют пили для закрепления на белках в сперме и перемещения через коитальную жидкость. [50]
Инфекция
Для N. gonorrhoeae первым шагом после успешной передачи является прикрепление к эпителиальным клеткам, обнаруженным на инфицированном участке слизистой оболочки. [51] Бактерия полагается на пили типа IV , которые прикрепляются и втягиваются, притягивая N. gonorrhoeae к эпителиальной мембране, где ее поверхностные белки, такие как белки непрозрачности, могут взаимодействовать напрямую. [51] После присоединения N. gonorrhoeae размножается и образует микроколонии . [52] Во время колонизации N. gonorrhoeae имеет потенциал для трансцитоза через эпителиальный барьер и проникновения в кровоток. [13] Во время роста и колонизации N. gonorrhoeae стимулирует высвобождение цитокинов и хемокинов из иммунных клеток хозяина, которые являются провоспалительными . [13] Эти провоспалительные молекулы приводят к привлечению макрофагов и нейтрофилов . [7] Эти фагоцитарные клетки обычно поглощают чужеродные патогены и уничтожают их, но N. gonorrhoeae выработала множество механизмов, которые позволяют ей выживать внутри этих иммунных клеток и препятствовать попыткам уничтожения. [7]
Профилактика
Распространение инфекции снижается при использовании латексных барьеров (например, презервативов или зубных прокладок ) во время секса и при ограничении числа сексуальных партнеров. [6] Презервативы и зубные прокладки следует использовать также во время орального и анального секса. Спермициды, вагинальные пены и спринцевания неэффективны для предотвращения распространения инфекции. [4]
Уход
Текущее лечение, рекомендованное CDC, представляет собой однократную инъекцию цефтриаксона ( цефалоспорин третьего поколения ). [53] Половые партнеры (определяемые CDC как половой контакт в течение последних 60 дней) [11] также должны быть уведомлены, проверены и пролечены. [6] [53] Важно, чтобы в случае сохранения симптомов после лечения инфекции N. gonorrhoeae была проведена повторная оценка. [53]
Устойчивость к антибиотикам
Устойчивость к антибиотикам при гонорее была отмечена с 1940-х годов. Гонорею лечили пенициллином, но дозы приходилось постепенно увеличивать, чтобы оставаться эффективными. К 1970-м годам гонорея, устойчивая к пенициллину и тетрациклину, появилась в Тихоокеанском бассейне. Затем эти устойчивые штаммы распространились на Гавайи, в Калифорнию, остальную часть Соединенных Штатов, Австралию и Европу. Фторхинолоны были следующей линией обороны, но вскоре появилась и устойчивость к этому антибиотику. С 2007 года стандартным лечением стали цефалоспорины третьего поколения, такие как цефтриаксон, которые считаются нашей «последней линией обороны». [54] [55] Недавно в Японии был обнаружен штамм гонореи с высокой устойчивостью к цефтриаксону под названием H041. Лабораторные тесты показали, что он устойчив к высоким концентрациям цефтриаксона, а также к большинству других протестированных антибиотиков. В N. gonorrhoeae существуют гены, которые обеспечивают устойчивость к каждому антибиотику, используемому для лечения гонореи, но до сих пор они не сосуществуют в пределах одного гонококка. Однако из-за высокой способности N. gonorrhoeae к горизонтальному переносу генов, гонорея, устойчивая к антибиотикам, рассматривается как новая угроза общественному здравоохранению. [55]
До 2007 года фторхинолон был распространенной рекомендацией по лечению гонореи. CDC прекратил предлагать эти системные бактериальные агенты, как только в Соединенных Штатах появился резистентный штамм N. gonorrhoeae . Удаление фторхинолонов как потенциального лечения оставило цефалоспорины как единственный жизнеспособный антимикробный вариант лечения гонореи. Опасаясь дальнейшей гонококковой резистентности, рекомендации CDC в 2010 году изменились на стратегию двойной терапии — цефалоспорин либо с азитромицином , либо с доксициклином . Несмотря на эти усилия, к 2011 году резистентные N. gonorrhoeae были зарегистрированы на пяти континентах, что еще больше ограничило варианты лечения и рекомендации. Устойчивость к антимикробным препаратам не является универсальной, и штаммы N. gonorrhoeae в Соединенных Штатах продолжают реагировать на комбинированный режим цефтриаксона и азитромицина. [56]
Устойчивость к сыворотке
Как грамотрицательная бактерия, N. gonorrhoeae требует защитных механизмов для защиты себя от системы комплемента (или каскада комплемента), компоненты которой обнаружены в сыворотке человека . [16] Существует три различных пути, которые активируют эту систему, однако все они приводят к активации белка комплемента 3 (C3). [57] Расщепленная часть этого белка, C3b , откладывается на патогенных поверхностях и приводит к опсонизации , а также к последующей активации комплекса мембранной атаки . [57] N. gonorrhoeae имеет несколько механизмов, чтобы избежать этого действия. [13] В целом эти механизмы называются сывороточной резистентностью. [13]
История
Происхождение имени
Neisseria gonorrhoeae названа в честь Альберта Нейссера, который выделил ее как возбудителя гонореи в 1878 году. [13] [3] Гален (130 г. н. э.) ввел термин «гонорея» от греческого gonos , что означает «семя» и rhoe , что означает «поток». [58] [7] Таким образом, гонорея означает «поток семени», описание, относящееся к белым выделениям из полового члена, предположительно, семенной жидкости, наблюдаемым при мужском заражении. [13]
Открытие
В 1878 году Альберт Нейссер выделил и визуализировал диплококки N. gonorrhoeae в образцах гноя от 35 мужчин и женщин с классическими симптомами мочеполовой инфекции гонореей — двое из которых также имели инфекции глаз. [7] В 1882 году Лейстиков и Леффлер смогли вырастить организм в культуре. [13] Затем в 1883 году Макс Бокхарт окончательно доказал, что бактерия, выделенная Альбертом Нейссером, была возбудителем заболевания, известного как гонорея, путем инокуляции полового члена здорового мужчины бактериями. [7] У мужчины развились классические симптомы гонореи через несколько дней, что удовлетворило последний из постулатов Коха . До этого момента исследователи спорили, являются ли сифилис и гонорея проявлениями одного и того же заболевания или двумя разными сущностями. [59] [7] Один из таких исследователей 18-го века, Джон Хантер, попытался урегулировать спор в 1767 году [7] , привив мужчине гной, взятый у пациента с гонореей. Он ошибочно заключил, что и сифилис, и гонорея были на самом деле одним и тем же заболеванием, когда у мужчины появилась сыпь медного цвета, которая является классической для сифилиса. [57] [59] Хотя многие источники повторяют, что Хантер привил себя сам, [57] [13] другие утверждают, что на самом деле это был другой мужчина. [60] После эксперимента Хантера другие ученые пытались опровергнуть его выводы, прививая других мужчин-врачей, студентов-медиков [13] и заключенных мужчин гонорейным гноем, у всех из которых развилось жжение и выделение гонореи. Один исследователь, Рикорд, взял на себя инициативу провести 667 прививок гонорейного гноя пациентам психиатрической больницы, при этом не было ни одного случая сифилиса. [7] [13] Примечательно, что появление пенициллина в 1940-х годах сделало доступным эффективное лечение гонореи. [ необходима цитата ]
Смотрите также
Ссылки
- ^ Euzéby JP, Parte AC. "Genus Neisseria". Список прокариотических названий со стоянием в номенклатуре (LPSN) . Получено 7 июля 2017 г.
- ^ Нейссер А (1879). «Ueber eine der Gonorrhoe eigentümliche Micrococusform» [О форме микрокока, свойственной гонорее]. Centralblatt für die medizinischen Wissenschaften (на немецком языке). 17 (28): 497–500.
- ^ abc O'Donnell JA, Gelone SP (2009). "Бактериальная причина PID: Gonorrhoeae". Воспалительные заболевания органов малого таза . Infobase Publishing. ISBN 978-1-4381-0159-0.
- ^ abcdefghijkl Райан К.Дж., Рэй К.Г., ред. (2004). Sherris Medical Microbiology (4-е изд.). McGraw Hill. ISBN 978-0-8385-8529-0.[ нужна страница ]
- ^ abcd "Подробные факты о ЗППП - Гонорея". www.cdc.gov . 26 сентября 2017 г. . Получено 7 декабря 2017 г. .
- ^ abcde "Руководство по лечению заболеваний, передающихся половым путем, 2015 г.". CDC . Центры по контролю и профилактике заболеваний, Министерство здравоохранения и социальных служб США. Архивировано из оригинала 22 декабря 2015 г.
- ^ abcdefghijklmnopq Hill SA, Masters TL, Wachter J (сентябрь 2016 г.). «Гонорея — развивающееся заболевание нового тысячелетия». Microbial Cell . 3 (9): 371–389. doi :10.15698/mic2016.09.524 (неактивен 13 сентября 2024 г.). PMC 5354566. PMID 28357376 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на сентябрь 2024 г. ( ссылка ) - ^ abcdefgh Левинсон В. (2014). Обзор медицинской микробиологии и иммунологии . McGraw-Hill Education. ISBN 978-0-07-181811-7. OCLC 871305336.[ нужна страница ]
- ^ "Заключительное заявление о рекомендациях: хламидиоз и гонорея: скрининг". Целевая группа профилактических служб США . Получено 7 декабря 2017 г.
- ^ abcde Ng LK, Martin IE (январь 2005 г.). «Лабораторная диагностика Neisseria gonorrhoeae». Канадский журнал инфекционных заболеваний и медицинской микробиологии . 16 (1): 15–25. doi : 10.1155/2005/323082 . PMC 2095009. PMID 18159523 .
- ^ ab "Гонококковые инфекции - Руководство по лечению ЗППП 2015". 4 января 2018 г.
- ^ MacKenzie CR, Henrich B, ред. (2012). Диагностика заболеваний, передающихся половым путем: методы и протоколы . Humana Press. ISBN 978-1-61779-936-5. OCLC 781681739.
- ^ abcdefghijk Quillin SJ, Seifert HS (апрель 2018 г.). «Адаптация и патогенез Neisseria gonorrhoeae к хозяину». Nature Reviews. Microbiology . 16 (4): 226–240. doi :10.1038/nrmicro.2017.169. PMC 6329377. PMID 29430011 .
- ^ Коста-Лоуренсо, Ана Паула Рамальо да; Баррос душ Сантуш, Кесия Таис; Морейра, Беатрис Мёрер; Фракаланцза, Серджио Эдуардо Лонго; Бонелли, Ракель Регина (1 октября 2017 г.). «Устойчивость Neisseria gonorrhoeae к противомикробным препаратам: история, молекулярные механизмы и эпидемиологические аспекты возникающей глобальной угрозы». Бразильский журнал микробиологии . 48 (4): 617–628. дои : 10.1016/j.bjm.2017.06.001. ISSN 1517-8382. ПМЦ 5628311 . ПМИД 28754299.
- ^ Ladhani SN, Lucidarme J, Parikh SR, Campbell H, Borrow R, Ramsay ME (июнь 2020 г.). «Менингококковая инфекция и ее половая передача: урогенитальные и аноректальные инфекции и инвазивное заболевание, вызванное Neisseria meningitidis». Lancet . 395 (10240): 1865–1877. doi :10.1016/S0140-6736(20)30913-2. PMID 32534649. S2CID 219701418.
- ^ abc Edwards JL, Apicella MA (октябрь 2004 г.). «Молекулярные механизмы, используемые Neisseria gonorrhoeae для инициирования инфекции, различаются у мужчин и женщин». Clinical Microbiology Reviews . 17 (4): 965–81, оглавление. doi :10.1128/CMR.17.4.965-981.2004. PMC 523569 . PMID 15489357.
- ^ Merz AJ, So M, Sheetz MP (сентябрь 2000 г.). «Втягивание пилуса обеспечивает бактериальную подергивающуюся подвижность». Nature . 407 (6800): 98–102. Bibcode :2000Natur.407...98M. doi :10.1038/35024105. PMID 10993081. S2CID 4425775.
- ^ Biais N, Ladoux B, Higashi D, So M, Sheetz M (апрель 2008 г.). «Кооперативная ретракция связанных пилей типа IV обеспечивает генерацию наноньютоновой силы». PLOS Biology . 6 (4): e87. doi : 10.1371/journal.pbio.0060087 . PMC 2292754 . PMID 18416602.
- ^ Freitag NE, Seifert HS, Koomey M (май 1995). "Характеристика локуса сборки пилей pilF-pilD Neisseria gonorrhoeae". Молекулярная микробиология . 16 (3): 575–586. doi :10.1111/j.1365-2958.1995.tb02420.x. hdl : 2027.42/72746 . PMID 7565116. S2CID 24580638.
- ^ Яковлевич В., Леонарди С., Хопперт М., Согаард-Андерсен Л. (апрель 2008 г.). «PilB и PilT представляют собой АТФазы, антагонистически действующие на функцию пилуса IV типа у Myxococcus xanthus». Журнал бактериологии . 190 (7): 2411–2421. дои : 10.1128/JB.01793-07. ПМК 2293208 . ПМИД 18223089.
- ^ Xu J, Seifert HS (ноябрь 2018 г.). «Анализ антигенной вариации пилина в Neisseria meningitidis с помощью секвенирования следующего поколения». Журнал бактериологии . 200 (22). doi :10.1128/JB.00465-18. PMC 6199478. PMID 30181126 .
- ^ Осведомленность о ИППП: гонорея. Planned Parenthood Advocates of Arizona. 11 апреля 2011 г. Получено 31 августа 2011 г.
- ^ Stern A, Brown M, Nickel P, Meyer TF (октябрь 1986 г.). «Гены непрозрачности в Neisseria gonorrhoeae: контроль фазы и антигенной изменчивости». Cell . 47 (1): 61–71. doi :10.1016/0092-8674(86)90366-1. PMID 3093085. S2CID 21366517.
- ^ Cahoon LA, Seifert HS (сентябрь 2011 г.). «Фокусирование гомологичной рекомбинации: антигенная вариация пилина у патогенных Neisseria». Молекулярная микробиология . 81 (5): 1136–1143. doi :10.1111/j.1365-2958.2011.07773.x. PMC 3181079. PMID 21812841 .
- ^ Obergfell KP, Seifert HS (февраль 2015 г.). «Подвижная ДНК патогенных Neisseria». Microbiology Spectrum . 3 (3). doi :10.1128/microbiolspec.MDNA3-0015-2014. PMC 4389775. PMID 25866700 .
- ^ Aas FE, Wolfgang M, Frye S, Dunham S, Løvold C, Koomey M (ноябрь 2002 г.). «Компетентность к естественной трансформации у Neisseria gonorrhoeae: компоненты связывания и поглощения ДНК, связанные с экспрессией пилей IV типа». Молекулярная микробиология . 46 (3): 749–760. doi : 10.1046/j.1365-2958.2002.03193.x . PMID 12410832. S2CID 21854666.
- ^ Simons MP, Nauseef WM, Apicella MA (апрель 2005 г.). «Взаимодействие Neisseria gonorrhoeae с адгезивными полиморфноядерными лейкоцитами». Инфекция и иммунитет . 73 (4): 1971–1977. doi :10.1128/iai.73.4.1971-1977.2005. PMC 1087443. PMID 15784537 .
- ^ Escobar A, Rodas PI, Acuña-Castillo C (2018). «Взаимодействие макрофагов и Neisseria gonorrhoeae: лучшее понимание патогенных механизмов иммуномодуляции». Frontiers in Immunology . 9 : 3044. doi : 10.3389/fimmu.2018.03044 . PMC 6309159. PMID 30627130 .
- ^ Stohl EA, Seifert HS (ноябрь 2006 г.). «Ферменты рекомбинации и восстановления ДНК Neisseria gonorrhoeae защищают от окислительного повреждения, вызванного перекисью водорода». Журнал бактериологии . 188 (21): 7645–7651. doi :10.1128/JB.00801-06. PMC 1636252. PMID 16936020 .
- ^ Michod RE, Bernstein H, Nedelcu AM (май 2008 г.). «Адаптивное значение пола у микробных патогенов». Инфекция, генетика и эволюция . 8 (3): 267–285. Bibcode : 2008InfGE...8..267M. doi : 10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Blokesch M (ноябрь 2016 г.). «Естественная компетентность для трансформации». Current Biology . 26 (21): R1126–R1130. Bibcode : 2016CBio...26R1126B. doi : 10.1016/j.cub.2016.08.058 . PMID 27825443.
- ^ "Статистика генома Neisseria gonorrhoeae". Broad Institute . Получено 8 апреля 2017 г.
- ^ Chung GT, Yoo JS, Oh HB, Lee YS, Cha SH, Kim SJ, Yoo CK (сентябрь 2008 г.). «Полная последовательность генома Neisseria gonorrhoeae NCCP11945». Журнал бактериологии . 190 (17): 6035–6036. doi :10.1128/JB.00566-08. PMC 2519540. PMID 18586945 .
- ^ Бурмейстер, Алита Р. (2015). «Горизонтальный перенос генов: Рисунок 1». Эволюция, медицина и общественное здравоохранение . 2015 (1): 193–194. doi :10.1093/emph/eov018. ISSN 2050-6201. PMC 4536854. PMID 26224621 .
- ^ Унемо, Магнус; Шафер, Уильям М. (август 2011 г.). «Устойчивость к антибиотикам у Neisseria gonorrhoeae: происхождение, эволюция и уроки, извлеченные на будущее». Анналы Нью-Йоркской академии наук . 1230 (1): E19-28. Bibcode : 2011NYASA1230E..19U. doi : 10.1111/j.1749-6632.2011.06215.x. ISSN 0077-8923. PMC 4510988. PMID 22239555 .
- ^ ab Spencer-Smith, Russell; Roberts, Sabrina; Gurung, Neesha; Snyder, Lori AS (25 августа 2016 г.). "Последовательности поглощения ДНК в Neisseria gonorrhoeae как внутренние терминаторы транскрипции и маркеры горизонтального переноса генов". Microbial Genomics . 2 (8): e000069. doi : 10.1099/mgen.0.000069 . ISSN 2057-5858. PMC 5320588 . PMID 28348864.
- ^ Manoharan-Basil, Sheeba Santhini; González, Natalia; Laumen, Jolein Gyonne Elise; Kenyon, Chris (17 марта 2022 г.). «Горизонтальный перенос генов, обусловливающих устойчивость к фторхинолонам, от комменсальной Neisseria к Neisseria gonorrhoeae: глобальный филогенетический анализ 20 047 изолятов». Frontiers in Microbiology . 13 . doi : 10.3389/fmicb.2022.793612 . ISSN 1664-302X. PMC 8973304 . PMID 35369513.
- ^ Гамильтон, Холли Л.; Диллард, Джозеф П. (январь 2006 г.). «Естественная трансформация Neisseria gonorrhoeae: от донорства ДНК до гомологичной рекомбинации». Молекулярная микробиология . 59 (2): 376–385. doi :10.1111/j.1365-2958.2005.04964.x. ISSN 0950-382X. PMID 16390436.
- ^ Anderson MT, Seifert HS (май 2011). «Neisseria gonorrhoeae и люди исполняют эволюционный танец LINE». Mobile Genetic Elements . 1 (1): 85–87. doi :10.4161/mge.1.1.15868. PMC 3190277. PMID 22016852 .
- ^ Anderson MT, Seifert HS (2011). «Возможность и средства: горизонтальный перенос генов от человека-хозяина к бактериальному патогену». mBio . 2 (1): e00005–e00011. doi :10.1128/mBio.00005-11. PMC 3042738 . PMID 21325040.
- ^ Detels R, Green AM, Klausner JD, Katzenstein D, Gaydos C, Handsfield H и др. (июнь 2011 г.). «Частота и корреляты симптоматических и бессимптомных инфекций Chlamydia trachomatis и Neisseria gonorrhoeae в отдельных популяциях в пяти странах». Заболевания, передаваемые половым путем . 38 (6): 503–509. doi :10.1097/OLQ.0b013e318206c288. PMC 3408314. PMID 22256336 .
- ^ abcdefghij Райан К.Дж., Рэй К.Г., ред. (2004). Sherris Medical Microbiology (4-е изд.). McGraw Hill. ISBN 978-0-8385-8529-0.[ нужна страница ]
- ^ abc "Гонококковые инфекции - Руководство по лечению ЗППП 2015". www.cdc.gov . Получено 7 декабря 2017 г. .
- ^ "Симптомы гонореи (триппера)". std-gov.org. 2 апреля 2015 г.
- ^ Caini S, Gandini S, Dudas M, Bremer V, Severi E, Gherasim A (август 2014 г.). «Инфекции, передающиеся половым путем, и риск рака простаты: систематический обзор и метаанализ». Cancer Epidemiology . 38 (4): 329–338. doi :10.1016/j.canep.2014.06.002. PMID 24986642.
- ^ Goodyear-Smith F (ноябрь 2007 г.). «Каковы доказательства неполовой передачи гонореи у детей после неонатального периода? Систематический обзор». Журнал судебной и юридической медицины . 14 (8): 489–502. doi :10.1016/j.jflm.2007.04.001. PMID 17961874.
- ^ Бевер Л. (10 мая 2019 г.). «Возможно, вам не обязательно заниматься сексом, чтобы передать гонорею, предполагает новое исследование». ScienceAlert . The Washington Post.
- ^ Chow EP, Cornelisse VJ, Williamson DA, Priest D, Hocking JS, Bradshaw CS и др. (ноябрь 2019 г.). «Поцелуи могут быть важным и игнорируемым фактором риска орофарингеальной гонореи: поперечное исследование среди мужчин, имеющих секс с мужчинами». Инфекции, передаваемые половым путем . 95 (7): 516–521. doi : 10.1136/sextrans-2018-053896 . PMID 31073095. S2CID 149446915.
- ^ Tran J, Ong JJ, Bradshaw CS, Chen MY, Kong FY, Hocking JS и др. (сентябрь 2022 г.). «Поцелуи, фелляция и аналингус как факторы риска орофарингеальной гонореи у мужчин, имеющих секс с мужчинами: поперечное исследование». eClinicalMedicine . 51 : 101557. doi :10.1016/j.eclinm.2022.101557. PMC 9294476 . PMID 35865738.
- ^ Anderson MT, Dewenter L, Maier B, Seifert HS (март 2014 г.). «Семенная плазма инициирует состояние передачи Neisseria gonorrhoeae». mBio . 5 (2): e01004–e01013. doi :10.1128/mBio.01004-13. PMC 3958800 . PMID 24595372.
- ^ ab Pearce WA, Buchanan TM (апрель 1978 г.). «Роль прикрепления гонококковых пилей. Оптимальные условия и количественная оценка прикрепления изолированных пилей к клеткам человека in vitro». Журнал клинических исследований . 61 (4): 931–943. doi :10.1172/JCI109018. PMC 372611. PMID 96134 .
- ^ Higashi DL, Lee SW, Snyder A, Weyand NJ, Bakke A, So M (октябрь 2007 г.). «Динамика прикрепления Neisseria gonorrhoeae: развитие микроколоний, образование кортикальных бляшек и цитопротекция». Инфекция и иммунитет . 75 (10): 4743–4753. doi :10.1128/IAI.00687-07. PMC 2044525. PMID 17682045 .
- ^ abc "CDC - Лечение гонореи". www.cdc.gov . 22 июля 2021 г. . Получено 11 апреля 2022 г. .
- ^ "Британские врачи сообщили, что гонорея стала устойчивой к лекарствам". BBC News . 10 октября 2011 г.
- ^ ab Осведомленность об ИППП: гонорея, устойчивая к антибиотикам. Planned Parenthood Advocates of Arizona. 6 марта 2012 г. Получено 6 марта 2012 г.
- ^ Tuddenham S, Hamill MM, Ghanem KG (январь 2022 г.). «Диагностика и лечение инфекций, передающихся половым путем: обзор». JAMA . 327 (2): 161–172. doi :10.1001/jama.2021.23487. PMID 35015033.
- ^ abcd Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001). «Система комплемента и врожденный иммунитет». Иммунобиология: иммунная система в здоровье и болезни. 5-е издание .
- ^ "гонорея | Происхождение и значение слова гонорея по данным словаря этимологии онлайн". www.etymonline.com . Получено 5 декабря 2017 г. .
- ^ ab Singal A, Grover C (2016). Комплексный подход к инфекциям в дерматологии . JP Medical. стр. 470. ISBN 978-93-5152-748-0.
- ^ Гладштейн Дж. (июль 2005 г.). «Шанкр Хантера: заразил ли хирург себя сифилисом?». Клинические инфекционные заболевания . 41 (1): 128, ответ автора 128-128, ответ автора 129. doi : 10.1086/430834 . PMID 15937780.
Внешние ссылки
- Тодар К. «Патогенные нейссерии: гонорея, неонатальная офтальмия и менингококковый менингит». Онлайн-учебник по бактериологии Тодара .
- Гонорея в eMedicine
- «Neisseria gonorrhoeae». Браузер таксономии NCBI . 485.
- Типовой штамм Neisseria gonorrhoeae в BacDive – базе метаданных бактериального разнообразия
