Микроцистин-LR
 | |
| Имена | |
|---|---|
| Название ИЮПАК (5 R ,8 S ,11 R ,12 S ,15 S ,18 S ,19 S ,22 R )-15-[3-(диаминометилиденамино)пропил]-18-[(1 E ,3 E ,5 S ,6 S )-6-метокси-3,5-диметил-7-фенилгепта-1,3-диенил]-1,5,12,19-тетраметил-2-метилиден-8-(2-метилпропил)-3,6,9,13,16,20,25-гептаоксо-1,4,7,10,14,17,21-гептазациклопентакозан-11,22-дикарбоновая кислота | |
| Другие имена 5- L -Аргинин-микроцистин LA | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Сокращения | MC-LR, MCYST-LR |
| ЧЭБИ | |
| ChEMBL | |
| ChemSpider | |
| Информационная карта ECHA | 100.150.186 |
| Номер ЕС |
|
| |
| КЕГГ |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С 49 Н 74 Н 10 О 12 | |
| Молярная масса | 995,189 г·моль −1 |
| Появление | Белое твердое вещество |
| Плотность | 1,299 г/см 3 |
| Растворимость в этаноле | 1 мг/мл |
| лог P | -1.44 |
| Фармакология | |
| Проглатывание | |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | чрезвычайно токсичен |
| Маркировка СГС : | |
 | |
| Опасность | |
| Х300 , Х310 , Х315 , Х317 , Х319 , Х335 | |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 5 мг/кг |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Микроцистин-LR ( MC-LR ) — токсин, вырабатываемый цианобактериями . Самый токсичный из микроцистинов .
Структура
Микроцистины представляют собой циклические гептапептиды . Семь аминокислот, которые участвуют в структуре микроцистина, включают уникальные аминокислоты ADDA и D -β-метил-изоаспартат ( D -β-Me-isoAsp). Кроме того, микроцистины содержат два вариабельных остатка, которые делают различия между вариантами микроцистинов. Эти две вариабельные функции всегда являются стандартными протеиногенными аминокислотами - в микроцистине-LR это лейцин и аргинин .
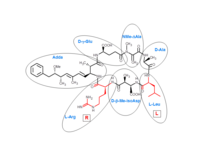
На сегодняшний день идентифицировано более 250 микроцистинов, [1] представляющих различия в двух вариабельных остатках и некоторые модификации в других аминокислотах. Эти модификации включают деметилирование Masp и Mdha и метилэстерификацию D -Glu. Различные микроцистины имеют различные профили токсичности, при этом микроцистин-LR оказался наиболее токсичным. [2] [3]
Биосинтез
Микроцистины — это небольшие нерибосомальные пептиды . У Microcystis aeruginosa микроцистин-LR синтезируется белками, которые кодируются кластером генов микроцистина размером 55 кб ( mcy ), содержащим 6 крупных (более 3 кб) генов, кодирующих белки с активностью поликетидсинтазы , активностью нерибосомальной пептидсинтазы ( mcyA-E и G ) и 4 меньших гена ( mcyF и HJ ). Эти крупные белки состоят из различных белковых доменов , называемых «модулями», каждый из которых имеет свою собственную специфическую ферментативную функцию. [4] Хотя ферментные системы, участвующие в биосинтезе микроцистинов, не идентичны среди всех цианобактерий, есть большое сходство, и большинство основных ферментов сохранены. [4] [5]
Биосинтез микроцистина-LR в Microcystis aeruginosa начинается с присоединения фенилацетата к ферменту mcyG . В серии реакций, катализируемых различными модулями ферментов, а также различными ферментами, образуется микроцистин-LR. Полный путь биосинтеза микроцистина-LR в Microcystis aeruginosa проиллюстрирован на рисунке.

Первые шаги синтеза включают вставку нескольких атомов углерода и кислорода между ацетил- и фенильной группой . Эта часть синтеза катализируется доменами ферментов, которые обладают активностью β-кетоацилсинтазы, ацилтрансферазы, C-метилтрансферазы и кетоацилредуктазы. В конце этой стадии, то есть после первой конденсации глутамата, образуется аминокислота Adda. [4] Вторая часть синтеза включает конденсацию аминокислот, из которых состоит микроцистин. Таким образом, в случае микроцистина-LR последовательная конденсация аминокислот глутаминовой кислоты, метилдегидроаланина, аланина, лейцина, метиласпарагиновой кислоты и аргинина приводит к связанному продукту. Нуклеофильная атака азота в остатке Adda приводит к высвобождению циклического микроцистина-LR. [4]
Различные микроцистины синтезируются теми же [ требуется разъяснение ] ферментами, что и микроцистин-LR. [6]
Механизм токсичности
Микроцистин-LR ингибирует активность протеинфосфатазы типа 1 и типа 2A ( PP1 и PP2A ) в цитоплазме клеток печени. Это приводит к увеличению фосфорилирования белков в клетках печени. Взаимодействие микроцистина-LR с фосфатазами включает образование ковалентной связи между метиленовой группой микроцистина-LR и остатком цистеина в каталитической субъединице семейства фосфопротеинфосфатазы (PPP) серин/треонин-специфических фосфатаз, таких как PP1 и PP2A. Когда микроцистин-LR связывается непосредственно с каталитическим центром ферментов PPP, они полностью блокируют доступ субстрата к активному сайту и происходит ингибирование фермента. Таким образом, протеинфосфатаза ингибируется, и в клетках печени остается больше фосфорилированных белков, что отвечает за гепатотоксичность микроцистина-LR.
Активный сайт каталитических ферментов PPP представляет собой три поверхностные бороздки: гидрофобную бороздку, кислотную бороздку и C-концевую бороздку, которые имеют Y-образную форму с активным сайтом в точке бифуркации. Боковая цепь Adda микроцистина-LR размещена в гидрофобной бороздке, карбоксильный сайт D-Glu образует водородные связи с металл-связанными молекулами воды, а карбоксильная группа сайта Masp образует водородные связи с консервативными остатками аргинина и тирозина в ферменте PPP. Наконец, метиленовая группа на сайте Mdha микроцистина-LR ковалентно связывается с S-атомом остатка цистеина, а остаток лейцина плотно прилегает к другому консервативному остатку тирозина. [2]
Эффекты
Microcystin-LR токсичен как для людей, так и для животных. Имеются эпидемиологические результаты исследований, которые показали симптомы отравления, связанные с наличием цианотоксинов в питьевой воде. Эффекты делятся на краткосрочные и долгосрочные.
Отравления людей
Нет никаких проверяемых сообщений о человеческих смертях, которые были бы вызваны именно микроцистином-LR, хотя есть сообщения о последствиях для здоровья после воздействия, и были случаи смерти, приписываемые микроцистинам в целом. [7] Одним из самых выдающихся сообщений была вспышка в Каруару , Бразилия , в 1996 году. 116 пациентов испытали множественные эффекты: нарушение зрения, тошноту, рвоту и мышечную слабость. У ста развилась острая печеночная недостаточность, а 52 страдали от симптомов того, что сейчас называется «синдромом Каруару». [8] Синдром был вызван диализной терапией с водой, которая не была должным образом очищена. [9]
Краткосрочные эффекты
Воздействие микроцистина-LR вызывает мало краткосрочных эффектов. Микроцистины в первую очередь являются гепатотоксичными соединениями; поэтому заметные токсические эффекты не проявляются немедленно. Большинство исследований токсичности проводились на мышах, которым делали внутрибрюшинные инъекции. Наиболее распространенным эффектом является повреждение печени, [10] Два наиболее часто встречающихся симптома — гастроэнтерит и холестатическое заболевание печени .
В эксперименте с мышами животные погибали в течение нескольких часов после инъекции смертельной дозы микоцистина-LR. Повреждение печени можно было заметить через 20 минут. В течение нескольких часов клетки печени погибали. [11]
Долгосрочные эффекты
Острая интоксикация микроцистином-LR может привести к долгосрочному повреждению, в то время как хроническое воздействие в малых дозах может вызвать неблагоприятные последствия для здоровья. Исследования на животных доказали, что при пероральном воздействии микроцистина-LR будет наблюдаться хроническое повреждение печени. Он может быть даже канцерогенным . В ходе исследований на животных были обнаружены раковые заболевания. Сам по себе микроцистин-LR не вызывает рак, но может стимулировать рост раковых клеток.
Эффекты животных
Микроцистин-LR оказал воздействие на всех животных, а не только на домашних животных, которые плавали в реке с питьевой водой, цветущей цианобактериями. Симптомы отравления домашних животных включают диарею, рвоту, слабость, лежачее положение и в большинстве случаев приводят к летальному исходу [12] [13]
Mircocystin-LR токсичен для всех животных, включая животных, потребляемых человеком. Рыбы и птицы также подвержены риску отравления microcystin-LR.
Пути воздействия
Цианобактерии предпочитают жить в водоемах, таких как озера, пруды, водохранилища и медленно текущие ручьи. Когда вода теплая, в ней достаточно питательных веществ для выживания бактерий. Большинство цианобактерий вырабатывают токсины, из которых микроцистин — лишь одна группа. Когда цианобактерия умирает, ее клеточная стенка разрушается, а токсины высвобождаются в воду. Микроцистины чрезвычайно стабильны в воде и выдерживают химическое разрушение, такое как гидролиз или окисление. Период полураспада этого токсина составляет 3 недели при pH 1 и 40 °C. Однако при типичных условиях в окружающей среде период полураспада составляет 10 недель. [10] Загрязнение воды микроцистином-LR устойчиво к кипячению и микроволновой обработке. [14]
После попадания в воду микроцистины активно поглощаются рыбами и птицами из отравленной воды и таким образом попадают в пищевую цепь . Люди также подвергаются воздействию микроцистинов, выполняя действия в отравленной воде. [15]
Распорядок дня и метаболизм
Распоряжение
Микроцистин-LR быстро выводится из плазмы крови. Периоды полураспада в плазме для α- и β-стадий, соответствующие распределению и выведению, составляют соответственно 0,8 и 6,9 минут. [16] [17] Общий клиренс соединения из плазмы составляет около 0,9 мл/мин. Выведение соединения происходит в основном через кал и мочу. Через 6 дней примерно 24% от принятого количества выводится из организма, из которых около 9% выводится через кал и 14,5% через мочу. [17]
Микроцистин-LR в основном концентрируется в печени. Другие ткани подвергаются воздействию в гораздо меньших количествах. [17]
Метаболизм
Данные о метаболизме микроцистина-LR у людей очень скудны. Данные о метаболизме и распределении токсина у мышей и крыс более широко доступны. У этих животных микроцистин-LR быстро концентрируется в печени. [18] Интоксикация мышей микроцистином-LR привела к снижению уровней цитохрома P450 и цитохрома b5 и повышению цитохрома P420, в который преобразуется CYP450. Вместе с тем фактом, что мыши с индуцированной более высокой концентрацией CYP450 меньше подвержены воздействию токсина, это позволяет предположить, что CYP450 играет важную роль в детоксикации соединения.
В фазе 2 биотрансформации соединение конъюгируется с несколькими различными эндогенными веществами. Известно, что микроцистин-LR выделяется в виде конъюгата глутатиона, конъюгата цистеина и окисленного диенового конъюгата ADDA. Конъюгат глутатиона и цистеина с Mda-фрагментом. Окисленный ADDA конъюгируется по конъюгированной связи . [19]
Токсичность
Токсические эффекты цианотоксинов весьма разнообразны и включают нейротоксичность , гепатотоксичность и цитотоксичность с химическими ожогами . Микроцистины, как правило, связаны с гепатотоксичностью. Токсическое действие микроцистинов обусловлено их ингибированием протеинфосфатаз. [20]
Острая подострая токсичность
Многие исследования проводились с внутрибрюшинным введением . Из-за различий в липофильности и полярности между различными микроцистинами нельзя предположить, что ip LD50 будет предсказывать токсичность после перорального введения. [10]
Микроцистины являются гепатотоксинами. После острого воздействия тяжелое повреждение печени заметно по нарушению структуры клеток печени. Вес печени увеличится из-за внутрипеченочного кровоизлияния , гемодинамического шока, сердечной недостаточности и смерти. [10]
После назального введения микроцистина-LR эпителий слизистой оболочки носа как обонятельной, так и респираторной зон страдал от некроза. После перорального введения были отмечены даже поражения печени. LD50 при назальном введении равна внутрибрюшинному введению.
Повторный пероральный прием
Для оценки возможных хронических эффектов на здоровье человека наиболее желательны исследования, включающие повторное пероральное введение чистых микроцистинов в различных дозах. В исследовании на мышах чистый мироцистин-LR вводился перорально в дозах 0, 40, 200 или 1000 мкг/кг веса тела. При самой высокой дозе почти у всех мышей наблюдались изменения печени и хроническое воспаление, а также несколько других симптомов. У самок мышей при самой высокой дозе наблюдались только изменения трансаминаз. [10]
Канцерогенность
Микроцистин отдельно
У мышей наблюдались неопластические узелки печени после 100 пероральных приемов в дозе 20 мкг/кг веса тела. Наблюдаемые узелки были до 5 мм в диаметре. Однако ни у одной мыши не наблюдалось узелков печени после 100 приемов в дозе 80 мкг/кг.
Взаимодействие с опухолями
Комитет МАИР пришел к выводу, что микроцистин-LR, возможно, канцерогенен для человека. Таким образом, сам по себе микроцистин-LR не является канцерогеном, но стимулирует рост опухолей. У мышей, которым вводили канцерогенное соединение диметилбензатрацен, наблюдалось увеличение количества и веса опухолей кожи. [7]
В естественных условияхэксперименты на животных
Об острой токсичности для человека известно очень мало, но исследования на животных показали следующие результаты.
| Способ применения [21] | Токсичность | Разновидность | Ценить |
|---|---|---|---|
| Оральный | ЛД50 | Мышь | 5 мг/кг |
| Ингаляция, 10ч. | ЛК50 | Мышь | 18 мг/кг |
| Внутрибрюшинный | ЛД50 | Крыса | 0,05 мг/кг |
| Внутрибрюшинный | ЛД50 | Мышь | 0,0325 мг/кг |
| Внутривенно | ЛД50 | Мышь | 0,06 мг/кг |
Когда микроцистины вводятся внутривенно или внутрибрюшинно , они локализуются в печени. По-видимому, это является результатом поглощения гепатоцитами . В отчете ВОЗ говорится, что микроцистины смертельны для мышей, когда они подвергаются внутрибрюшинному воздействию в дозе от 25 до 150 мкг/кг веса тела. [10] Возможно, из-за плохого всасывания после воздействия перорально вводимые микроцистины менее токсичны, так как летальная доза для мышей составляет около 5-10 мкг/кг веса тела. Гепатотоксичность в виде некроза печени наступает в течение 60 минут после внутривенной дозы. [20] Цветение Microcystis aeruginosa не вызывало увеличения частоты опухолей в группах мышей, лечившихся до одного года. Показано, что у мышей, которым давали 20 мкг/кг веса тела 4 раза в неделю в течение 28 недель, развились новообразования печени. [20] Однако результаты неоднозначны. При пероральном введении микроцистин-LR проявляет острую токсичность у грызунов. Очевидно, что значительное количество пероральной дозы проходит через кишечный барьер.
Эффекты развития
Микроцистины, по-видимому, не оказывают токсического воздействия на развитие.
Генотоксичность
ВОЗ утверждает, что микроцистин-LR не обладает мутагенным эффектом. Однако индукция разрывов ДНК-цепей в лимфоцитах наблюдалась у мышей после однократного перорального введения. Эффект зависит от времени и дозы. Не наблюдается никаких изменений в экспрессии выбранных генов, участвующих в клеточной реакции на повреждение ДНК после 4-часового воздействия. Через 24 часа гены, реагирующие на повреждение ДНК, были повышены, что указывает на то, что микроцистин-LR является косвенным генотоксическим агентом. [22] В Китае самая высокая заболеваемость раком печени наблюдается в районах с обилием цианобактерий в поверхностных водах. Развитие опухолей связано с воздействием низких концентраций в течение длительного периода времени. [20]
В пробиркеисследования
Исследования in vitro показали, что микроцистин-LR является мощным ингибитором протеинфосфатазы 1 (PP-1) и PP2A , но не оказывает влияния на протеинкиназу C или циклическую АМФ-зависимую киназу . Мутагенность, по-видимому, не проявляется для очищенных токсинов, полученных из Microcystis , хотя токсины были кластогенными для человеческих лимфоцитов. [20]
Биодеградация
Фермент металлопротеаза, выделенный из бактерий в озере Роторуа , среди других мест, называется микроцистиназой . Этот конкретный фермент превращает микроцистины в продукты с 160-кратным снижением токсичности. [23]
История
Китайский генерал Чжу-Гэ Лян был первым, кто наблюдал отравление цианобактериями около 1000 лет назад. Он сообщил о смерти солдат, которые пили зеленую воду из реки на юге Китая. [ требуется цитата ] Первый опубликованный отчет о случае отравления цианобактериями датируется отравлением австралийского озера в 1878 году. [24] Кроме того, в Китае и Бразилии люди умирали после употребления воды из озера. Все эти инциденты были приписаны цианобактериям и токсичному соединению микроцистин-LR. Вот почему Всемирная организация здравоохранения (ВОЗ) выпустила руководство по микроцистинам в питьевой воде. Руководство ВОЗ по микроцистинам в питьевой воде, основанное на микроцистине-LR, составляет 1 мкг/л. [16] При высоких уровнях эвтрофикации в Южной Африке типичное воздействие может достигать 10 мкг/л. [25] [26] [27] [28]
Ссылки
- ^ Структурное разнообразие, характеристика и токсикология микроцистинов , doi: 10.3390/toxins11120714
- ^ ab S. Pereira, V. Vasconcelos & A. Antunes, Вычислительное исследование ковалентного связывания микроцистинов с остатками цистеина — реакция, участвующая в ингибировании семейства протеинфосфатаз PPP , FEBS Journal, doi: 10.1111/j.1742-4658.2011.08454.x
- ^ А. Кампос и В. Васконселос, Молекулярные механизмы токсичности микроцистина в клетках животных , Int. J. Mol. Sc., 11(1), стр. 268-287
- ^ abcd D. Tillett et al., Структурная организация биосинтеза микроцистина в Microcystis aeruginosa PCC7806: интегрированная система пептид-поликетидсинтетазы , Chem. Biol., 7(10), стр. 753-764
- ^ Г. Кристиансен и др., Биосинтез микроцистина в Planktothrix: гены, эволюция и манипуляция , J. Bacteriol., 185(2), стр. 564-572
- ^ T. Nishizawa et al., Ген поликетидсинтазы, связанный с модулем пептидсинтетазы, участвующим в биосинтезе циклического гептапептида микроцистина , J. Biochem., 127(5), стр.779-789
- ^ ab Bulter, N., Carlisle, JC Микроцистины: краткий обзор их токсичности и воздействия, с особым упором на рыбу, диких животных и домашний скот. Департамент водных ресурсов, Калифорния. Январь 2009 г.
- ^ Азеведо, SM и др., Интоксикация человека микроцистинами во время лечения почечным диализом в Каруару, Бразилия. Токсикология, 2002. 181-182 : стр. 441-6.
- ^ Йохимсен, Э.М. и др., Печеночная недостаточность и смерть после воздействия микроцистинов в центре гемодиализа в Бразилии . N Engl J Med, 1998. 338 (13): стр. 873-8.
- ^ abcdef ВОЗ (2003) Токсины цианобактерий: Микроцистин-LR в питьевой воде. Справочный документ для подготовки Руководства ВОЗ по качеству питьевой воды . Женева, Всемирная организация здравоохранения (WHO/SDE/WSH/03.04/57).
- ^ Слаткин, Д.Н. и др., Атипичный тромбоз легких, вызванный токсичным пептидом цианобактерий . Science, 1983. 220 (4604): стр. 1383-5.
- ^ DeVries, SE, et al., Клинические и патологические результаты интоксикации сине-зелеными водорослями (Microcystis aeruginosa) у собаки. Журнал ветеринарных диагностических исследований, 1993. 5 (3): стр. 403.
- ^ Бриан, Дж. Ф. и др., Опасности для здоровья наземных позвоночных от токсичных цианобактерий в поверхностных водных экосистемах. Vet Res, 2003. 34 (4): стр. 361-77.
- ^ Меткалф, Джеймс С.; Кодд, Джеффри А. (2000). «Извлечение гепатотоксинов из клеток цианобактерий в микроволновой печи и кипящей водяной бане». FEMS Microbiology Letters . 184 (2): 241– 246. doi : 10.1111/j.1574-6968.2000.tb09021.x . PMID 10713428.
- ^ Харада, КИ и др., Стабильность микроцистинов из цианобактерий. III. Влияние pH и температуры Phycologia, 1996. 35(6) стр. 83-88
- ^ ab Chorus, I., и J. Bartram, Токсичные цианобактерии в воде; Руководство по их последствиям для общественного здравоохранения, мониторингу и управлению. Лондон: E & FN Spon, 1999.
- ^ abc Робинсон, NA, Пейс, JG, Мэтсон, CF, Миура, GA и Лоуренс, WB 1991 Распределение в тканях, экскреция и печеночная биотрансформация микроцистина-LR у мышей , J.Pharmacol. Exp. Ther., 256(1), 176-182.
- ^ Брукс, WP и Кодд, GA 1987 Распределение пептидного токсина Microcystis aeruginosa и взаимодействие с микросомами печени у мышей Pharmacol. Toxicol., 60(3), 187-191.
- ^ Кондо, Ф., Мацумото, Х., Ямада, С., Исикава, Н., Ито, Э., Нагата, С., Уэно, И., Сузуки, М. и Харада, К.-И. 1996 Обнаружение и идентификация метаболитов микроцистинов, образующихся in vivo в печени мышей и крыс Chem. Res. Toxicol., 9(8), 1355-1359.
- ^ abcde Отчет о токсичности микроцистина Национальной токсикологической программы, https://ntp.niehs.nih.gov/ntp/htdocs/chem_background/exsumpdf/microcystin_508.pdf (дата обращения: 1 марта 2012 г.)
- ^ Информация о продукции Sigma Aldrich, http://www.sigmaaldrich.com/catalog/product/sigma/m2912 (дата обращения: 1 марта 2012 г.)
- ^ Зегура. Б. и др. Микроцистин-LR вызвал повреждение ДНК в лимфоцитах периферической крови человека . Mutation Research 725 (2011). 116-122
- ^ Somdee, Theerasak; Thunders, Michelle; Ruck, John; Lys, Isabelle; Allison, Margaret; Page, Rachel (2013). «Деградация [Dha7]MC-LR бактерией, разрушающей микроцистин, выделенной из озера Ротоити, Новая Зеландия». ISRN Microbiology . 2013 : 1– 8. doi : 10.1155 /2013/596429 . PMC 3712209. PMID 23936728.
- ^ Фрэнсис, Г. Ядовитые австралийские озера Природа 18, 11-12 (1878)
- ^ Oberholster, PJ, Cloete, TE, van Ginkel, C., Botha, AM. & Ashton, PJ 2008. Использование дистанционного зондирования и молекулярных маркеров в качестве ранних предупреждающих индикаторов развития цианобактериальной гиперпунцитовой корки и генотипов, продуцирующих микроцистин, в гипертрофном озере Хартебиспурт, Южная Африка. Претория: Совет по научным и промышленным исследованиям (CSIR).
- ^ Turton, AR 2015. Загрязнение воды и бедные в Южной Африке. Йоханнесбург: Южноафриканский институт расовых отношений. http://irr.org.za/reports-and-publications/occasional-reports/files/water-pollution-and-south-africas-poor Архивировано 12.03.2017 в Wayback Machine
- ^ Turton, AR 2016. Южная Африка и засуха, которая обнажила молодую демократию. В Водной политике (18); 210 – 227. http://wp.iwaponline.com/content/ppiwawaterpol/18/S2/210.full.pdf
- ^ Мэтьюз, М. В. и Барнард, С. 2015. Эвтрофикация и цианобактерии в стоячих водоемах Южной Африки: взгляд из космоса. В Южноафриканском научном журнале. Т. 111. № 5/6.



