Матрично-активированная лазерная десорбция/ионизация

В масс-спектрометрии матрично -ассистированная лазерная десорбция/ионизация ( MALDI ) — это метод ионизации , который использует поглощающую лазерную энергию матрицу для создания ионов из больших молекул с минимальной фрагментацией. [1] Он применялся для анализа биомолекул ( биополимеров , таких как ДНК , белки , пептиды и углеводы ) и различных органических молекул (таких как полимеры , дендримеры и другие макромолекулы ), которые, как правило, хрупкие и фрагментируются при ионизации более традиционными методами ионизации. По характеру он похож на ионизацию электрораспылением (ESI), поскольку оба метода являются относительно мягкими (с низкой фрагментацией) способами получения ионов больших молекул в газовой фазе, хотя MALDI обычно производит гораздо меньше многозарядных ионов.
Методология MALDI представляет собой трехэтапный процесс. Во-первых, образец смешивается с подходящим материалом матрицы и наносится на металлическую пластину. Во-вторых, импульсный лазер облучает образец, вызывая абляцию и десорбцию образца и материала матрицы. Наконец, молекулы аналита ионизируются путем протонирования или депротонирования в горячем шлейфе аблированных газов, а затем их можно ускорить в любом масс-спектрометре, который используется для их анализа. [2]
История
Термин «матрично-ассистированная лазерная десорбционная ионизация» (MALDI) был придуман в 1985 году Францем Хилленкампом , Майклом Карасом и их коллегами. [3] Эти исследователи обнаружили, что аминокислота аланин может быть ионизирована легче, если ее смешать с аминокислотой триптофаном и облучить импульсным лазером с длиной волны 266 нм. Триптофан поглощал энергию лазера и помогал ионизировать непоглощающий аланин. Пептиды вплоть до пептида мелиттина массой 2843 Да могли быть ионизированы при смешивании с такой «матрицей». [4] Прорыв в области лазерной десорбционной ионизации больших молекул произошел в 1987 году, когда Коичи Танака из Shimadzu Corporation и его коллеги использовали то, что они назвали «методом сверхтонкого металла плюс жидкой матрицы», который объединял 30-нм частицы кобальта в глицерине с 337-нм азотным лазером для ионизации. [5] Используя эту комбинацию лазера и матрицы, Танака смог ионизировать биомолекулы размером с белок карбоксипептидазу-А массой 34 472 Да. Танака получил четверть Нобелевской премии по химии 2002 года за демонстрацию того, что при правильном сочетании длины волны лазера и матрицы белок может быть ионизирован. [6] Карас и Хилленкамп впоследствии смогли ионизировать белок альбумин массой 67 кДа, используя матрицу никотиновой кислоты и лазер с длиной волны 266 нм. [7] Дальнейшие усовершенствования были реализованы за счет использования лазера с длиной волны 355 нм и производных коричной кислоты : феруловой кислоты , кофейной кислоты и синапиновой кислоты в качестве матрицы. [8] Доступность небольших и относительно недорогих азотных лазеров, работающих на длине волны 337 нм, и первые коммерческие приборы, представленные в начале 1990-х годов, привлекли все большее число исследователей к MALDI. [9] Сегодня для масс-спектрометрии МАЛДИ используются в основном органические матрицы.
Матрица
| Сложный | Другие имена | Растворитель | Длина волны (нм) | Приложения |
|---|---|---|---|---|
| 2,5-дигидроксибензойная кислота (гентизиновая кислота) [10] | DHB, гентизиновая кислота | ацетонитрил , вода , метанол , ацетон , хлороформ | 337, 355, 266 | пептиды , нуклеотиды , олигонуклеотиды , олигосахариды |
| 3,5-диметокси-4-гидроксикоричная кислота [8] [11] | синапиновая кислота; синапиновая кислота; СА | ацетонитрил, вода, ацетон, хлороформ | 337, 355, 266 | пептиды, белки, липиды |
| 4-гидрокси-3-метоксикоричная кислота [8] [11] | феруловая кислота | ацетонитрил, вода, пропанол | 337, 355, 266 | белки |
| α-циано-4-гидроксикоричная кислота [12] | ЧКА | ацетонитрил, вода, этанол , ацетон | 337, 355 | пептиды, липиды, нуклеотиды |
| Пиколиновая кислота [13] | ПА | этанол | 266 | олигонуклеотиды |
| 3-гидроксипиколиновая кислота [14] | HPA | этанол | 337, 355 | олигонуклеотиды |
Матрица состоит из кристаллизованных молекул , из которых три наиболее часто используемые — это синапиновая кислота , α-циано-4-гидроксикоричная кислота ( α-CHCA, альфа-циано или альфа-матрица) и 2,5-дигидроксибензойная кислота (DHB). [15] Раствор одной из этих молекул делается, часто в смеси высокоочищенной воды и органического растворителя, такого как ацетонитрил (ACN) или этанол. Источник противоиона, такой как трифторуксусная кислота (TFA), обычно добавляется для получения ионов [M+H]. Хорошим примером матричного раствора будет 20 мг/мл синапиновой кислоты в ACN:вода:TFA (50:50:0,1).

Идентификация подходящих матричных соединений в некоторой степени определяется методом проб и ошибок, но они основаны на некоторых конкретных соображениях молекулярного дизайна. Они имеют довольно низкую молекулярную массу (чтобы обеспечить легкое испарение), но достаточно большие (с достаточно низким давлением паров), чтобы не испаряться во время подготовки образца или во время нахождения в масс-спектрометре. Они часто являются кислыми, поэтому действуют как источник протонов, способствуя ионизации аналита. Сообщалось также об основных матрицах. [16] Они обладают сильным оптическим поглощением как в УФ-, так и в ИК-диапазоне, [17] поэтому они быстро и эффективно поглощают лазерное облучение. Эта эффективность обычно связана с химическими структурами, включающими несколько сопряженных двойных связей , как видно в структуре коричной кислоты . Они функционализированы полярными группами, что позволяет использовать их в водных растворах. Обычно они содержат хромофор .
Раствор матрицы смешивается с аналитом (например, образцом белка ). Смесь воды и органического растворителя позволяет как гидрофобным , так и водорастворимым ( гидрофильным ) молекулам растворяться в растворе. Этот раствор наносится на пластину MALDI (обычно металлическую пластину, предназначенную для этой цели). Растворители испаряются, оставляя только перекристаллизованную матрицу, но теперь с молекулами аналита, встроенными в кристаллы MALDI. Говорят, что матрица и аналит сокристаллизованы. Сокристаллизация является ключевым вопросом при выборе правильной матрицы для получения качественного масс-спектра интересующего аналита.
При анализе биологических систем неорганические соли, которые также входят в состав белковых экстрактов, мешают процессу ионизации. Соли можно удалить твердофазной экстракцией или промывкой пятен MALDI высушенных капель холодной водой. [18] Оба метода также могут удалять другие вещества из образца. Смесь матрицы и белка не является однородной, поскольку разница полярности приводит к разделению двух веществ во время совместной кристаллизации. Диаметр пятна мишени намного больше диаметра лазера, что делает необходимым делать много лазерных выстрелов в разных местах мишени, чтобы получить статистическое среднее значение концентрации вещества в пятне мишени.
Матрицу можно использовать для настройки прибора на ионизацию образца различными способами. Как упоминалось выше, для ионизации образца часто используются кислотно-основные реакции, однако молекулы с сопряженными пи-системами , такие как нафталиноподобные соединения, также могут служить акцептором электронов и, таким образом, матрицей для MALDI/TOF. [19] Это особенно полезно при изучении молекул, которые также обладают сопряженными пи-системами. [20] Наиболее широко используемым применением этих матриц является изучение порфириноподобных соединений, таких как хлорофилл . Было показано, что эти матрицы имеют лучшие образцы ионизации, которые не приводят к странным образцам фрагментации или полной потере боковых цепей. [21] Также было высказано предположение, что сопряженные порфириноподобные молекулы могут служить матрицей и расщеплять себя, устраняя необходимость в отдельном матричном соединении. [22]
Инструментарий
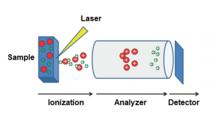
Существует несколько разновидностей технологии MALDI, и сегодня производятся сопоставимые приборы для самых разных целей: от более академических и аналитических до более промышленных и высокопроизводительных. Область масс-спектрометрии расширилась до требующей сверхвысокоразрешающей масс-спектрометрии, такой как приборы FT-ICR [23] [24] , а также более высокопроизводительных приборов. [25] Поскольку многие приборы MALDI MS можно купить со сменным источником ионизации ( ионизация электрораспылением , MALDI, ионизация при атмосферном давлении и т. д.), технологии часто пересекаются, и во многих случаях потенциально может быть использован любой метод мягкой ионизации. Для получения дополнительных разновидностей методов мягкой ионизации см.: Мягкая лазерная десорбция или Источник ионов .
Лазер
Методы MALDI обычно предполагают использование УФ -лазеров, таких как азотные лазеры (337 нм) и лазеры Nd:YAG с утроенной и учетверенной частотой (355 нм и 266 нм соответственно). [26]
Длины волн инфракрасного лазера, используемые для инфракрасной MALDI, включают 2,94 мкм лазер Er:YAG , оптический параметрический осциллятор среднего ИК-диапазона и 10,6 мкм лазер на диоксиде углерода . Хотя и не так распространены, инфракрасные лазеры используются из-за их более мягкого режима ионизации. [27] IR-MALDI также имеет преимущество большего удаления материала (полезно для биологических образцов), меньше помех малой массы и совместимость с другими методами лазерной десорбционной масс-спектрометрии без матрицы.
Время полета

Тип масс-спектрометра, наиболее широко используемый с MALDI, — это времяпролетный масс-спектрометр (TOF), в основном из-за его большого диапазона масс. Процедура измерения TOF также идеально подходит для процесса ионизации MALDI, поскольку импульсный лазер делает отдельные «выстрелы», а не работает в непрерывном режиме. Приборы MALDI-TOF часто оснащены рефлектроном ( «ионным зеркалом»), который отражает ионы с помощью электрического поля. Это увеличивает траекторию полета ионов, тем самым увеличивая время пролета между ионами с разным m/z и повышая разрешение. Современные коммерческие рефлектронные приборы TOF достигают разрешающей способности m/Δm 50 000 FWHM (полная ширина на полумаксимуме, Δm определяется как ширина пика при 50% высоты пика) или более. [28]
MALDI был объединен с IMS -TOF MS для идентификации фосфорилированных и нефосфорилированных пептидов. [29] [30]
Было показано, что MALDI- FT-ICR MS является полезным методом, когда требуются измерения MALDI-MS с высоким разрешением. [31]
Атмосферное давление
Матрично-лазерная десорбция/ионизация при атмосферном давлении (МАЛДИ) — это метод ионизации (источник ионов), который в отличие от вакуумного МАЛДИ работает в обычных атмосферных условиях. [32] Основное различие между вакуумным МАЛДИ и AP-MALDI заключается в давлении, при котором создаются ионы. В вакуумном МАЛДИ ионы обычно производятся при 10 мТорр или менее, тогда как в AP-MALDI ионы образуются при атмосферном давлении. В прошлом основным недостатком метода AP-MALDI по сравнению с обычным вакуумным МАЛДИ была его ограниченная чувствительность; однако ионы можно переносить в масс-спектрометр с высокой эффективностью, и сообщалось о пределах обнаружения в аттомоль. [33] AP-MALDI используется в масс-спектрометрии (МС) в различных приложениях, начиная от протеомики и заканчивая открытием лекарств. Популярные темы, которые решает масс-спектрометрия AP-MALDI, включают: протеомику; Массовый анализ ДНК, РНК, ПНК, липидов, олигосахаридов, фосфопептидов, бактерий, малых молекул и синтетических полимеров, аналогичные приложения, доступные также для вакуумных инструментов MALDI. Источник ионов AP-MALDI легко соединяется с масс-спектрометром с ионной ловушкой [34] или любой другой системой MS, оснащенной источником электрораспылительной ионизации (ESI) или нано-ESI.
Известно, что MALDI с ионизацией при пониженном давлении производит в основном однозарядные ионы (см. «Механизм ионизации» ниже). Напротив, ионизация при атмосферном давлении может генерировать высокозаряженные аналиты, как это было впервые показано для инфракрасных [35] , а затем также для азотных лазеров. [36] Многократная зарядка аналитов имеет большое значение, поскольку она позволяет измерять высокомолекулярные соединения, такие как белки, в приборах, которые обеспечивают только меньшие диапазоны обнаружения m/z, такие как квадруполи. Помимо давления, для достижения этого эффекта важен состав матрицы.
Аэрозоль
В аэрозольной масс-спектрометрии один из методов ионизации заключается в воздействии лазера на отдельные капли. Эти системы называются одночастичными масс-спектрометрами (SPMS) . [37] Образец может быть дополнительно смешан с матрицей MALDI перед аэрозолизацией.
Механизм ионизации
Лазер выстреливает в кристаллы матрицы в пятне высушенной капли. Матрица поглощает энергию лазера, и считается, что в первую очередь матрица десорбируется и ионизируется (добавлением протона ) этим событием. Горячий шлейф, образующийся во время абляции, содержит много видов: нейтральные и ионизированные молекулы матрицы, протонированные и депротонированные молекулы матрицы, кластеры матрицы и нанокапли . Абляционные виды могут участвовать в ионизации аналита, хотя механизм MALDI все еще обсуждается. Затем считается, что матрица переносит протоны к молекулам аналита (например, молекулам белка), таким образом заряжая аналит. [38] Ион, наблюдаемый после этого процесса, будет состоять из исходной нейтральной молекулы [M] с добавленными или удаленными ионами. Это называется квазимолекулярным ионом, например, [M+H] + в случае добавленного протона, [M+Na] + в случае добавленного иона натрия или [MH] − в случае удаленного протона. MALDI способна создавать однозарядные ионы или многозарядные ионы ([M+nH] n+ ) в зависимости от природы матрицы, интенсивности лазера и/или используемого напряжения. Обратите внимание, что все это виды с четными электронами. Ионные сигналы радикальных катионов (фотоионизированных молекул) можно наблюдать, например, в случае молекул матрицы и других органических молекул.
Модель переноса протонов в газовой фазе [2] , реализованная как модель связанной физической и химической динамики (CPCD) [39] УФ-лазера MALDI, постулирует первичные и вторичные процессы, приводящие к ионизации. [40] Первичные процессы включают начальное разделение зарядов посредством поглощения фотонов матрицей и объединения энергии для формирования пар ионов матрицы. Образование первичных ионов происходит посредством поглощения УФ-фотона для создания возбужденных молекул
- S0 + hν → S1
- С1 + С1 → С0 + Сn
- С 1 + С n → М + + М −
где S 0 — основное электронное состояние, S 1 — первое электронное возбужденное состояние, а S n — более высокое электронное возбужденное состояние. [39] Ионы-продукты могут быть парами ионов с переносом протона или электрона, обозначенными выше как M + и M − . Вторичные процессы включают ионно-молекулярные реакции для образования ионов аналита.

Модель «счастливого выжившего» (механизм ионизации кластера [2] ) постулирует, что молекулы аналита включаются в матрицу, сохраняя зарядовое состояние из раствора. [41] [42] Образование ионов происходит путем разделения заряда при фрагментации кластеров, удаленных лазером. [2] Ионы, которые не нейтрализуются рекомбинацией с фотоэлектронами или противоионами, называются «счастливыми выжившими».
Тепловая модель постулирует, что высокая температура облегчает перенос протонов между матрицей и аналитом в расплавленной матричной жидкости. [43] Соотношение ионов к нейтральным ионам является важным параметром для обоснования теоретической модели, и ошибочное цитирование соотношения ионов к нейтральным ионам может привести к ошибочному определению механизма ионизации. [44] Модель количественно предсказывает увеличение общей интенсивности ионов в зависимости от концентрации и сродства к протонам аналитов, а также соотношение ионов к нейтральным ионам в зависимости от плотности потока лазерного излучения. [45] [46] Эта модель также предполагает, что аддукты ионов металлов (например, [M+Na] + или [M+K] + ) в основном образуются из термически индуцированного растворения соли. [47]
Метод ионизации с помощью матрицы (MAI) использует подготовку матрицы, аналогичную MALDI, но не требует лазерной абляции для получения аналитических ионов летучих или нелетучих соединений. [48] Простое воздействие вакуума масс-спектрометра на матрицу с аналитом создает ионы с почти идентичными зарядовыми состояниями для электрораспылительной ионизации. [49] Предполагается, что между этим процессом и MALDI, вероятно, есть механистическая общность. [42]
Выход ионов обычно оценивается в диапазоне от 10−4 до 10−7 , [ 50] с некоторыми экспериментами, намекающими на даже более низкие выходы 10−9 . [ 51] Проблема низкого выхода ионов была решена уже вскоре после внедрения MALDI различными попытками, включая постионизацию с использованием второго лазера. [52] Большинство этих попыток показали лишь ограниченный успех с низким увеличением сигнала. Это может быть связано с тем фактом, что использовались аксиальные времяпролетные приборы, которые работают при давлениях в области источника от 10−5 до 10−6 , что приводит к быстрому расширению струи со скоростями частиц до 1000 м/с. [53] В 2015 году сообщалось об успешной лазерной постионизации с использованием модифицированного источника MALDI, работающего при повышенном давлении ~3 мбар, соединенного с ортогональным времяпролетным масс-анализатором, и использующего настраиваемый по длине волны постионизационный лазер, работающий на длине волны от 260 нм до 280 нм, что ниже порога двухфотонной ионизации используемых матриц, что увеличило выход ионов нескольких липидов и малых молекул до трех порядков величины. [54] Этот подход, названный MALDI-2 из-за второго лазера и второго процесса ионизации, подобного MALDI, был впоследствии принят для других масс-спектрометров, все из которых оснащены источниками, работающими в диапазоне низких мбар. [55] [56]
Приложения
Биохимия
В протеомике MALDI используется для быстрой идентификации белков, выделенных с помощью гель-электрофореза : SDS-PAGE , гель-хроматографии , аффинной хроматографии , сильного/слабого ионного обмена, изотопно-кодированной маркировки белков (ICPL) и двумерного гель-электрофореза . Пептидная масс-фингерпринтинг является наиболее популярным аналитическим применением масс-спектрометров MALDI-TOF. Масс-спектрометры MALDI TOF/TOF используются для выявления аминокислотной последовательности пептидов с использованием пост-источникового распада или диссоциации, вызванной столкновениями высокой энергии (дальнейшее применение см. в масс-спектрометрии ).
MALDI-TOF использовались для характеристики посттрансляционных модификаций . Например, он широко применялся для изучения метилирования и деметилирования белков . [57] [58] Однако следует соблюдать осторожность при изучении посттрансляционных модификаций с помощью MALDI-TOF. Например, сообщалось, что потеря сиаловой кислоты была выявлена в работах, когда дигидроксибензойная кислота (DHB) использовалась в качестве матрицы для анализа MALDI MS гликозилированных пептидов. Используя синапиновую кислоту, 4-HCCA и DHB в качестве матриц, S. Martin изучал потерю сиаловой кислоты в гликозилированных пептидах путем метастабильного распада в MALDI/TOF в линейном режиме и режиме рефлектора. [59] Группа в Shimadzu Corporation дериватизировала сиаловую кислоту с помощью реакции амидирования в качестве способа повышения чувствительности обнаружения [60] , а также продемонстрировала, что матрица ионной жидкости снижает потерю сиаловой кислоты во время анализа MALDI/TOF MS сиалилированных олигосахаридов. [61] THAP, [62] DHAP, [63] и смесь 2-аза-2-тиотимина и фенилгидразина [64] были идентифицированы как матрицы, которые можно использовать для минимизации потери сиаловой кислоты во время анализа MALDI MS гликозилированных пептидов. Сообщалось, что снижение потери некоторых посттрансляционных модификаций может быть достигнуто, если использовать IR MALDI вместо UV MALDI. [65]
Помимо белков, MALDI-TOF также применялся для изучения липидов . [66] Например, он применялся для изучения каталитических реакций фосфолипаз . [67] [68] Помимо липидов, MALDI-TOF также характеризовал олигонуклеотиды . Например, в молекулярной биологии смесь 5-метоксисалициловой кислоты и спермина может использоваться в качестве матрицы для анализа олигонуклеотидов в масс-спектрометрии MALDI, [69] например, после синтеза олигонуклеотидов .
Органическая химия
Некоторые синтетические макромолекулы, такие как катенаны и ротаксаны , дендримеры и гиперразветвленные полимеры, а также другие сборки, имеют молекулярные веса, простирающиеся до тысяч или десятков тысяч, где большинство методов ионизации испытывают трудности с получением молекулярных ионов. MALDI — это простой и быстрый аналитический метод, который может позволить химикам быстро анализировать результаты таких синтезов и проверять их результаты. [ необходима цитата ]
Полимеры
В химии полимеров MALDI может использоваться для определения распределения молярной массы . [70] Полимеры с полидисперсностью более 1,2 трудно охарактеризовать с помощью MALDI из-за дискриминации интенсивности сигнала по сравнению с олигомерами с большей массой. [71] [72] [73]
Хорошей матрицей для полимеров является дитранол [74] или AgTFA. [75] Образец необходимо сначала смешать с дитранолом, а затем добавить AgTFA; в противном случае образец выпадет в осадок из раствора.
Микробиология
Спектры MALDI-TOF часто используются для идентификации микроорганизмов, таких как бактерии или грибки. Часть колонии рассматриваемого микроба помещается на образец-мишень и накладывается на матрицу. Масс-спектры полученных экспрессированных белков анализируются специальным программным обеспечением и сравниваются с сохраненными профилями для определения видов в том, что известно как биотипирование. Это дает преимущества другим иммунологическим или биохимическим процедурам и стало распространенным методом идентификации видов в клинических микробиологических лабораториях. [76] [77] Преимущества MALDI-MS высокого разрешения, выполняемого на масс-спектрометрии циклотронного резонанса с преобразованием Фурье (также известной как FT-MS), были продемонстрированы для типирования и подтипирования вирусов с помощью обнаружения отдельных ионов, известного как протеотипирование, с особым акцентом на вирусы гриппа. [78]
Одним из главных преимуществ перед другими методами микробиологической идентификации является его способность быстро и надежно идентифицировать, при низких затратах, широкий спектр микроорганизмов непосредственно из селективной среды, используемой для их изоляции. Отсутствие необходимости очищать подозреваемую или «предполагаемую» колонию [79] позволяет значительно сократить время выполнения. Например, было продемонстрировано, что MALDI-TOF можно использовать для обнаружения бактерий непосредственно из культур крови. [80]
Другим преимуществом является возможность прогнозирования восприимчивости бактерий к антибиотикам. Один пик масс-спектра может предсказать устойчивость Staphylococcus aureus к метициллину . [81] MALDI также может обнаруживать карбапенемазу энтеробактерий , устойчивых к карбапенемам , [82] включая Acinetobacter baumannii [83] и Klebsiella pneumoniae . [84] Однако большинство белков, которые опосредуют устойчивость к антибиотикам, больше, чем диапазон MALDI-TOF 2000–20 000 Да для интерпретации пика белка, и только иногда, как во время вспышки карбапенемазы Klebsiella pneumoniae (KPC) в 2011 году в NIH, можно установить корреляцию между пиком и белком, определяющим устойчивость. [85]
Паразитология
Спектры MALDI-TOF использовались для обнаружения и идентификации различных паразитов, таких как трипаносоматиды , [86] лейшмании [87] и плазмодии . [88] Помимо этих одноклеточных паразитов, MALDI/TOF можно использовать для идентификации паразитических насекомых, таких как вши [89] или церкарии , свободноплавающая стадия трематод . [90]
Лекарство
Спектры MALDI-TOF часто используются в тандеме с другими методами анализа и спектроскопии при диагностике заболеваний. MALDI/TOF — это диагностический инструмент с большим потенциалом, поскольку он позволяет быстро идентифицировать белки и изменения в белках без затрат или вычислительной мощности секвенирования, а также без навыков или времени, необходимых для решения кристаллической структуры в рентгеновской кристаллографии . [ необходима цитата ]
Одним из примеров этого является некротический энтероколит (НЭК), который является разрушительным заболеванием, поражающим кишечник недоношенных детей. Симптомы НЭК очень похожи на симптомы сепсиса , и многие дети умирают, не дождавшись диагностики и лечения. MALDI/TOF использовался для идентификации бактерий, присутствующих в фекалиях младенцев с положительным результатом на НЭК. Это исследование было сосредоточено на характеристике фекальной микробиоты, связанной с НЭК, и не рассматривало механизм заболевания. Есть надежда, что аналогичный метод может быть использован в качестве быстрого диагностического инструмента, который не потребует секвенирования. [91]
Другой пример диагностической силы MALDI/TOF — область рака . Рак поджелудочной железы остается одним из самых смертоносных и труднодиагностируемых видов рака. [92] Долгое время предполагалось, что нарушение клеточной сигнализации из-за мутаций в мембранных белках способствует развитию рака поджелудочной железы. [93] MALDI/TOF использовался для идентификации мембранного белка , связанного с раком поджелудочной железы, и в какой-то момент может даже служить методом раннего обнаружения. [94] [ необходим неосновной источник ]
MALDI/TOF также может потенциально использоваться для определения лечения и диагностики. MALDI/TOF служит методом определения лекарственной устойчивости бактерий, особенно к β-лактамам (семейство пенициллина). MALDI/TOF обнаруживает наличие карбапенемаз, что указывает на лекарственную устойчивость к стандартным антибиотикам. Предполагается, что это может служить методом идентификации бактерии как лекарственно-устойчивой всего за три часа. Этот метод может помочь врачам решить, следует ли изначально назначать более агрессивные антибиотики. [95]
Обнаружение белковых комплексов
После первоначальных наблюдений, что некоторые комплексы пептид-пептид могут выдерживать осаждение и ионизацию MALDI, [96] были опубликованы исследования крупных белковых комплексов с использованием MALDI-MS. [97] [98]
Малые молекулы
Хотя MALDI является распространенной техникой для больших макромолекул, часто возможно также анализировать малые молекулы с массой менее 1000 Да. Проблема с малыми молекулами заключается в эффектах матрицы, где возможны помехи сигнала, насыщение детектора или подавление сигнала аналита, поскольку матрицы часто состоят из самих малых молекул. Выбор матрицы во многом зависит от того, какие молекулы должны быть проанализированы. [99] [100]
Масс-спектрометрия с визуализацией MALDI
Поскольку MALDI является источником мягкой ионизации, он используется для широкого спектра биомолекул. Это привело к его использованию в новых целях, таких как масс-спектрометрия с визуализацией MALDI. Эта техника позволяет визуализировать пространственное распределение биомолекул. [101]
Смотрите также
Ссылки
- ^ Hillenkamp, Franz; Karas, Michael; Beavis, Ronald C.; Chait, Brian T. (1991). "Матрично-ассистированная лазерная десорбция/ионизационная масс-спектрометрия биополимеров". Analytical Chemistry . 63 (24): 1193A – 1203A . doi :10.1021/ac00024a002. ISSN 0003-2700. PMID 1789447.
- ^ abcd Карас, Михаэль; Крюгер, Ральф (2003). «Формирование ионов в MALDI: механизм ионизации кластеров». Chemical Reviews . 103 (2): 427– 440. doi :10.1021/cr010376a. ISSN 0009-2665. PMID 12580637.
- ^ Карас, М.; Бахманн, Д.; Хилленкамп, Ф. (1985). «Влияние длины волны на высокоинтенсивную ультрафиолетовую лазерную десорбционную масс-спектрометрию органических молекул». Аналитическая химия . 57 (14): 2935– 9. doi :10.1021/ac00291a042.
- ^ Карас, М.; Бахманн, Д.; Бар, У.; Хилленкамп, Ф. (1987). «Десорбция нелетучих соединений с помощью ультрафиолетового лазера с использованием матрицы». Международный журнал масс-спектрометрии и ионных процессов . 78 : 53–68 . Bibcode : 1987IJMSI..78...53K. doi : 10.1016/0168-1176(87)87041-6.
- ^ Танака, К.; Ваки, Х.; Идо, Й.; Акита, С.; Йошида, Й.; Йошида, Т.; Мацуо, Т. (1988). «Анализ белков и полимеров до m / z 100 000 с помощью лазерной ионизации времяпролетной масс-спектрометрии». Rapid Communications in Mass Spectrometry . 2 (20): 151– 3. Bibcode : 1988RCMS....2..151T. doi : 10.1002/rcm.1290020802.
- ^ Маркидес, К.; Грэслунд, А. ( 9 октября 2002 г.). «Дополнительная информация о Нобелевской премии по химии 2002 г.» (PDF) . Королевская шведская академия наук . стр. 1–13 . Получено 28.08.2013 .
- ^ Карас, М.; Хилленкамп, Ф. (1988). «Лазерная десорбционная ионизация белков с молекулярными массами, превышающими 10 000 дальтон». Аналитическая химия . 60 (20): 2299– 301. doi :10.1021/ac00171a028. PMID 3239801.
- ^ abc Beavis, RC; Chait, BT; Standing, KG (1989). "Матрично-ассистированная лазерная десорбционная масс-спектрометрия с использованием излучения 355 нм". Rapid Communications in Mass Spectrometry . 3 (12): 436– 9. Bibcode : 1989RCMS....3..436B. doi : 10.1002/rcm.1290031208. PMID 2520224.
- ^ Карас, М.; Бахр, У. (1990). «Лазерная десорбционная ионизация масс-спектрометрии больших биомолекул». Тенденции в аналитической химии . 9 (10): 321– 5. doi :10.1016/0165-9936(90)85065-F.
- ^ Strupat, K.; Karas, M.; Hillenkamp, F. (1991). "2,5-Дигидроксибензойная кислота: новая матрица для лазерной десорбции — ионизационной масс-спектрометрии". Международный журнал масс-спектрометрии и ионных процессов . 111 : 89– 102. Bibcode :1991IJMSI.111...89S. doi :10.1016/0168-1176(91)85050-V.
- ^ ab Beavis, RC; Chait, BT; Fales, HM (1989). «Производные коричной кислоты как матрицы для масс-спектрометрии белков с десорбцией ультрафиолетовым лазером». Rapid Communications in Mass Spectrometry . 3 (12): 432– 5. Bibcode : 1989RCMS....3..432B. doi : 10.1002/rcm.1290031207. PMID 2520223.
- ^ Beavis, RC; Chaudhary, T.; Chait, BT (1992). "α-Циано-4-гидроксикоричная кислота как матрица для масс-спектрометрии с лазерной десорбцией с матрицей". Органическая масс-спектрометрия . 27 (2): 156– 8. doi :10.1002/oms.1210270217.
- ^ Tang, K.; Taranenko, NI; Allman, SL; Cháng, LY; Chen, CH; Lubman, DM (1994). «Обнаружение 500-нуклеотидной ДНК методом лазерной десорбционной масс-спектрометрии». Rapid Communications in Mass Spectrometry . 8 (9): 727– 30. Bibcode : 1994RCMS....8..727T. doi : 10.1002/rcm.1290080913. PMID 7949335.
- ^ Wu, KJ; Steding, A.; Becker, CH (1993). "Матрично-ассистированная лазерная десорбционная времяпролетная масс-спектрометрия олигонуклеотидов с использованием 3-гидроксипиколиновой кислоты в качестве чувствительной к ультрафиолету матрицы". Rapid Communications in Mass Spectrometry . 7 (2): 142– 6. Bibcode : 1993RCMS....7..142W. doi : 10.1002/rcm.1290070206. PMID 8457722.
- ^ Корфмахер, Вальтер А. (2009). Использование масс-спектрометрии для изучения метаболизма лекарств. CRC Press. стр. 342. ISBN 9781420092219.
- ^ Фицджеральд, MC; Парр, GR; Смит, LM (1993). "Базовые матрицы для матрично-ассистированной лазерной десорбционной/ионизационной масс-спектрометрии белков и олигонуклеотидов". Аналитическая химия . 65 (22): 3204– 11. doi :10.1021/ac00070a007. PMID 8291672.
- ^ Зеноби, Р.; Кнохенмусс, Р. (1998). «Формирование ионов в масс-спектрометрии МАЛДИ». Обзоры масс-спектрометрии . 17 (5): 337– 366. Bibcode :1998MSRv...17..337Z. doi :10.1002/(SICI)1098-2787(1998)17:5<337::AID-MAS2>3.0.CO;2-S.
- ^ Xu, Yingda; Bruening, Merlin L.; Watson, J. Throck (2003). «Неспецифические методы очистки на зонде для образцов MALDI-MS». Mass Spectrometry Reviews . 22 (6): 429– 440. Bibcode : 2003MSRv...22..429X. doi : 10.1002/mas.10064. ISSN 0277-7037. PMID 14528495.
- ^ Nazim Boutaghou, M.; Cole, RB (2012). «9,10-Дифенилантрацен как матрица для вторичных реакций переноса электронов MALDI-MS». J. Mass Spectrom . 47 (8): 995–1003 . Bibcode : 2012JMSp...47..995N. doi : 10.1002/jms.3027. PMID 22899508.
- ^ Suzuki, T.; Midonoya, H.; Shioi, Y. (2009). «Анализ хлорофиллов и их производных методом матрично-активированной лазерной десорбции/ионизации–времяпролетной масс-спектрометрии». Anal. Biochem . 390 (1): 57– 62. doi :10.1016/j.ab.2009.04.005. hdl : 10297/4147 . PMID 19364490. S2CID 2634483.
- ^ Wei, J.; Li, H.; Barrow, MP; O'Connor, PB (2013). «Структурная характеристика хлорофилла-a с помощью тандемной масс-спектрометрии высокого разрешения». J. Am. Soc. Mass Spectrom . 24 (5): 753– 760. Bibcode :2013JASMS..24..753W. doi :10.1007/s13361-013-0577-1. PMID 23504642. S2CID 43158125.
- ^ Шринивасан, Н.; Хейни, К.А.; Линдси, Дж.С.; Чжан, В.; Чайт, Б.Т. (1999). «Исследование масс-спектрометрии MALDI-TOF различных синтетических металлопорфиринов, фталоцианинов и мультипорфириновых массивов». Журнал порфиринов и фталоцианинов . 3 (4): 283– 291. doi :10.1002/(SICI)1099-1409(199904)3:4<283::AID-JPP132>3.0.CO;2-F.
- ^ «Говоря о революции: масс-спектрометрия с ИЦР-Фурье обеспечивает высокое разрешение и точность определения масс для Pr».
- ^ Schmitt-Kopplin, P; Hertkorn, N (2007). "Масс-спектрометрия сверхвысокого разрешения". Anal Bioanal Chem . 389 (5): 1309– 1310. doi :10.1007/s00216-007-1589-0. PMC 2129108 .
- ^ Гизелинк, Йонас; Ван Хорд, Коенраад; Хост, Барт; Хейлен, Ким; Де Вос, Пол (сентябрь 2011 г.). «Оценка MALDI-TOF MS как инструмента высокопроизводительной дерепликации». Журнал микробиологических методов . 86 (3): 327–336 . doi :10.1016/j.mimet.2011.06.004. ПМИД 21699925.
- ^ Драйзеверд, Клаус (2014). «Последние методологические достижения в масс-спектрометрии МАЛДИ». Аналитическая и биоаналитическая химия . 406 ( 9– 10): 2261– 2278. doi :10.1007/s00216-014-7646-6. ISSN 1618-2642. PMID 24652146. S2CID 5467069.
- ^ Мюррей, К (2006). "Глава 9 Десорбция фотонами: лазерная десорбция и ионизация лазерной десорбцией с помощью матрицы (MALDI) – инфракрасная ионизация лазерной десорбцией с помощью матрицы". В Гросс, Майкл Л.; Каприоли, Ричард М. (ред.). Энциклопедия масс-спектрометрии . Том 6: Методы ионизации. Elsevier Science. ISBN 9780080438016. Получено 2017-04-05 .
- ^ Сянь, Фэн; Хендриксон, Кристофер Л.; Маршалл, Алан Г. (17.01.2012). «Масс-спектрометрия высокого разрешения». Аналитическая химия . 84 (2): 708– 719. doi :10.1021/ac203191t. ISSN 0003-2700. PMID 22263633.
- ^ Ruotolo, BT; Gillig, KJ; Woods, AS; Egan, TF; Ugarov, MV; Schultz, JA; Russell, DH (2004). «Анализ фосфорилированных пептидов с помощью масс-спектрометрии ионной подвижности». Аналитическая химия . 76 (22): 6727– 6733. doi :10.1021/ac0498009. PMID 15538797.(требуется подписка)
- ^ Ruotolo, BT; Verbeck, GF; Thomson, LM; Woods, AS; Gillig, KJ; Russell, DH (2002). «Различение фосфорилированных и нефосфорилированных пептидов с помощью масс-спектрометрии ионной подвижности». Журнал исследований протеома . 1 (4): 303– 306. doi :10.1021/pr025516r. PMID 12645885.(требуется подписка)
- ^ Pasa-Tolic, L.; Huang, Y.; Guan, S.; Kim, HS; Marshall, AG (1995). "Масс-спектры пептидов с сверхвысоким разрешением и матрично-ассистированной лазерной десорбцией/ионизацией с преобразованием Фурье и ионным циклотронным резонансом". Журнал масс-спектрометрии . 30 (6): 825–833 . Bibcode : 1995JMSp...30..825P. doi : 10.1002/jms.1190300607.(требуется подписка)
- ^ Лайко, В.В.; Болдуин, МА; Берлингейм, АЛ (2000). «Масс-спектрометрия с лазерной десорбцией/ионизацией при атмосферном давлении с использованием матрицы». Аналитическая химия . 72 (4): 652–7 . doi :10.1021/ac990998k. PMID 10701247.
- ^ Strupat, K.; Scheibner, O.; Arrey, T.; Bromirski, M. (2011). "Biological Applications of AP MALDI with Thermo Scientific Exactive Orbitrap MS" (PDF) . 443-539-1710 . Thermo Scientific . Получено 17 июня 2011 г. .
- ^ Laiko, VV; Moyer, SC; Cotter, RJ (2000). "Масс-спектрометрия MALDI/ионной ловушки при атмосферном давлении". Аналитическая химия . 72 (21): 5239– 43. doi :10.1021/ac000530d. PMID 11080870.
- ^ Кениг, Симоне; Коллас, Оливер; Драйзеверд, Клаус (1 июля 2007 г.). «Генерация высокозаряженных пептидных и белковых ионов с помощью инфракрасной лазерной десорбции/ионизации с использованием матрицы при атмосферном давлении и масс-спектрометрии с ионной ловушкой». Аналитическая химия . 79 (14): 5484– 5488. doi : 10.1021/ac070628t . ISSN 0003-2700. PMID 17569505.
- ^ Trimpin, Sarah; Inutan, Ellen D.; Herath, Suchani N.; McEwen, Charles N. (1 января 2010 г.). «Метод масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией для селективного получения одно- или многозарядных молекулярных ионов». Аналитическая химия . 82 (1): 11– 15. doi :10.1021/ac902066s. ISSN 0003-2700. PMID 19904915.
- ^ Ли, Юн Цзе; Сан, Йеле; Чжан, Ци; Ли, Сюэ; Ли, Мэй; Чжоу, Чжэнь; Чан, Чак К. (июнь 2017 г.). «Химическая характеристика твердых частиц в атмосфере в Китае в режиме реального времени: обзор». Atmospheric Environment . 158 : 270–304 . Bibcode : 2017AtmEn.158..270L. doi : 10.1016/j.atmosenv.2017.02.027.
- ^ Knochenmuss, R (2006). "Механизмы образования ионов в УФ-МАЛДИ". Analyst . 131 (9): 966– 986. Bibcode :2006Ana...131..966K. doi :10.1039/b605646f. PMID 17047796.
- ^ ab Knochenmuss, Richard (2016). "Связанная химическая и физическая динамическая модель MALDI". Annual Review of Analytical Chemistry . 9 (1): 365– 385. Bibcode :2016ARAC....9..365K. doi : 10.1146/annurev-anchem-071015-041750 . ISSN 1936-1327. PMID 27070182.
- ^ Knochenmuss, Richard (2006). «Механизмы образования ионов в УФ-МАЛДИ». The Analyst . 131 (9): 966– 86. Bibcode : 2006Ana...131..966K. doi : 10.1039/b605646f. ISSN 0003-2654. PMID 17047796.
- ^ Карас, Михаэль; Глюкманн, Маттиас; Шефер, Юрген (2000). «Ионизация при матрично-ассистированной лазерной десорбции/ионизации: однозарядные молекулярные ионы — счастливчики, выжившие». Журнал масс-спектрометрии . 35 (1): 1– 12. Bibcode :2000JMSp...35....1K. doi :10.1002/(SICI)1096-9888(200001)35:1<1::AID-JMS904>3.0.CO;2-0. ISSN 1076-5174. PMID 10633229.
- ^ ab Макьюэн, Чарльз Н.; Ларсен, Барбара С. (2015). «Пятьдесят лет десорбционной ионизации нелетучих соединений». Международный журнал масс-спектрометрии . 377 : 515–531 . Bibcode : 2015IJMSp.377..515M. doi : 10.1016/j.ijms.2014.07.018. ISSN 1387-3806.
- ^ Лу, И.-Чунг; Ли, Чупинг; Ли, Юань-Цех; Ни, Чи-Кунг (2015). «Механизм ионизации матрично-активированной лазерной десорбции/ионизации». Annual Review of Analytical Chemistry . 8 : 21– 39. Bibcode :2015ARAC....8...21L. doi :10.1146/annurev-anchem-071114-040315. PMID 26132345.
- ^ Tsai, Ming-Tsang; Lee, Sheng; Lu, I-Chung; Chu, Kuan Yu; Liang, Chi-Wei; Lee, Chih Hao; Lee, Yuan T.; Ni, Chi-Kung (2013-05-15). "Ion-to-neutral ratio of 2,5-dihydroxybenzoic acid in matrix-assisted laser desorb/ionization". Rapid Communications in Mass Spectrometry . 27 (9): 955– 963. Bibcode :2013RCMS...27..955T. doi :10.1002/rcm.6534. ISSN 1097-0231. PMID 23592197.
- ^ Лу, И-Чунг; Ли, Чупин; Чэнь, Хуэй-Юань; Линь, Хоу-Ю; Хунг, Шэн-Вэй; Дьяков, Юрий А.; Сюй, Куотунг; Ляо, Чи-Ю; Ли, Инь-Ю (2014). «Интенсивность ионов и тепловой перенос протонов при ультрафиолетовой матрично-активированной лазерной десорбции/ионизации». Журнал физической химии B. 118 ( 15): 4132– 4139. doi :10.1021/jp5008076. ISSN 1520-6106. PMID 24707818.
- ^ Lu, I.-Chung; Chu, Kuan Yu; Lin, Chih-Yuan; Wu, Shang-Yun; Dyakov, Yuri A.; Chen, Jien-Lian; Gray-Weale, Angus; Lee, Yuan-Tseh; Ni, Chi-Kung (2015). «Соотношения ионов и нейтралов и тепловой перенос протонов при матрично-активированной лазерной десорбции/ионизации». Журнал Американского общества масс-спектрометрии . 26 (7): 1242– 1251. Bibcode : 2015JASMS..26.1242L. doi : 10.1007/s13361-015-1112-3. ISSN 1044-0305. PMID 25851654. S2CID 24085468.
- ^ Ли, Чупинг; Лу, И.-Чунг; Сюй, Сюй Чэнь; Линь, Хоу-Ю; Лян, Шэн-Пинг; Ли, Юань-Цех; Ни, Чи-Кунг (2016). «Формирование ионов, связанных с металлами, при ионизации с помощью матричного лазера». Журнал Американского общества масс-спектрометрии . 27 (9): 1491– 1498. Bibcode : 2016JASMS..27.1491L. doi : 10.1007/s13361-016-1424-y. ISSN 1044-0305. PMID 27306427. S2CID 2139197.
- ^ Тримпин, Сара (2015). ""Волшебная" ионизационная масс-спектрометрия". Журнал Американского общества масс-спектрометрии . 27 (1): 4– 21. Bibcode : 2016JASMS..27....4T. doi : 10.1007/s13361-015-1253-4. ISSN 1044-0305. PMC 4686549. PMID 26486514 .
- ^ Trimpin, S; Inutan, ED (2013). «Матричная ионизация в вакууме, чувствительный и широко применяемый метод ионизации для масс-спектрометрии». J. Am. Soc. Mass Spectrom . 24 (5): 722– 732. Bibcode :2013JASMS..24..722T. doi :10.1007/s13361-012-0571-z. PMID 23526166. S2CID 29978978.
- ^ Лу, И-Чунг; Чу, Куан Юй; Линь, Чи-Юань; У, Шан-Юнь; Дьяков, Юрий А.; Чэнь, Цзянь-Лянь; Грей-Уиле, Ангус; Ли, Юань-Цех; Ни, Чи-Кунг (июль 2015 г.). «Соотношения ионов и нейтрали и тепловой перенос протонов при матрично-активированной лазерной десорбции/ионизации». Журнал Американского общества масс-спектрометрии . 26 (7): 1242– 1251. Bibcode : 2015JASMS..26.1242L. doi : 10.1007/s13361-015-1112-3. ISSN 1044-0305. PMID 25851654. S2CID 24085468.
- ^ Робинсон, Кеннет Н.; Стивен, Рори Т.; Рейс, Алан М.; Банч, Жозефина (июль 2019 г.). «Влияние параметров визуализации МС на десорбцию УФ-МАЛДИ и выход ионов». Журнал Американского общества масс-спектрометрии . 30 (7): 1284– 1293. Bibcode : 2019JASMS..30.1284R. doi : 10.1007/s13361-019-02193-8. ISSN 1044-0305. PMID 30949969. S2CID 96435099.
- ^ Шпенглер, Б.; Бар, У.; Карас, М.; Хилленкамп, Ф. (январь 1988 г.). «Позиционирование десорбированных лазером органических и неорганических соединений в масс-спектрометре времени пролета». Instrumentation Science & Technology . 17 ( 1– 2): 173– 193. Bibcode : 1988IS&T...17..173S. doi : 10.1080/10739148808543672. ISSN 1073-9149.
- ^ Dreisewerd, Klaus (февраль 2003 г.). «Процесс десорбции в MALDI». Chemical Reviews . 103 (2): 395– 426. doi :10.1021/cr010375i. ISSN 0009-2665. PMID 12580636.
- ^ Soltwisch, J.; Kettling, H.; Vens-Cappell, S.; Wiegelmann, M.; Muthing, J.; Dreisewerd, K. (2015-04-10). "Масс-спектрометрическая визуализация с лазерно-индуцированной постионизацией". Science . 348 (6231): 211– 215. Bibcode :2015Sci...348..211S. doi : 10.1126/science.aaa1051 . ISSN 0036-8075. PMID 25745064. S2CID 206632790.
- ^ Солтвиш, Йенс; Хейс, Брам; Кох, Анника; Венс-Каппелл, Симеон; Хёндорф, Йенс; Драйзеверд, Клаус (2020-07-07). "MALDI-2 на квадрупольном приборе с подвижностью захваченных ионов и временем пролета для быстрой масс-спектрометрической визуализации и разделения подвижности ионов сложных профилей липидов". Аналитическая химия . 92 (13): 8697– 8703. doi : 10.1021/acs.analchem.0c01747. hdl : 1887/3182290 . ISSN 0003-2700. PMID 32449347. S2CID 218874538.
- ^ Эллис, SR; Солтвиш, J.; Пейн, MRL; Драйзеверд, K.; Херен, RMA (2017). «Лазерная постионизация в сочетании с масс-спектрометром орбитальной ловушки высокой разрешающей способности для улучшенной визуализации липидов методом MALDI-MS». Chemical Communications . 53 (53): 7246– 7249. doi :10.1039/C7CC02325A. ISSN 1359-7345. PMID 28573274.
- ^ Стейси Л. Ричардсон; Паул Ханджра; Ганг Чжан; Брианна Д. Маки; Даррелл Л. Петерсон; Ронг Хуан (2015). «Прямой, ратиометрический и количественный анализ MALDI–MS для метилтрансфераз и ацетилтрансфераз белков». Anal. Biochem . 478 : 59–64 . doi :10.1016/j.ab.2015.03.007. PMC 4855292. PMID 25778392 .
- ^ Карин Гито; Тьерри Дрюжон; Фабьен Бурлина; Сандрин Саган; Сандра Бопьер; Оливье Памлар; Роберт Х. Додд; Катрин Гийу; Жерар Больбах; Эммануэль Сашон; Доминик Гвианварк (2017). «Прямой безметочный MALDI-TOF масс-спектрометрический анализ на основе анализа для характеристики ингибиторов протеин-лизин-метилтрансфераз». Аналитическая и биоаналитическая химия . 409 (15): 3767– 3777. doi :10.1007/s00216-017-0319-5. PMID 28389916. S2CID 4021309.
- ^ Huberty, MC; Vath, JE; Yu, W.; Martin, SA (1993). «Сайт-специфическая идентификация углеводов в рекомбинантных белках с использованием MALD-TOF MS». Аналитическая химия . 65 (20): 2791– 2800. doi :10.1021/ac00068a015. PMID 8250262.
- ^ Секия, С.; Вада, И.; Танака, К. (2005). «Дериватизация для стабилизации сиаловых кислот в МАЛДИ-МС». Аналитическая химия . 77 (15): 4962– 4968. doi :10.1021/ac050287o. PMID 16053310.
- ^ Фукуяма, Y.; Накая, S.; Ямазаки, Y.; Танака, K. (2008). «Матрицы ионной жидкости, оптимизированные для MALDI-MS сульфатированных/сиалилированных/нейтральных олигосахаридов и гликопептидов». Аналитическая химия . 80 (6): 2171– 2179. doi :10.1021/ac7021986. PMID 18275166.
- ^ Papac, DI; Wong, A.; Jones, AJS (1996). «Анализ кислых олигосахаридов и гликопептидов методом времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией». Аналитическая химия . 68 (18): 3215– 3223. doi :10.1021/ac960324z. PMID 8797382.
- ^ Харви, DJ (1999). "Матрично-ассистированная лазерная десорбция/ионизационная масс-спектрометрия углеводов". Mass Spectrometry Reviews . 18 (6): 349– 451. Bibcode :1999MSRv...18..349H. CiteSeerX 10.1.1.1012.1931 . doi :10.1002/(SICI)1098-2787(1999)18:6<349::AID-MAS1>3.0.CO;2-H. PMID 10639030.
- ^ Латтова, Э.; Чен, В.С.; Варма, С.; Безабех, Т.; Перро, Х. (2007). «Метод матрично-активированной лазерной десорбции/ионизации на мишени для исследования олигосахаридов и участков гликозилирования в гликопептидах и гликопротеинах». Rapid Communications in Mass Spectrometry . 21 (10): 1644– 1650. Bibcode : 2007RCMS...21.1644L. doi : 10.1002/rcm.3007. PMID 17465012.
- ^ Таджири, М.; Такеучи, Т.; Вада, Й. (2009). «Отличительные особенности матрично-ассистированной 6 мкм инфракрасной лазерной десорбционной/ионизационной масс-спектрометрии в биомолекулярном анализе». Аналитическая химия . 81 (16): 6750– 6755. doi :10.1021/ac900695q. PMID 19627133.
- ^ TW Jaskolla; K. Onischke; J. Schiller (2014). "Соли 2,5-дигидроксибензойной кислоты для времяпролетного масс-спектрометрического анализа липидов с помощью матрично-активированной лазерной десорбции/ионизации: упрощенная интерпретация спектров и понимание газофазной фрагментации". Rapid Communications in Mass Spectrometry . 28 (12): 1353– 1363. Bibcode : 2014RCMS...28.1353J. doi : 10.1002/rcm.6910. PMID 24797946.
- ^ J. Lee; Y.-K. Kim; D.-H. Min (2010). «Лазерная десорбция/ионизация масс-спектрометрического анализа активности фосфолипазы на основе двухслойных пленок оксида графена/углеродной нанотрубки». Журнал Американского химического общества . 132 (42): 14714– 14717. doi :10.1021/ja106276j. PMID 20886850.
- ^ Nabangshu Sharma; Ries J. Langley; Chatchakorn Eurtivong; Euphemia Leung; Ryan Joseph Dixon; Emily K. Paulin; Shaun WP Rees; Lisa I Pilkington; David Barker; Johannes Reynisson; Ivanhoe KH Leung (2021). "Оптимизированный анализ MALDI-TOF для фосфатидилхолин-специфической фосфолипазы C". Аналитические методы . 13 (4): 491– 496. doi :10.1039/D0AY02208J. PMID 33432952. S2CID 231584395.
- ^ Дистлер, AM; Эллисон, Дж. (2001). «5-Метоксисалициловая кислота и спермин: новая матрица для анализа олигонуклеотидов методом масс-спектрометрии с лазерной десорбцией/ионизацией с использованием матрицы». Журнал Американского общества масс-спектрометрии . 12 (4): 456– 62. Bibcode : 2001JASMS..12..456D. doi : 10.1016/S1044-0305(01)00212-4. PMID 11322192. S2CID 18280663.
- ^ Шрепп, В.; Паш, Х. (2003). MALDI-TOF Масс-спектрометрия синтетических полимеров . Спрингер-Верлаг . ISBN 978-3-540-44259-2.
- ^ Нилен, М. В. Ф.; Малуча, С. (1997). «Характеристика полидисперсных синтетических полимеров с помощью эксклюзионной хроматографии/матричной лазерной десорбции/ионизационной времяпролетной масс-спектрометрии». Rapid Communications in Mass Spectrometry . 11 (11): 1194– 1204. Bibcode :1997RCMS...11.1194N. doi :10.1002/(SICI)1097-0231(199707)11:11<1194::AID-RCM935>3.0.CO;2-L.
- ^ Wu, KJ; Odom, RW (1998). «Характеристика синтетических полимеров с помощью MALDI MS». Аналитическая химия . 70 (13): 456A – 461A . doi :10.1021/ac981910q. PMID 9666717.
- ^ Schriemer, DC; Li, L. (1997). «Массовая дискриминация при анализе полидисперсных полимеров с помощью времяпролетной масс-спектрометрии MALDI. 2. Инструментальные вопросы». Аналитическая химия . 69 (20): 4176– 4183. doi :10.1021/ac9707794.
- ^ Шайбергер, Одри М.; Мосс, Джейсон А. (2008). «Оптимизированная подготовка образцов для масс-спектрометрического анализа защищенных синтетических пептидов с помощью МАЛДИ». Журнал Американского общества масс-спектрометрии . 19 (4): 614– 619. Bibcode :2008JASMS..19..614S. doi : 10.1016/j.jasms.2008.01.010 . ISSN 1044-0305. PMID 18295503. S2CID 5305444.
- ^ Бар, Уте; Деппе, Андреас; Карас, Михаэль; Хилленкамп, Франц; Гиссманн, Ульрих (1992). «Масс-спектрометрия синтетических полимеров с помощью УФ-матрично-лазерной десорбции/ионизации». Аналитическая химия . 64 (22): 2866– 2869. doi :10.1021/ac00046a036. ISSN 0003-2700.
- ^ Seng, P.; Drancourt, M.; Gouriet, F.; La Scola, B.; Fournier, PE; Rolain, JM; Raoult, D. (2009). «Продолжающаяся революция в бактериологии: рутинная идентификация бактерий с помощью времяпролетной масс-спектрометрии с лазерной десорбцией и ионизацией с использованием матрицы». Клинические инфекционные заболевания . 49 (4): 552– 3. doi : 10.1086/600885 . PMID 19583519.
- ^ Сандрин, Тодд Р.; Голдштейн, Джейсон Э.; Шумейкер, Стефани (2013). «MALDI TOF MS профилирование бактерий на уровне штамма: обзор». Mass Spectrometry Reviews . 32 (3): 188– 217. Bibcode : 2013MSRv...32..188S. doi : 10.1002/mas.21359. ISSN 0277-7037. PMID 22996584.
- ^ Даунард, Кевин М. (2013). «Протеотипирование для быстрой идентификации вируса гриппа и других биопатогенов». Chemical Society Reviews . 42 (22): 8584– 8595. doi :10.1039/c3cs60081e. ISSN 1460-4744. PMID 23632861.
- ^ Capocefalo M., Ridley EV, Tranfield EY и Thompson KC (2015). "Гл. 9 - MALDI-TOF: метод быстрого микробиологического подтверждения для анализа пищевых продуктов и воды". В Cook N.; D'Agostino M.; Thompson KC (ред.). Молекулярные микробные методы диагностики - пути внедрения для пищевой и водной промышленности . Elsevier. ISBN 978-0-12-416999-9.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Seon Young Kim; Jeong Su Park; Yun Ji Hong; Taek Soo Kim; Kiho Hong; Kyoung-Ho Song; Hyunju Lee; Eu Suk Kim; Hong Bin Kim; Kyoung Un Park; Junghan Song; Sun Hoe Koo; Eui-Chong Kim (2019). «Анализ нуклеиновых кислот на основе микрочипов и анализ MALDI-TOF MS для обнаружения грамотрицательных бактерий в прямых культурах крови». Американский журнал клинической патологии . 151 (2): 143– 153. doi : 10.1093/AJCP/AQY118 . PMID 30383194.
- ^ Rhoads, DD (2016). «Наличие одного пика масс-спектра MALDI-TOF предсказывает устойчивость стафилококков к метициллину. et al.». Diagn Microbiol Infect Dis . 86 (3): 257– 261. doi :10.1016/j.diagmicrobio.2016.08.001. PMID 27568365.
- ^ Vogne, C.; et al. (2014). ""Простой, надежный и быстрый подход к обнаружению карбапенемаз в грамотрицательных изолятах с помощью масс-спектрометрии MALDI-TOF" валидация с тройной квадрипольной тандемной масс-спектрометрией, микрочипом и ПЦР". Clin Microbiol Infect . 20 (12): O1106-12. doi : 10.1111/1469-0691.12715 . PMID 24930405.
- ^ Абусеада, Н; Рауф, М; Эль-Аттар, Э; Моез, П (2017). «Матричная лазерная десорбционная ионизация времяпролетная масс-спектрометрия быстрое обнаружение активности карбапенамаз в изолятах Acinetobacter baumannii». Indian J Med Microbiol . 35 (1): 85–89 . doi : 10.4103/0255-0857.202335 . PMID 28303824. S2CID 20480725.
- ^ Sakarikou, C; Ciotti, M; Dolfa, C; Angeletti, S; Favalli, C (2017). "Быстрое обнаружение штаммов Klebsiella pneumoniae, продуцирующих карбапенемазу, полученных из культур крови с помощью матрично-активированной лазерной десорбционной ионизации и времяпролетной масс-спектрометрии (MALDI-TOF MS)". BMC Microbiol . 17 (1): 54. doi : 10.1186/s12866-017-0952-3 . PMC 5343375. PMID 28274205 .
- ^ Lau, A.; et al. (август 2014 г.). «Быстрая матрично-ассистированная лазерная десорбционная ионизация–времяпролетная масс-спектрометрия для отслеживания отдельных плазмид во время вспышки карбапенем-резистентных энтеробактерий». Журнал клинической микробиологии . 52 (8): 2804–2812 . doi : 10.1128/JCM.00694-14 . PMC 4136129. PMID 4136129. S2CID 43633405.
- ^ Avila, CC; Almeida, FG; Palmisano, G. (2016). «Прямая идентификация трипаносоматид с помощью матрично-активированной лазерной десорбционной ионизации-времяпролетной масс-спектрометрии (DIT MALDI-TOF MS)». Журнал масс-спектрометрии . 51 (8): 549– 557. Bibcode : 2016JMSp...51..549A. doi : 10.1002/jms.3763. ISSN 1076-5174. PMID 27659938.
- ^ Лашо, Лоуренс; Фернандес-Аревало, Анна; Норманд, Анн-Сесиль; Лами, Патрик; Набет, Сесиль; Доннадье, Жан Люк; Пиарру, Мартина; Дженад, Фарид; Кассань, Кэрол; Равель, Кристоф; Тебар, Сильвия; Лловет, Тереза; Бланше, Дени; Демар, Магали; Харрат, Зубир; Аун, Карим; Бастьен, Патрик; Муньос, Кармен; Гальего, Монтсеррат; Пиарру, Рено; Леффельхольц, Майкл Дж. (2017). «Идентификация Leishmania с помощью масс-спектрометрии с матричной лазерной десорбцией и ионизацией и временем пролета (MALDI-TOF) с использованием бесплатного веб-приложения и специальной масс-спектральной библиотеки». Журнал клинической микробиологии . 55 (10): 2924– 2933. doi :10.1128/JCM.00845-17. ISSN 0095-1137. PMC 5625378. PMID 28724559 .
- ^ Laroche, Maureen; Almeras, Lionel; Pecchi, Emilie; Bechah, Yassina; Raoult, Didier; Viola, Angèle; Parola, Philippe (2017). "MALDI-TOF MS как инновационный инструмент для обнаружения паразитов Plasmodium у комаров Anopheles". Malaria Journal . 16 (1): 5. doi : 10.1186/s12936-016-1657-z . ISSN 1475-2875. PMC 5209920. PMID 28049524 .
- ^ Уарти, Басма; Ларош, Морин; Риги, Суад; Мегуини, Мохамед Надир; Бенахла, Ахмед; Рауль, Дидье; Парола, Филипп (2020). «Разработка масс-спектрометрии MALDI-TOF для идентификации вшей, выделенных от сельскохозяйственных животных». Parasite . 27 : 28. doi :10.1051/parasite/2020026. ISSN 1776-1042. PMC 7191974 . PMID 32351208.

- ^ Угенен, Антуан; Депакит, Жером; Виллена, Изабель; Ферте, Юбер (2019). «Масс-спектрометрия MALDI-TOF: новый инструмент для быстрой идентификации церкарий (Trematoda, Digenea)». Паразит . 26:11 . doi :10.1051/parasite/2019011. ISSN 1776-1042. ПМК 6402365 . ПМИД 30838972.

- ^ Сим, К.; Шоу, АГ; Рэнделл, П.; Кокс, М.Дж.; МакКлур, З.Е.; Ли, М.С.; Хаддад, М.; Лэнгфорд, П.Р.; Куксон, У.О.; Моффатт, М.Ф.; Кролл, Дж.С. Дисбактериоз, предупреждающий некротизирующий энтероколит у глубоко недоношенных детей. Клиническая инфекционная дис. 2014.
- ^ Грантцдорффер, И; Карл-МакГрат, С; Эберт, МП; Рокен, К (2008). «Протеомика рака поджелудочной железы». Поджелудочная железа . 36 (4): 329–36 . doi :10.1097/MPA.0b013e31815cc452. PMID 18437077. S2CID 29118712.
- ^ Dhillon, AS; Hagan, S; Rath, O; Kolch, W (2007). «Пути сигнализации MAP-киназы при раке». Oncogene . 26 (22): 3279– 90. doi : 10.1038/sj.onc.1210421 . PMID 17496922. S2CID 17464318.
- ^ Чжун, Н.; Цуй, И.; Чжоу, С.; Ли, Т.; Хан, Дж. Идентификация прохибитина 1 как потенциального прогностического биомаркера при карциноме поджелудочной железы человека с использованием модифицированной водной двухфазной системы разделения в сочетании с 2D-MALDI-TOF-TOF-MS/MS. Tumour Biol. 2014.
- ^ Храбак, Ярослав (2015). «Обнаружение карбапенемаз с использованием времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией (MALDI-TOF MS) для анализа гидролиза меропенема». Методы в молекулярной биологии (1064-3745), 1237, стр. 91.
- ^ Вудс, А.С.; Буксбаум, Дж.С.; Уорралл, ТА; Берг, Дж.М.; Коттер, Р.Дж. (1995). «Матричная лазерная десорбция/ионизация нековалентно связанных соединений». Anal. Chem . 67 (24): 4462– 4465. doi :10.1021/ac00120a005.
- ^ Киселар, Дж. Дж. Г.; Даунард, К. М. (2000). «Сохранение и обнаружение специфических комплексов антитело-пептид с помощью масс-спектрометрии с лазерной десорбцией/ионизацией с использованием матрицы». J. Am. Soc. Mass Spectrom . 11 (8): 746– 750. Bibcode : 2000JASMS..11..746K. doi : 10.1016/S1044-0305(00)00144-6. PMID 10937798. S2CID 33248551.
- ^ Даунард, К. М. (2006). «Мягко, мягко — обнаружение белковых комплексов с помощью масс-спектрометрии с лазерной десорбцией и ионизацией с помощью матрицы». Масс-спектрометрия белковых взаимодействий . Wiley. стр. 25–43 . doi :10.1002/9780470146330.ch2. ISBN 9780470146330.
- ^ Бергман, Нина; Шевченко, Денис; Бергквист, Йонас (январь 2014 г.). «Подходы к анализу низкомолекулярных соединений с использованием методов лазерной десорбции/ионизации и масс-спектрометрии». Аналитическая и биоаналитическая химия . 406 (1): 49– 61. doi :10.1007/s00216-013-7471-3. ISSN 1618-2642. PMID 24322735.
- ^ Кальвано, Козима Дамиана; Монополи, Антонио; Катальди, Томмазо RI; Палмисано, Франческо (июль 2018 г.). «Матрицы МАЛДИ для соединений с низкой молекулярной массой: бесконечная история?». Аналитическая и биоаналитическая химия . 410 (17): 4015– 4038. doi :10.1007/s00216-018-1014-x. hdl : 11586/226062 . ISSN 1618-2642. PMID 29682685.
- ^ Zaima, Nobuhiro; Hayasaka, Takahiro; Goto-Inoue, Naoko; Setou, Mitsutoshi (2010-12-07). "Матрично-ассистированная лазерная десорбция/ионизация масс-спектрометрия". International Journal of Molecular Sciences . 11 (12): 5040–5055 . doi : 10.3390/ijms11125040 . ISSN 1422-0067. PMC 3100838. PMID 21614190 .
Библиография
- Рагуссис, Дж.; Элвидж, Г.П.; Каур, К.; Колелла, С. (2006). «Матрично-активированная лазерная десорбция/ионизация, времяпролетная масс-спектрометрия в геномных исследованиях». PLOS Genetics . 2 (7): e100. doi : 10.1371/journal.pgen.0020100 . PMC 1523240 . PMID 16895448.
- Хардуэн, Дж. (2007). «Информация о последовательности белка с помощью матрично-ассистированной лазерной десорбции/ионизации в масс-спектрометрии с распадом источника». Обзоры масс-спектрометрии . 26 (5): 672– 82. Bibcode : 2007MSRv...26..672H. doi : 10.1002/mas.20142. PMID 17492750.
- Peter-Katalinic, J.; Hillenkamp, F. (2007). MALDI MS: Практическое руководство по приборам, методам и приложениям . Wiley-VCH . ISBN 978-3-527-31440-9.
- Шрепп, В.; Паш, Х. (2003). MALDI-TOF Масс-спектрометрия синтетических полимеров . Спрингер-Верлаг . ISBN 978-3-540-44259-2.
Внешние ссылки
- Учебник по матрично-активированной лазерной десорбционной ионизации (MALDI) Национальная лаборатория сильных магнитных полей
