Нитрат свинца(II)
_nitrate_1.jpg/440px-Lead(II)_nitrate_1.jpg) | |||
| |||
| Идентификаторы | |||
|---|---|---|---|
3D модель ( JSmol ) |
| ||
| ChemSpider |
| ||
| Информационная карта ECHA | 100.030.210 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ |
| ||
| Номер ООН | 1469 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| Pb( NO3 ) 2 | |||
| Молярная масса | 331,2 г/моль | ||
| Появление | бесцветный или белый | ||
| Плотность | 4,53 г/см 3 | ||
| Температура плавления | 470 °C (878 °F; 743 K) [2] разлагается | ||
| 376,5 г/л (0 °C) 597 г/л (25 °C) 1270 г/л (100 °C) | |||
| −74·10 −6 см 3 /моль [1] | |||
Показатель преломления ( nD ) | 1.782 [2] | ||
| Термохимия | |||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −451,9 кДж·моль −1 [1] | ||
| Опасности | |||
| Маркировка СГС : [4] | |||
    | |||
| Опасность | |||
| Х302 , Х317 , Х318 , Х332 , Х360 , Х373 , Х410 | |||
| Р201 , Р202 , Р210 , Р220 , Р221 , Р260 , Р261 , Р264 , Р270 , Р271 , Р272 , Р273 , Р280 , Р281 , Р301+Р312 , Р302+Р352 , Р304+Р312 , Р304+Р340 , Р305+Р351+Р338 , Р308+Р313 , Р310 , Р312 , Р314 , Р321 , Р330 , Р333+Р313 , Р363 , Р370+Р378 , Р391 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD Lo ( самый низкий опубликованный ) | 500 мг/кг (морская свинка, перорально) [3] | ||
| Паспорт безопасности (SDS) | МКХС 1000 | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Нитрат свинца(II) — неорганическое соединение с химической формулой Pb ( NO3 ) 2 . Обычно встречается в виде бесцветных кристаллов или белого порошка и, в отличие от большинства других солей свинца(II) , растворим в воде .
Известное со времен Средневековья под названием plumbum dulce , производство нитрата свинца(II) из металлического свинца или оксида свинца в азотной кислоте было мелкомасштабным, для непосредственного использования в производстве других соединений свинца . В девятнадцатом веке нитрат свинца(II) начал производиться в коммерческих целях в Европе и Соединенных Штатах. Исторически, основным применением было использование в качестве сырья при производстве пигментов для свинцовых красок , но такие краски были вытеснены менее токсичными красками на основе диоксида титана . Другие промышленные применения включали термическую стабилизацию в нейлоне и полиэфирах , а также в покрытиях фототермографической бумаги. Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота .
Нитрат свинца(II) токсичен и требует осторожного обращения, чтобы избежать вдыхания, проглатывания и контакта с кожей. Из-за его опасной природы ограниченные области применения нитрата свинца(II) находятся под постоянным контролем.
История
Нитрат свинца был впервые обнаружен в 1597 году алхимиком Андреасом Либавиусом , который назвал это вещество plumbum dulce , что означает «сладкий свинец», из-за его вкуса. [5] Он производится в коммерческих целях путем реакции металлического свинца с концентрированной азотной кислотой , в которой он плохо растворяется. [6] [7] Он производился в качестве сырья для изготовления пигментов, таких как хромовый желтый (хромат свинца (II), PbCrO 4 ) и хромовый оранжевый (основной хромат свинца (II), Pb 2 CrO 5 ) и неаполитанский желтый . Эти пигменты использовались для окрашивания и печати на ситце и других текстильных изделиях. [8] Он использовался в качестве окислителя в черном порохе и вместе с азидом свинца в специальных взрывчатых веществах . [9]
Производство
Нитрат свинца получают путем реакции оксида свинца(II) с концентрированной азотной кислотой: [10]
- PbO + 2 HNO 3 (концентрированный) → Pb(NO 3 ) 2 ↓ + H 2 O
Его также можно получить выпариванием раствора, полученного при взаимодействии металлического свинца с разбавленной азотной кислотой . [11]
- Pb + 4 HNO 3 → Pb(NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Растворы и кристаллы нитрата свинца(II) образуются при переработке свинцово- висмутовых отходов свинцовых заводов. [12]
Структура
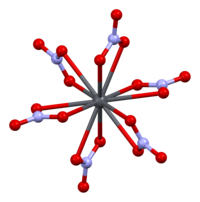
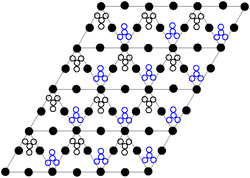
Кристаллическая структура твердого нитрата свинца(II) была определена методом нейтронной дифракции . [13] [14] Соединение кристаллизуется в кубической системе с атомами свинца в гранецентрированной кубической системе. Его пространственная группа Pa3 Z=4 ( обозначение решетки Браве ), с каждой стороной куба длиной 784 пикометра .
Черные точки представляют атомы свинца, белые точки — нитратные группы на 27 пикометров выше плоскости атомов свинца, а синие точки — нитратные группы на том же расстоянии ниже этой плоскости. В этой конфигурации каждый атом свинца связан с двенадцатью атомами кислорода ( длина связи : 281 пм). Все длины связей N–O идентичны и составляют 127 пикометров. [15]
Исследовательский интерес к кристаллической структуре нитрата свинца (II) частично основывался на возможности свободного внутреннего вращения нитратных групп в кристаллической решетке при повышенных температурах, однако это не было реализовано. [14]
Химические свойства и реакции
Нитрат свинца разлагается при нагревании, это свойство используется в пиротехнике . [9] Он растворяется в воде и разбавленной азотной кислоте.
Основные нитраты образуются при добавлении щелочи к раствору. Pb 2 (OH) 2 (NO 3 ) 2 является преобладающим видом, образующимся при низком pH. При более высоком pH образуется Pb 6 (OH) 5 (NO 3 ). [17] Катион [Pb 6 O(OH) 6 ] 4+ необычен тем, что имеет оксидный ион внутри кластера из 3 тетраэдров PbO 4 с общими гранями . [18] Нет никаких доказательств образования гидроксида Pb(OH) 2 в водном растворе при pH ниже 12.
Растворы нитрата свинца можно использовать для образования координационных комплексов. Свинец(II) является жестким акцептором ; он образует более прочные комплексы с лигандами, отдающими электроны азоту и кислороду . Например, объединение нитрата свинца и пентаэтиленгликоля (ЭО 5 ) в растворе ацетонитрила и метанола с последующим медленным испарением дало соединение [Pb(NO 3 ) 2 (ЭО 5 )]. [19] В кристаллической структуре этого соединения цепь ЭО 5 обернута вокруг иона свинца в экваториальной плоскости , подобной плоскости краун -эфира . Два бидентатных нитратных лиганда находятся в транс-конфигурации . Общее координационное число равно 10, при этом ион свинца находится в молекулярной геометрии двушапочной квадратной антипризмы .
Комплекс, образованный нитратом свинца с бидентатным N-донорным лигандом битиазола, является биядерным. Кристаллическая структура показывает, что нитратная группа образует мостик между двумя атомами свинца. [20] Одним из интересных аспектов этого типа комплексов является наличие физического зазора в координационной сфере ; т. е. лиганды не размещены симметрично вокруг иона металла. Это потенциально связано с неподеленной парой электронов свинца, также обнаруженной в комплексах свинца с имидазольным лигандом. [21]
Приложения
Нитрат свинца использовался в качестве термостабилизатора в нейлоне и полиэстерах, в качестве покрытия для фототермографической бумаги и в родентицидах . [10]
Нагревание нитрата свинца является удобным способом получения диоксида азота.
В процессе цианирования золота добавление раствора нитрата свинца (II) улучшает процесс выщелачивания . Требуются только ограниченные количества (от 10 до 100 миллиграммов нитрата свинца на килограмм золота). [22] [23]
В органической химии его можно использовать при получении изотиоцианатов из дитиокарбаматов . [24] Сообщалось о его использовании в качестве поглотителя бромида во время замещения S N 1. [25]
Безопасность
Нитрат свинца (II) токсичен, и его прием внутрь может привести к острому отравлению свинцом, как и для всех растворимых соединений свинца. [26] Все неорганические соединения свинца классифицируются Международным агентством по изучению рака (МАИР) как вероятно канцерогенные для человека (категория 2А). [27] Они были связаны с раком почки и глиомой у подопытных животных, а также с раком почки, раком мозга и раком легких у людей, хотя исследования рабочих, подвергавшихся воздействию свинца, часто осложняются сопутствующим воздействием мышьяка . [28] Известно, что свинец заменяет цинк в ряде ферментов , включая дегидратазу δ-аминолевулиновой кислоты (порфобилиногенсинтазу) в пути биосинтеза гема и пиримидин-5′-нуклеотидазу , важную для правильного метаболизма ДНК и, следовательно, может вызывать повреждение плода. [29]
Ссылки
- ^ ab CRC handbook ofchemistry and physics: a ready-reference book of chemical and physical data. Уильям М. Хейнс, Дэвид Р. Лид, Томас Дж. Бруно (2016-2017, 97-е изд.). Бока-Ратон, Флорида. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: местоположение отсутствует издатель ( ссылка ) CS1 maint: другие ( ссылка ) - ^ ab Patnaik, Pradyot (2003). Справочник по неорганическим химикатам. Нью-Йорк: McGraw-Hill. стр. 475. ISBN 0-07-049439-8. OCLC 50252041.
- ^ "Соединения свинца (как Pb)". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ "Нитрат свинца". pubchem.ncbi.nlm.nih.gov . Получено 19 декабря 2021 г. .
- ^ Либавиус, Андреас (1595). Алхимия Андреа Либавия . Франкофурти: Иоанн Сауриус.
- ^ Чисхолм, Хью , ред. (1911). . Encyclopaedia Britannica . Том 16 (11-е изд.). Cambridge University Press. С. 314–320.
- ^ Макгрегор, Джон (1847). Прогресс Америки к 1846 году . Лондон: Whittaker & Co. ISBN 0-665-51791-2.
- ^ Партингтон, Джеймс Риддик (1950). Учебник неорганической химии . MacMillan. стр. 838.
- ^ ab Barkley, JB (октябрь 1978 г.). «Нитрат свинца как окислитель в черном порохе». Pyrotechnica . 4. Post Falls, Idaho : Pyrotechnica Publications: 16–18.
- ^ ab Гринвуд, Норман Н.; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Butterworth-Heinemann. стр. 388, 456. ISBN 0-7506-3365-4.
- ^ Отмер, ДФ (1967). Энциклопедия химической технологии Кирка-Отмера . Т. 12 (От железа до марганца) (второе полностью переработанное издание). Нью-Йорк: John Wiley & Sons . С. 272. ISBN 0-471-02040-0.
- ^ "Каталог продукции; другие продукты". Тилли, Бельгия: Sidech. Архивировано из оригинала 2007-07-01 . Получено 2008-01-05 .
- ^ Гамильтон, WC (1957). «Нейтронное кристаллографическое исследование нитрата свинца». Acta Crystallogr. 10 (2): 103–107. doi :10.1107/S0365110X57000304.
- ^ ab Новотны, Х.; Г. Хегер (1986). «Уточнение структуры нитрата свинца». Acta Crystallographica Section C. 42 ( 2): 133–35. doi :10.1107/S0108270186097032.
- ^ Новотны, Х.; Хегер, Г. (15 февраля 1986 г.). «Cấu trúc của chì nitrat». Acta Crystallographica Section C . 42 (2): 133–135. doi :10.1107/S0108270186097032 . Получено 15 июля 2019 г. .
- ^ Феррис, Л. М. (1959). «Система нитрат свинца — азотная кислота — вода». Журнал химических и инженерных данных . 5 (3): 242. doi :10.1021/je60007a002.
- ^ Pauley, JL; MK Testerman (1954). «Основные соли нитрата свинца, образующиеся в водных средах». Журнал Американского химического общества . 76 (16): 4220–4222. doi :10.1021/ja01645a062.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.стр. 395
- ^ Роджерс, Робин Д.; Эндрю Х. Бонд; Дебра М. Роден (1996). «Структурная химия полиэтиленгликоля». Комплексы нитрата свинца (II) и бромида свинца (II)». Неорган. химия 35 (24): 6964–6973. doi :10.1021/ic960587b. PMID 11666874.
- ^ Махджуб, Али Реза; Али Морсали (2001). «Димерный комплекс смешанных анионов свинца(II): синтез и структурная характеристика [Pb2 ( BTZ) 4 (NO3 ) (H2O ) ](ClO4 ) 3 { BTZ = 4,4'-Bithiazole}». Chemistry Letters . 30 (12): 1234. doi :10.1246/cl.2001.1234.
- ^ Шуан-И Вань; Цзянь Фань; Така-аки Окамура; Хуэй-Фан Чжу; Син-Мэй Оуян; Вэй-Инь Сан и Нориказу Уэяма (2002). «2D 4.8 2 Сеть с тройным параллельным взаимопроникновением из нанометрового триподального лиганда и нитрата свинца(II)». Chem. Commun. (21): 2520–2521. doi :10.1039/b207568g.
- ^ Хабаши, Фатхи (1998). «Последние достижения в металлургии золота». Revisa de la Facultad de Ingeniera, Центральный университет Венесуэлы . 13 (2): 43–54.
- ^ "Вспомогательные агенты при цианировании золота". Gold Prospecting and Gold Mining . Получено 2008-01-05 .
- ^ Dains, FB; Brewster, RQ; Olander, CP "Фенилизотиоцианат". Органические синтезы; Собрание томов , т. 1, стр. 447.
- ^ Рапопорт, Х.; Джеймисон, Т. (1998). "(S)-N-(9-фенилфлуорен-9-ил)аланин и (S)-диметил-N-(9-фенилфлуорен-9-ил)аспартат". Органические синтезы; Собрание томов , т. 9, стр. 344.
- ^ "Нитрат свинца, Карточка химической безопасности 1000". Международная организация труда , Международный информационный центр по охране труда. Март 1999 г. Получено 19 января 2008 г.
- ^ "Неорганические и органические соединения свинца" (PDF) . Монографии МАИР по оценке канцерогенных рисков для человека . Приложение 7. Международное агентство по изучению рака : 239. 1987. Архивировано из оригинала (PDF) 2008-03-06 . Получено 2008-01-19 .
- ^ Всемирная организация здравоохранения, Международное агентство по изучению рака (2006). "Неорганические и органические соединения свинца" (PDF) . Монографии МАИР по оценке канцерогенных рисков для человека . 87 . Международное агентство по изучению рака . ISBN 92-832-1287-8. Архивировано из оригинала (PDF) 2007-10-21 . Получено 2008-01-01 .
- ^ Mohammed-Brahim, B.; Buchet, JP; Lauwerys, R. (1985). «Активность пиримидин-5'-нуклеотидазы эритроцитов у рабочих, подвергшихся воздействию свинца, ртути или кадмия». Int Arch Occup Environ Health . 55 (3): 247–52. doi :10.1007/BF00383757. PMID 2987134. S2CID 40092031.
Внешние ссылки
- Вудбери, Уильям Д. (1982). «Свинец». Mineral Yearbook Metals and Minerals . Бюро горной промышленности : 515–42 . Получено 18.01.2008 .
- "Свинец". Карманный справочник NIOSH по химическим опасностям . Национальный институт охраны труда. Сентябрь 2005 г. NIOSH 2005-149 . Получено 19.01.2008 .
- "Информационный листок о свинце и его соединениях". Национальный реестр загрязняющих веществ . Правительство Австралии, Департамент окружающей среды и водных ресурсов. Июль 2007 г. Архивировано из оригинала 11 января 2008 г. Получено 19 января 2008 г.
- "Свинец". Здоровая домашняя среда, Опасности для здоровья . Альянс США за здоровые дома. Архивировано из оригинала 20-02-2008 . Получено 19-01-2008 .
- Паспорта безопасности материалов
- MSDS для нитрата свинца, PTCL, Оксфордский университет
- Паспорт безопасности для нитрата свинца, Science Stuff Inc.
- Паспорт безопасности нитрата свинца, Университет штата Айова



![{\displaystyle {\ce {2 Pb(NO_3)_2->[\Delta]2PbO + 4NO_2 +O_2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06f64696eaa883432008d7e6af4c5af9b60a6b85)
