|
Японский огненнобрюхий тритон
| Японский огненнобрюхий тритон Временной диапазон: Средний миоцен – настоящее время | |
|---|---|
 | |
| Самка японского огненнобрюхого тритона | |
| Научная классификация | |
| Домен: | Эукариоты |
| Королевство: | Анималия |
| Тип: | Хордовые |
| Сорт: | Амфибии |
| Заказ: | Urodela |
| Семья: | Саламандровые |
| Род: | Цинопс |
| Разновидность: | C. пиррогастер |
| Биномиальное имя | |
| Цинопс пиррогастер ( Бойе , 1826) | |
 | |
| Синонимы [2] | |
Молге пиррогастер ( Бойе , 1826) | |
Японский огненнобрюхий тритон или японская огненнобрюхая саламандра ( Cynops pyrrhogaster ) — вид тритонов , эндемичный для Японии. Кожа на верхней части тела темная, а на нижней — ярко-красная, хотя окраска меняется в зависимости от возраста, генетики и региона. Длина взрослых особей составляет от 8 до 15 см (от 3,1 до 5,9 дюйма). Для отпугивания хищников японские огненнобрюхие тритоны содержат высокие уровни тетродотоксина — нейротоксина , накапливающегося в основном из их рациона.
Вид встречается на многих японских островах , включая Хонсю , Сикоку и Кюсю . Их среда обитания включает как естественные, так и искусственные водоемы, а также леса и луга. Они размножаются с весны до начала лета, оба пола производят феромоны , когда готовы к спариванию. Яйца откладываются отдельно, и вылупляются примерно через три недели. Они вырастают из личинки в молодь за пять-шесть месяцев. Молодь питается добычей, обитающей в почве, а взрослые особи едят самых разных насекомых, головастиков и икру своего собственного вида. У них есть несколько адаптаций , чтобы избегать хищников, хотя то, что они используют, зависит от того, где они живут. Были изучены несколько аспектов их биологии , включая их способность восстанавливать отсутствующие части тела .
Японский огненнобрюхий тритон впервые отделился от своего ближайшего родственника в среднем миоцене , прежде чем разделиться на четыре отдельных разновидности, каждая из которых имеет в основном отдельный ареал, хотя все четыре официально признаны составляющими один вид. В настоящее время их популяция сокращается, и они сталкиваются с угрозами со стороны болезней и торговли домашними животными . Их можно успешно содержать в неволе.
Этимология и таксономия
Вид был впервые научно описан немецким зоологом Генрихом Бойе в 1826 году как Molge pyrrhogaster [примечание 1] на основе образцов, привезенных из Японии в Европу. Он сравнил его с гладким тритоном , заявив, что принял бы первого за второго, если бы не знал, что он из Японии. Ни один из изученных им образцов не был полностью зрелым. [ 3] [4] Pyrrhogaster происходит от греческого purrhos ( дословно « огонь » ) и gastēr ( дословно « живот » ). [5] Salamandra subcristata была описана Конрадом Якобом Темминком и Германом Шлегелем в 1838 году и позже в том же году перенесена в Cynops швейцарским натуралистом Иоганном Якобом фон Чуди , [6] [2] а в 1850 году Cynops subcristata и Molge pyrrhogaster были объединены в синонимы как Cynops pyrrhogaster британским зоологом Джоном Эдвардом Греем . [7] [2] Исследование митохондриальной ДНК в 2001 году показало, что ее предполагаемые собратья по роду Cynops , C. cyanurus и C. wolterstorffi , могут принадлежать к другому роду. [8]
Интегрированная таксономическая информационная система перечисляет шестнадцать синонимов для Cynops pyrrhogaster . [9] Распространенные названия вида включают японского огненнобрюхого тритона, [1] краснобрюхого тритона, [10] и японскую огненнобрюхую саламандру. [11] Исследования, изучающие морфологические и географические изменения, ранее признавали шесть рас : Тохоку, Канто, Ацуми, промежуточную, Сасаяма и Хиросима, [12] одна из которых, Сасаяма, была описана как подвид в 1969 году Робертом Мертенсом как Triturus pyrrhogaster sasayamae , который теперь считается синонимом C. pyrrhogaster . [2] Современный молекулярный анализ поддерживает разделение C. pyrrhogaster на четыре клады вместо этого. [12] В частности, обоснованность рас Сасаяма и промежуточных рас никогда не была доказана, при этом одно исследование не обнаружило поведенческих различий между двумя предполагаемыми формами. [13]
_(20226567219).jpg/440px-Brehms_Tierleben._Allgemeine_kunde_des_Tierreichs_(1911)_(20226567219).jpg)
Cynops pyrrhogaster отделился от своего близкого родственника C. ensicauda около 13,75 миллионов лет назад ( Mya ; в среднем миоцене ). Общий предок двух видов жил в районе материковой части Евразии , который сегодня является Восточно-Китайским морем и центральными островами Рюкю . Земля, которая стала Японскими островами — соединенная с материком в то время — вероятно, имела субтропический климат , что могло заставить предков японского огненнобрюхого тритона мигрировать на север в поисках желаемой среды обитания. Со временем C. pyrrhogaster разделился на четыре клады: северную, южную, западную и центральную. Сначала разошлась северная, около 9,68 млн лет назад, затем центральная около 8,23 млн лет назад и, наконец, южная и западная около 4,05 млн лет назад. Ареалы всех клад, кроме южной, сократились во время последнего ледникового периода , но затем снова расширились. Исследование, которое их идентифицировало, пришло к выводу, что четыре клады представляют собой отдельные таксономические единицы, хотя их точное соотношение неясно. Также были отмечены их экстремальные генетические различия, необычно большие для любого вида. [12] Ареалы центральных и западных разновидностей встречаются в Чугоку на западе Японии, образуя гибридную зону (область, где две клады скрещиваются, производя гибриды). Центральный тип начал перемещаться на запад, что привело к смещению гибридной зоны. Ожидается, что в конечном итоге это приведет к разбавлению генома западной формы за счет увеличения гибридизации . [14]
Описание

На верхней части тела тритона кожа темно-коричневая, приближающаяся к черной, и покрыта бородавчатыми бугорками. Низ живота и нижняя часть хвоста ярко-красные, с черными пятнами. [4] Молодые особи имеют кремовую окраску вместо красной, хотя у большинства более крупных особей присутствует некоторая краснота. [15] Взрослые особи с небольших островов, как правило, имеют больше красного цвета на брюшной (брюшной) области, чем с крупных островов, иногда с очень маленькими пятнами или вообще без них. В целом самцы, как правило, имеют больше красного цвета, чем самки. [16] Самцов также можно отличить от самок по их плоским, широким хвостам и припухлости вокруг брюшной области. [17] Существует полностью красный вариант: считается, что эта окраска наследуется и рецессивна . Этот вариант не ограничивается какой-либо одной популяцией, но более распространен в западной половине Японии в целом. [18]
Вомеронебные зубы, группа зубов в верхней задней части рта, расположены в два ряда. Язык относительно небольшой, в половину ширины рта. Ноздри расположены спереди (по направлению к голове), ближе друг к другу, чем к глазам, и едва видны при взгляде сверху. Пальцы ног у самцов длиннее, чем у самок, хотя сами самки длиннее. Хвост плотно сжат, с плавниками как сверху, так и снизу. Гладкий гребень проходит от затылка до хвоста. [19] Полная длина тела взрослых особей составляет от 8 до 15 см (от 3,1 до 5,9 дюйма). [11] Длина от рыла до анального отверстия может быть от 43,0 до 64,0 мм (от 1,69 до 2,52 дюйма) у самцов и от 48,5 до 75,0 мм (от 1,91 до 2,95 дюйма) у самок. Популяции из более северных и возвышенных регионов, как правило, крупнее, чем из южных и более низких регионов. [20] Длина яиц составляет от 2,1 до 2,3 мм (от 0,083 до 0,091 дюйма). [17]
Распространение и среда обитания
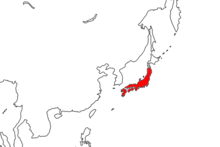
Cynops pyrrhogaster является эндемиком Японии, встречается на нескольких островах архипелага , включая Хонсю , Сикоку и Кюсю . [1] В основном он обитает на крупных островах, тогда как его родственник, C. ensicauda , встречается на островах Рюкю. Он имеет самый северный ареал среди всех видов Cynops ; все остальные виды, кроме вышеупомянутого C. ensicauda , являются аборигенами южного Китая. [12] Также есть интродуцированная популяция на Хатидзё-дзиме , которая, как полагают, произошла от особей с Сикоку. Считается, что их интродукция произошла в 1970-х годах, хотя точно неизвестно, как это произошло. [21] Он был зарегистрирован в Соединенных Штатах трижды, во Флориде и Массачусетсе. Каждый случай был либо побегом, либо преднамеренным выпуском, и ни одна популяция не была установлена. [11]
Из четырех кладов северный находится в округах Тохоку и Канто . Он не пересекается с ареалом центрального клада, который находится в Тюбу , северном Кансае и восточном Тюгоку. Ареал центрального имеет небольшое перекрытие с западным, который находится в южном Кинки, западном Тюгоку, Сикоку и центральном Кюсю. Западный также имеет некоторое перекрытие с южным кладом, который находится в западном и южном Кюсю. [12]
Тритоны встречаются на высоте от 30 до 2020 м (от 98 до 6627 футов). Экосистемы, в которых они встречаются, включают леса, луга, кустарники, водно-болотные угодья, озера, болота и возделываемые среды. Они также могут обитать в искусственных водоемах, таких как пруды аквакультуры . [1]
Поведение и экология
_(3149749632).jpg/440px-Japanese_Fire-Bellied_Newt_(Cynops_pyrrhogaster)_(3149749632).jpg)
Размножение и жизненный цикл
Размножение происходит на рисовых полях, прудах, ручьях, бассейнах и ручьях. Самки принимают ухаживания самцов с весны до начала лета. [20] Самцы и самки производят пептидные феромоны для привлечения противоположного пола, когда они готовы к спариванию. Самцы производят тип, известный как содефрин (от японского термина sodefuri , буквально « выпрашивание » ); [22] у самок есть своя собственная разновидность, названная их первооткрывателями иморин (от японского термина imo , буквально « любимая женщина » и rin от sodefrin ). Они выделяются из клоаки и были первым пептидным феромоном, который был идентифицирован у позвоночного и первым, который был идентифицирован у самки позвоночного, соответственно. [10] [23]
Ухаживание начинается, когда самец приближается к самке, обнюхивая ее бока или клоаку. Затем самец подносит свой хвост к самке и быстро вибрирует им. Самка отвечает, толкая шею самца своей мордой. В этот момент самец медленно отходит, волнообразно двигая хвостом, а самка следует за ним, касаясь хвоста своей мордой, когда оказывается достаточно близко. Затем самец откладывает от двух до четырех сперматофоров , по одному за раз, перемещаясь на несколько сантиметров после каждого, которые самка пытается подобрать своей клоакой, иногда безуспешно. [24] Самки откладывают яйца по отдельности на подводные объекты, такие как листья и затопленные корни травы, оплодотворяя их по одному из сперматофоров, которые они несут. Они могут отложить до 40 яиц за один сеанс и от 100 до 400 яиц за сезон размножения. [24]

Молодь вылупляется из яиц примерно через три недели в виде плавающих личинок с жабрами и спинными хвостовыми плавниками. Они вырастают примерно на 3 см (1,2 дюйма) в течение первых трех месяцев своей жизни. В возрасте от пяти до шести месяцев они перестают есть и претерпевают метаморфоз , теряя жабры и плавники и становясь мальками. Молодь не может оставаться погруженной в воду, как личинки, или тонет. [25] [26] Тритоны на более низких высотах созревают быстрее, чем те, что на более высоких. Самцы тритонов из популяций, живущих на больших высотах, как правило, живут дольше после достижения зрелости, но их полностью выращенный размер не такой большой, как у равнинных тритонов. Были найдены дикие особи в возрасте двадцати трех лет. [20]
Сперматогенез
Cynops pyrrhogaster считается идеальной моделью позвоночных для исследования механизмов, участвующих в переходе от митоза к мейозу во время сперматогенеза . [27] У самцов этот переход включает экспрессию PCNA , вспомогательного белка ДНК-полимеразы дельта, используемого в репликации ДНК и репарации ДНК . [27] В переходе также участвует DMC1 , белок, используемый в генетической рекомбинации . [27]
Диета
Известно, что в неволе головастики охотно поедают личинок комаров , артемий и дождевых червей . [25] Молодь часто потребляет виды Collembola (ногохвостов) и Acari (клещей), обитающие в почве . [15] Было обнаружено, что взрослые особи на одном конкретном субальпийском болоте в горах Адзума префектуры Фукусима любят как живую добычу, так и падаль . Они потребляют множество видов насекомых, таких как представители Odonata , в том числе стрекозы и равнокрылые стрекозы, чьи личинки были найдены целиком в желудках тритонов, но только части взрослых особей; Brachycera , подотряд Diptera (мухи); Hymenoptera , в который входят пилильщики, осы, пчелы и муравьи; и Coleoptera (жуки). Они также едят головастиков Rhacophorus arboreus и яйца своих собственных видов. Состав их рациона меняется в зависимости от сезона и года, что предполагает изменения в мелких животных в прудах, в которых они обитают, и вокруг них. [17] Аналогичные результаты были обнаружены в пруду на территории кампуса Токийского столичного университета в Хатиодзи , Токио, желудки тритонов содержали насекомых из многих разных отрядов , и снова, яйца конспецификов. Как и прежде, были съедены головастики лягушек, хотя они принадлежали к виду Rhacophorus schlegelii . [28]
Хищники
.jpg/440px-Cynops_pyrrhogaster_(under_s4).jpg)
Тритоны на материковой части Японии ведут себя иначе, чем тритоны на меньших островах. Особи на меньших островах (например, на острове Фукуэ ) обычно используют маневр, называемый рефлексом ункэн , когда они выставляют нападающим свой ярко-красный подбрюшник . Поскольку их основными хищниками являются птицы, которые способны различать красный цвет, этот метод эффективен. На материковой части Японии тритоны также должны избегать млекопитающих хищников, которые не могут различать цвета, а также охотников- птиц . Это приводит к тому, что эти популяции реже используют этот маневр, так как попытка его применения может привести к смерти. [16]
В случае со змеями тритоны с острова Фукуэ, как правило, демонстрируют демонстрацию виляния хвостом, призванную привлечь внимание хищника к их сменному хвосту, а не к более важной голове; тритоны из префектуры Нагасаки в материковой Японии, как правило, просто убегают. Змеи присутствуют в обеих областях. Эта разница в поведении, вероятно, объясняется тем, что тритоны с материка приспособлены к бегству от охотников-млекопитающих, которых такая демонстрация вряд ли отпугнет. [29]
Токсин
Дикие японские огненнобрюхие тритоны содержат высокие уровни нейротоксина тетродотоксина ( TTX). [30] Этот токсин подавляет активность натриевых каналов у большинства позвоночных, препятствуя нападению как птиц, так и млекопитающих. [29] Эксперименты показали, что токсин почти полностью выводится из рациона тритона. При выращивании в неволе без источника TTX 36-70-недельные детеныши не содержали определяемых уровней, но дикие особи из той же исходной среды обитания имели высокую токсичность. У более молодых тритонов, выращенных в неволе, все еще обнаруживалось некоторое количество TTX, которое, как предполагалось, было передано взрослыми самками в их яйца. [30] В последующем эксперименте той же группы выращенным в неволе тритонам давали пищу, содержащую нейротоксин. Они охотно съедали мотыля с добавлением TTX, когда им его предлагали, не проявляя никаких симптомов после приема яда. Впоследствии его можно было обнаружить в их телах, что еще раз указывает на то, что источником токсина была пища. В их среде обитания не известны организмы, продуцирующие ТТХ, но их существование вероятно и могло бы объяснить происхождение ТТХ у диких тритонов. [31]
Сохранение
.JPG/440px-Cynops_pyrrhogaster_(flocks).JPG)
Международный союз охраны природы (МСОП) оценил его как близкий к уязвимому положению . Эта оценка была сделана в 2020 году, [1] что является изменением по сравнению с 2004 годом, когда ему была присвоена оценка «наименьшая опасность» . [32] Он успешно размножается в австралийских зоопарках. [1] Одной из основных угроз, с которой сталкивается C. pyrrhogaster, является сбор для торговли домашними животными . МСОП заявляет, что эту торговлю необходимо немедленно прекратить. Их популяция сокращается, особенно вблизи мест проживания людей. [1]
Японские огненнобрюхие тритоны с загадочными поражениями кожи в озере Бива в префектуре Сига в Японии, как выяснилось, страдают от инфекций, вызванных одноклеточным эукариотом из отряда Dermocystida . Поражения содержали цисты , которые были заполнены спорами . Почти все поражения были внешними, хотя одно было обнаружено на печени . Во всем мире болезни являются одной из причин сокращения популяций амфибий. Существует опасение, что это заболевание может распространиться на другие близлежащие виды, включая Zhangixalus arboreus и Hynobius vandenburghi . [33]
Разновидность, которая, как считалось, встречается исключительно на полуострове Ацуми , считалась вымершей в 1960-х годах. Затем, в 2016 году, трио исследователей обнаружило, что тритоны на полуострове Чита, скорее всего, являются тем же вариантом из-за их схожих морфологических черт. Обе группы разделяют предпочтение более низкой температуре и имеют гладкие и мягкие тела, бледные спинные области и желтоватые нижние стороны. Даже если эта форма все еще жива, она находится под большой угрозой и скоро будет уничтожена без немедленной защиты. [34]
Взаимодействие с людьми
Исследовать
Японские огненнобрюхие тритоны служат весьма полезным модельным организмом в лабораторных условиях, но после метаморфоза за ними становится сложнее ухаживать. Эксперимент, поддержанный Японским обществом содействия науке, показал, что тиомочевина (TU) может предотвратить этот процесс, позволяя животным оставаться в своей преметаморфозной форме в течение двух лет, при этом оставаясь способными к метаморфозе после извлечения из раствора TU. Это не оказало никакого влияния на их способность к регенерации. [25]
Японские огненнобрюхие тритоны вырабатывают мотилин , пептид, стимулирующий желудочно-кишечные сокращения , обнаруженный у многих позвоночных. Он вырабатывается в верхней части тонкого кишечника и поджелудочной железе . Открытие последнего было первым случаем наблюдения мотилина поджелудочной железы. Орган также вырабатывает инсулин . Эти результаты представляют собой первое открытие мотилина у амфибий, что позволяет предположить, что он играет для них ту же роль, что и для птиц и млекопитающих. Существование мотилина поджелудочной железы также указывает на другую, неизвестную функцию. [35]
Этот вид, как и другие амфибии Urodele , способен восстанавливать утраченные части тела , включая конечности с функциональными суставами и нижнюю челюсть . [36] [37] Когда происходит этот процесс, регенерированная ткань имеет тенденцию отражать по форме неповрежденную ткань. [36] Он также способен восстанавливать утраченные линзы , занимая на это тридцать дней у личинки и восемьдесят дней у взрослой особи. Разница во времени обусловлена исключительно размером глаза, а регенеративная способность не меняется; открытие этого факта противоречило популярному утверждению, что молодые животные быстрее восстанавливаются, чем взрослые. [38]
В плену
Cynops pyrrhogaster можно содержать в неволе. Доктор ветеринарной медицины Лианн Маклеод описала их как «неприхотливых», отметив, что невольные тритоны любят мотыля, артемию, стеклянную креветку , дафнию , а для более крупных особей — гуппи . [39]
Примечания
- ↑ Иногда некоторые авторы, включая самого Бойе, ошибочно пишут его как Molga pyrrhogaster . [2]
Ссылки
- ^ abcdefg Группа специалистов по амфибиям IUCN SSC (2021). "Cynops pyrrhogaster". Красный список исчезающих видов IUCN . 2021 : e.T59444A177224976. doi : 10.2305/IUCN.UK.2021-1.RLTS.T59444A177224976.en . Получено 12 ноября 2021 г.
- ^ abcde Frost, Darrel R. (2023). "Cynops pyrrhogaster (Boie, 1826)". Amphibian Species of the World: An Online Reference . doi :10.5531/db.vz.0001. Архивировано из оригинала 2 мая 2021 г. Получено 8 января 2023 г.
- ↑ Окен, Лоренц (1826). «Изида фон Окена». Expedition der Isis (на немецком языке): 203–204 . Архивировано из оригинала 10 января 2023 года . Получено 8 января 2023 года .
- ^ аб Бойе, Генрих (1827). Kenteekenen van eenige Japansche Amphibiën (на голландском языке). Джо. Ф. Снеллеман. стр. 30–31 . doi : 10.5962/bhl.title.46817 . OCLC 727216017. Архивировано из оригинала 28 октября 2022 года . Проверено 28 октября 2022 г.
- ^ Джоблинг, Джеймс А. (2010). Словарь научных названий птиц Helm [электронный ресурс]: от aalge до zusii. Кристофер Хелм. стр. 326. ISBN 978-1-4081-3326-2. Получено 13 ноября 2022 г. .
- ^ Чуди, Иоганн Якоб фон; Агассис, Луи (1838). Классификация Batrachier: mit Berucksichtigung der ископаемых Thiere dieser Abtheilung der Reptilien / von JJ Tschudi (на немецком языке). Университет Невшателя . п. 94. дои : 10.5962/bhl.title.4883 . OCLC 964903266. Архивировано из оригинала 28 октября 2022 года . Проверено 28 октября 2022 г.
- ^ Грей, Джон Эдвард (1850). Каталог образцов амфибий в коллекции Британского музея. Часть II. Batrachia gradientia и т. д. Напечатано по распоряжению попечителей. стр. 25. doi : 10.5962/bhl.title.64048 . OCLC 3183646. Архивировано из оригинала 28 октября 2022 г. Получено 28 октября 2022 г.
- ^ Чан, Лорен М.; Замудио, Келли Р.; Уэйк, Дэвид Б. (декабрь 2001 г.). «Взаимоотношения родов саламандр Paramesotriton, Pachytriton и Cynops на основе последовательностей митохондриальной ДНК». Copeia . 2001 (4): 997– 1009. doi :10.1643/0045-8511(2001)001[0997:ROTSGP]2.0.CO;2. ISSN 0045-8511. S2CID 46994906. Архивировано из оригинала 28 октября 2022 г. . Получено 28 октября 2022 г. .
- ^ "Cynops pyrrhogaster". itis.gov . Архивировано из оригинала 30 октября 2022 г. Получено 30 октября 2022 г.
- ^ аб Накада, Томоаки; Тойода, Фумиё; Мацуда, Кохей; Накакура, Такаши; Хасунума, Итару; Ямамото, Кадзутоши; Оноуэ, Сатоми; Ёкосука, Макото; Кикуяма, Сакаэ (25 января 2017 г.). «Иморин: феромон сексуальной привлекательности самок краснобрюхих тритонов (Cynopspyrrogaster)». Научные отчеты . 7 (1): 41334. Бибкод : 2017NatSR...741334N. дои : 10.1038/srep41334. ISSN 2045-2322. ПМК 5264602 . ПМИД 28120945.
- ^ abc "Cynops pyrrhogaster". usgs.gov . Архивировано из оригинала 28 октября 2022 г. Получено 27 октября 2022 г.
- ^ abcdef Томинага, Ацуши; Мацуи, Масафуми; Ёсикава, Нацухико; Нисикава, Канто; Хаяси, Терутакэ; Мисава, Ясучика; Танабэ, Синго; Ота, Хидетоши (март 2013 г.). «Филогения и историческая демография Cynops pyrrhogaster (Amphibia: Urodela): таксономические связи и изменения в распределении, связанные с климатическими колебаниями». Молекулярная филогенетика и эволюция . 66 (3): 654– 667. doi :10.1016/j.ympev.2012.10.015. PMID 23103571. Получено 28 октября 2022 г.
- ^ Tagami, Masataka; Horie, Chikako; Kawai, Toshimasa; Sakabe, Ai; Shimada, Tomohiko (2015). «The Mating behavior of Cynops pyrrhogaster from Gifu and Aichi Prefectures, Central Japan, in captivity» ( Текущая герпетология ) . 34 (1): 12– 18. doi :10.5358/hsj.34.12. S2CID 86006031. Архивировано из оригинала 30 октября 2022 г. Получено 30 октября 2022 г.
- ^ Томинага, Ацуши; Мацуи, Масафуми; Ёсикава, Нацухико; Это, Коширо; Нисикава, Канто (16 марта 2018 г.). «Геномное смещение и сдвиг гибридной зоны у японского огненнобрюхого тритона». Journal of Heredity . 109 (3): 232– 242. doi : 10.1093/jhered/esx085 . PMID 29566204. Архивировано из оригинала 29 октября 2022 г. Получено 29 октября 2022 г.
- ^ аб Мацуи, Куми; Мочида, Кодзи; Накамура, Масахиса (июль 2003 г.). «Пищевые привычки молоди японского тритона Cynopspyrrogaster». Зоологическая наука . 20 (7): 855–859 . doi : 10.2108/zsj.20.855 . PMID 12867714. S2CID 40530531.
- ^ ab Mochida, Koji (23 июня 2009 г.). «Параллельная географическая мозаика морфологических и поведенческих апосематических признаков тритона Cynops pyrrhogaster (Urodela: Salamandridae): параллельная вариация апосематических признаков». Biological Journal of the Linnean Society . 97 (3): 613– 622. doi : 10.1111/j.1095-8312.2008.01182.x .
- ^ abc Ихара, Садао (февраль 2014 г.). «Пищевые привычки взрослого японского тритона». Современная герпетология . 33 (1): 38–45 . doi :10.5358/hsj.33.38. ISSN 1345-5834. S2CID 83534797. Архивировано из оригинала 30 октября 2022 года . Проверено 30 октября 2022 г.
- ^ Мацуи, Куми; Маруноучи, Джунсукэ; Накамура, Масахиса (2003). «Красные варианты японского тритона Cynops pyrrhogaster (Amphibia: Salamandridae): обзор записей и наблюдений в неволе по наследственности окраски». Current Herpetology . 22 (1): 37– 42. doi : 10.5358/hsj.22.37 . S2CID 89239218. Архивировано из оригинала 30 октября 2018 г. Получено 30 октября 2022 г.
- ^ Stejneger, Leonhard (1907). "Herpetology of Japan and neighbor Territory". Bulletin of the United States National Museum (58): 16. doi : 10.5479/si.03629236.58.i . Архивировано из оригинала 30 октября 2022 г. . Получено 30 октября 2022 г. .
- ^ abc Ochi, Osamu; Marunouchi, Junsuke; Ueda, Hiroaki (1 января 2000 г.). «Изменение возраста и размера среди размножающихся популяций на разных высотах у японских тритонов Cynops pyrrhogaster». Amphibia-Reptilia . 21 (3): 381– 396. doi : 10.1163/156853800507444 . ISSN 1568-5381. Архивировано из оригинала 29 октября 2022 г. . Получено 29 октября 2022 г. .
- ^ Томинага, Ацуши; Мейер-Рохов, В. Бенно; Окамото, Таку; Курияма, Такео; Нисикава, Канто; Мацуи, Масафуми (февраль 2016 г.). «Происхождение и генетическое единообразие интродуцированной популяции Cynopspyrrogaster (амфибия: Urodela) на острове Хатидзёдзима». Современная герпетология . 35 (1): 64–68 . doi :10.5358/hsj.35.64. S2CID 87404627. Архивировано из оригинала 30 октября 2022 года . Проверено 30 октября 2022 г.
- ^ Ван Бокслаер, Инес; Маекс, Марго; Трир, Даг; Янссенсвиллен, Сунита; Янссенс, Рик; Вандеберг, Вим; Пруст, Пол; Боссайт, Фрэнки (3 марта 2016 г.). «Помимо содефрина: доказательства существования многокомпонентной феромонной системы у модельного тритона Cynopspyrhogaster (Salamandridae)». Научные отчеты . 6 (1): 21880. Бибкод : 2016NatSR...621880V. дои : 10.1038/srep21880. ISSN 2045-2322. ПМК 4776240 . ПМИД 26935790.
- ^ Кикуяма, С.; Тоёда, Ф.; Омия, Й.; Мацуда, К.; Танака, С.; Хаяши, Х. (1995). «Содефрин: привлекающий самок пептидный феромон в клоакальных железах тритона». Science . 267 (5204): 1643– 1645. Bibcode :1995Sci...267.1643K. doi :10.1126/science.7886452. ISSN 0036-8075. JSTOR 2886746. PMID 7886452. S2CID 38424857. Архивировано из оригинала 29 октября 2022 г. Получено 29 октября 2022 г.
- ^ ab Kutsuki, Takako; Hasegawa, Eisuke (сентябрь 2016 г.). «Предпочтение самок по признакам поведения и морфологии самца японского тритона Cynops pyrrhogaster». Journal of Ethology . 34 (3): 337– 342. doi :10.1007/s10164-016-0480-x. S2CID 11330345. Архивировано из оригинала 30 октября 2022 г. Получено 30 октября 2022 г.
- ^ abc Тиба, Чикафуми; Ямада, Шута; Танака, Хибики; Инаэ-Чиба, Майко; Миура, Томоя; Каско-Роблес, Мартин Мигель; Ёсикава, Таро; Инами, Ватару; Мизуно, Аки; Ислам, доктор медицинских наук. Рафикуль; Хан, Вендже; Ясумуро, Хирофуми; Мацумото, Микико; Такаянаги, Мияко (1 мая 2012 г.). «Ингибирование метаморфоза: альтернативный протокол выращивания тритона Cynopspyrhogaster». Зоологическая наука . 29 (5): 293–298 . doi :10.2108/zsj.29.293. PMID 22559962. S2CID 22637590 . Получено 30 октября 2022 г.
- ^ Каско-Роблес, Мартин Мигель; Ямада, Шута; Миура, Томоя; Накамура, Кента; Хейнс, Трейси; Маки, Нобуясу; Дель Рио-Цонис, Катя; Цонис, Панайотис А; Тиба, Чикафуми (май 2011 г.). «Экспрессия экзогенных генов у тритонов путем трансгенеза». Протоколы природы . 6 (5): 600–608 . doi :10.1038/nprot.2011.334. PMID 21527918. S2CID 5305751. Архивировано из оригинала 18 ноября 2022 года . Проверено 30 октября 2022 г.
- ^ abc Yazawa T, Yamamoto T, Nakayama Y, Hamada S, Abé S. Переход от митоза к мейозу: морфология и экспрессия ядерного антигена пролиферирующих клеток (PCNA) и Dmc1 во время сперматогенеза тритона. Dev Growth Differ. 2000 Dec;42(6):603-11. doi: 10.1046/j.1440-169x.2000.00544.x. PMID 11142682
- ^ Хикари, Накагава; Хо, Кусано (2007). 東京都八王子市南大沢におけるアカハライモリ (Cynops пиррогастер) の食性 中川 光, 草野 保. Бюллетень Герпетологического общества (на японском языке). 2007 (1): 1–5 . doi : 10.14880/hrghsj1999.2007.1. Архивировано из оригинала 31 октября 2022 года . Проверено 31 октября 2022 г.(требуется подписка)
- ^ ab Mochida, Koji; Mori, Akira (29 ноября 2021 г.). «Поведение тритонов (Cynops pyrrhogaster) против змей в борьбе с хищниками». PLOS ONE . 16 (11): e0258218. Bibcode : 2021PLoSO..1658218M. doi : 10.1371/journal.pone.0258218 . PMC 8629279. PMID 34843491 .
- ^ ab Kudo, Yuta; Chiba, Chikafumi; Konoki, Keiichi; Cho, Yuko; Yotsu-Yamashita, Mari (июль 2015 г.). «Подтверждение отсутствия тетродотоксина и его аналогов у молодых особей японского огненнобрюхого тритона Cynops pyrrhogaster, выращенных в неволе из яиц в лаборатории с использованием HILIC-LC-MS». Toxicon . 101 : 101– 105. doi :10.1016/j.toxicon.2015.05.008. PMID 25986913 . Получено 27 октября 2022 г. .
- ^ Кудо, Юта; Чиба, Чикафуми; Коноки, Кейичи; Чо, Юко; Ёцу-Ямашита, Мари (октябрь 2017 г.). «Диетическое введение тетродотоксина и его предполагаемых биосинтетических промежуточных продуктов выращенному в неволе нетоксичному японскому огненнобрюхому тритону Cynops pyrrhogaster». Toxicon . 137 : 78–82 . doi :10.1016/j.toxicon.2017.07.016. PMID 28734983. Получено 28 октября 2022 г.
- ^ "Японский огненнобрюхий тритон". iucnredlist.org . Архивировано из оригинала 26 января 2021 г. . Получено 30 октября 2022 г. .
- ^ Кавахара, Го; Такаяма, Юта; Сугияма, Макото; Икадай, Хироми; Хасимото, Осаму (2022). «Дермоцистидная инфекция у японского огнебрюхого тритона Cynopspyrrogaster». Журнал ветеринарной медицины . 84 (10): 1410–1416 . doi :10.1292/jvms.22-0233. ПМЦ 9586028 . PMID 36047163. S2CID 251945249. Архивировано из оригинала 29 октября 2022 года . Проверено 29 октября 2022 г.
- ^ Симада, Томохико; Маэда, Сиота; Сакакибара, Масаки (февраль 2016 г.). «Морфологическое исследование Cynopspyrrogaster с полуострова Чита: повторное открытие« вымершей » расы Ацуми, эндемической для полуостровных регионов префектуры Айти, Центральная Япония». Современная герпетология . 35 (1): 38–52 . doi :10.5358/hsj.35.38. ISSN 1345-5834. S2CID 88355202. Архивировано из оригинала 30 октября 2022 года . Проверено 30 октября 2022 г.
- ^ Мацумото, Мио; Такеми, Шота; Сакаи, Такафуми; Саката, Ичиро (июль 2022 г.). «Идентификация мотилина у японского огнебрюхого тритона». Общая и сравнительная эндокринология . 323–324 : 114031. doi : 10.1016/j.ygcen.2022.114031 . PMID 35331740. S2CID 247653195.
- ^ ab Tsutsumi, Rio; Inoue, Takeshi; Yamada, Shigehito; Agata, Kiyokazu (февраль 2015 г.). «Реинтеграция регенерированных и оставшихся тканей во время регенерации суставов у тритона Cynops pyrrhogaster». Регенерация . 2 (1): 26– 36. doi :10.1002/reg2.28. ISSN 2052-4412. PMC 4895332. PMID 27499865 .
- ^ Куросака, Хироси; Такано-Ямамото, Теруко; Ямаширо, Такаши; Агата, Киёказу (февраль 2008 г.). «Сравнение молекулярных и клеточных событий во время регенерации нижней челюсти тритона (Cynops pyrrhogaster) и западноафриканской шпорцевой лягушки (Xenopus tropicalis)». Динамика развития . 237 (2): 354–365 . doi : 10.1002/dvdy.21419 . PMID 18161063. S2CID 41117859.
- ^ Иноуэ, Такеши; Иноуэ, Ре; Цуцуми, Рио; Тада, Кикуо; Урата, Юко; Мичибаяси, Чиаки; Такемура, Шота; Агата, Киёкадзу (октябрь 2012 г.). «Хрусталик регенерирует посредством аналогичных процессов и сроков у взрослых особей и личинок тритона Cynopspyrrogaster». Динамика развития . 241 (10): 1575–1583 . doi :10.1002/dvdy.23854. PMID 22930574. S2CID 6513165. Архивировано из оригинала 30 октября 2022 года . Проверено 30 октября 2022 г.
- ^ Маклеод, Лианн. "Огненно-брюшной тритон: профиль вида". thesprucepets.com . Архивировано из оригинала 30 октября 2022 г. . Получено 30 октября 2022 г. .
