Изомер
В химии изомеры — это молекулы или многоатомные ионы с одинаковой молекулярной формулой , то есть одинаковым числом атомов каждого элемента , но различным расположением атомов в пространстве. [1] Изомерия относится к существованию или возможности изомеров.
Изомеры не обязательно имеют схожие химические или физические свойства . Две основные формы изомерии — это структурная (или конституционная) изомерия, при которой связи между атомами различаются; и стереоизомерия (или пространственная изомерия), при которой связи одинаковы, но относительное положение атомов различается.
Изомерные отношения формируют иерархию . Два химических вещества могут быть одним и тем же конституционным изомером, но при более глубоком анализе быть стереоизомерами друг друга. Две молекулы, которые являются одним и тем же стереоизомером друг друга, могут находиться в разных конформационных формах или быть разными изотопологами . Глубина анализа зависит от области исследования или интересующих химических и физических свойств.
Английское слово «изомер» ( / ˈ aɪ s əm ər / ) является обратной структурой от слова «изомерный» [2] , которое было заимствовано через немецкое isomerisch [3] из шведского isomerisk ; которое в свою очередь было образовано от греческого ἰσόμερoς isómeros , с корнями isos = «равный», méros = «часть». [4]

Структурные изомеры
Структурные изомеры имеют одинаковое количество атомов каждого элемента (отсюда и одинаковую молекулярную формулу ), но атомы соединены различными способами. [5]
Пример:С
3ЧАС
8О
Например, существует три различных соединения с молекулярной формулой :
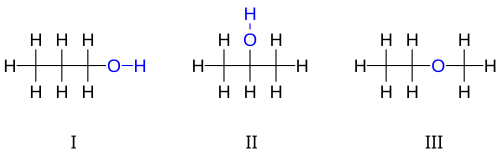
3ЧАС
8O : I 1-пропанол, II 2-пропанол, III этилметиловый эфир.
Первые два изомера, показанные на рисунке, являются пропанолами , то есть спиртами, полученными из пропана . Оба имеют цепь из трех атомов углерода, соединенных одинарными связями, причем оставшиеся валентности углерода заполнены семью атомами водорода и гидроксильной группой , содержащей атом кислорода, связанный с атомом водорода. Эти два изомера различаются тем, с каким углеродом связан гидроксил: либо с концом углеродной цепи пропан-1-ол (1-пропанол, н- пропиловый спирт, н -пропанол; I ), либо со средним углеродом пропан-2-ол (2-пропанол, изопропиловый спирт, изопропанол; II ). Их можно описать с помощью сокращенных структурных формул и .
Третий изомер — это эфир метоксиэтан (этилметиловый эфир; III ). В отличие от двух других, у него атом кислорода связан с двумя атомами углерода, а все восемь атомов водорода связаны непосредственно с атомами углерода. Его можно описать сжатой формулой .
Спирт "3-пропанол" не является другим изомером, поскольку разница между ним и 1-пропанолом не является реальной; это лишь результат произвольного выбора направления нумерации атомов углерода вдоль цепи. По той же причине "этоксиметан" является той же молекулой, что и метоксиэтан, а не другим изомером.
1-пропанол и 2-пропанол являются примерами позиционных изомеров , которые различаются положением, в котором определенные особенности, такие как двойные связи или функциональные группы , находятся в «родительской» молекуле (в данном случае пропане).
Пример:С
3ЧАС
4
Существуют также три структурных изомера углеводорода :
 | 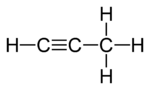 |  |
| Я Пропадиене | II Пропин | III Циклопропен |
В двух изомерах три атома углерода соединены в открытую цепь, но в одном из них ( пропадиене или аллене; I ) атомы углерода соединены двумя двойными связями , а в другом ( пропине или метилацетилене; II ) они соединены одинарной и тройной связью . В третьем изомере ( циклопропене ; III ) три атома углерода соединены в кольцо двумя одинарными связями и двойной связью. Во всех трех оставшиеся валентности атомов углерода удовлетворяются четырьмя атомами водорода.
Опять же, обратите внимание, что существует только один структурный изомер с тройной связью, поскольку другое возможное размещение этой связи — это просто рисование трех атомов углерода в другом порядке. По той же причине существует только один циклопропен, а не три.
Таутомеры
Таутомеры — это структурные изомеры, которые легко взаимопревращаются, так что два или более вида сосуществуют в равновесии, например:
. [6]
Важными примерами являются кето-енольная таутомерия и равновесие между нейтральной и цвиттер-ионной формами аминокислоты .
Стереоизомеры

.
Стереоизомеры имеют одинаковые атомы или изотопы, соединенные связями одного типа, но различаются относительным положением этих атомов в пространстве. Существуют два широких типа стереоизомеров: энантиомы и диастереомеры. Энантиомеры имеют идентичные физические свойства, а диастереомеры — нет. [7]
Энантиомеры
Два соединения называются энантиомерами, если их молекулы являются зеркальными отражениями друг друга, которые не могут быть совмещены только путем поворотов или трансляций – как левая рука и правая рука. Две формы называются хиральными .
Классический пример — бромхлорфторметан ( ). Два энантиомера можно различить, например, по тому, поворачивает ли путь по часовой стрелке или против часовой стрелки, если смотреть со стороны атома водорода. Чтобы изменить одну конформацию на другую, в какой-то момент эти четыре атома должны были бы лежать в одной плоскости — что потребовало бы сильного напряжения или разрыва их связей с атомом углерода. Соответствующий энергетический барьер между двумя конформациями настолько высок, что при комнатной температуре между ними практически нет конверсии, и их можно рассматривать как разные конфигурации.
Соединение хлорфторметан , напротив, не является хиральным: зеркальное отображение его молекулы также получается путем полуоборота вокруг подходящей оси.
Другим примером хирального соединения является 2,3-пентадиен — углеводород, содержащий две перекрывающиеся двойные связи. Двойные связи таковы, что три средних атома углерода находятся на прямой линии, а первые три и последние три лежат в перпендикулярных плоскостях. Молекула и ее зеркальное изображение не накладываются друг на друга, хотя молекула имеет ось симметрии. Два энантиомера можно различить, например, с помощью правила правой руки . Этот тип изомерии называется аксиальной изомерией.
Энантиомеры ведут себя идентично в химических реакциях, за исключением случаев, когда они реагируют с хиральными соединениями или в присутствии хиральных катализаторов , таких как большинство ферментов . По этой последней причине два энантиомера большинства хиральных соединений обычно оказывают заметно разные эффекты и играют разные роли в живых организмах. В биохимии и пищевой науке два энантиомера хиральной молекулы, такой как глюкоза , обычно идентифицируются и рассматриваются как совершенно разные вещества.
Каждый энантиомер хирального соединения обычно вращает плоскость поляризованного света , проходящего через него. Вращение имеет одинаковую величину, но противоположные направления для двух изомеров и может быть полезным способом различения и измерения их концентрации в растворе. По этой причине энантиомеры ранее назывались «оптическими изомерами». [8] [9] Однако этот термин неоднозначен и не одобряется ИЮПАК . [ 10] [11]
Некоторые пары энантиомеров (например, пары транс -циклооктена ) могут быть взаимопревращены внутренними движениями, которые лишь немного изменяют длины связей и углы. Другие пары (например, CHFClBr) не могут быть взаимопревращены без разрыва связей и, следовательно, являются различными конфигурациями.
Диастереомеры
Стереоизомеры, которые не являются энантиомерами, называются диастереомерами . Некоторые диастереомеры могут содержать хиральный центр , некоторые нет. [12]
Цис-транс-изомерия
Двойная связь между двумя атомами углерода заставляет оставшиеся четыре связи (если они одинарные) лежать в одной плоскости, перпендикулярной плоскости связи, как определено ее π-орбиталью . Если две связи на каждом углероде соединяются с разными атомами, возможны две различные конформации, которые отличаются друг от друга поворотом на 180 градусов одного из атомов углерода вокруг двойной связи.
Классическим примером является дихлорэтен , в частности структурный изомер , в котором один хлор связан с каждым углеродом. Он имеет два конформационных изомера, с двумя хлорами на одной стороне или на противоположных сторонах плоскости двойной связи. Их традиционно называют цис (от латинского слова, означающего «по эту сторону») и транс («по другую сторону»), соответственно; или Z и E в рекомендуемой ИЮПАК номенклатуре. Преобразование между этими двумя формами обычно требует временного разрыва связей (или превращения двойной связи в одинарную), поэтому эти две конфигурации считаются различными конфигурациями молекулы.
В более общем смысле цис - транс- изомерия (ранее называвшаяся «геометрической изомерией») встречается в молекулах, где относительная ориентация двух различимых функциональных групп ограничена довольно жесткой структурой других атомов. [13]
Например, в циклическом спирте инозитоле (шестикратный спирт циклогексана) шестиуглеродный циклический остов в значительной степени препятствует тому, чтобы гидроксил и водород на каждом углероде менялись местами. Поэтому существуют различные конфигурационные изомеры в зависимости от того, находится ли каждый гидроксил на «этой стороне» или «на другой стороне» средней плоскости кольца. Исключая изомеры, которые эквивалентны при вращениях, существует девять изомеров, которые различаются по этому критерию и ведут себя как различные стабильные вещества (два из них являются энантиомерами друг друга). Самый распространенный в природе ( мио -инозитол) имеет гидроксилы на углеродах 1, 2, 3 и 5 на одной стороне этой плоскости, и поэтому может быть назван цис -1,2,3,5- транс -4,6-циклогексангексол. И каждый из этих цис - транс -изомеров, возможно, может иметь стабильные конформации «кресла» или «лодки» (хотя барьеры между ними значительно ниже, чем между различными цис - транс -изомерами).

Цис- и транс- изомеры также встречаются в неорганических координационных соединениях , таких как квадратно-плоские комплексы и октаэдрические комплексы.
Для более сложных органических молекул цис- и транс -метки могут быть неоднозначными. В таких случаях используется более точная схема маркировки, основанная на правилах приоритета Кана-Ингольда-Прелога . [14] [12]
Изотопы и спин
Изотопомеры
Различные изотопы одного и того же элемента можно рассматривать как различные виды атомов при перечислении изомеров молекулы или иона. Замена одного или нескольких атомов их изотопами может создать несколько структурных изомеров и/или стереоизомеров из одного изомера.
Например, замена двух атомов обычного водорода ( ) дейтерием ( , или ) в молекуле этана дает два различных структурных изомера, в зависимости от того, находятся ли замены на одном и том же углероде (1,1-дидейтероэтан, ) или по одной на каждом углероде (1,2-дидейтероэтан, ); как если бы заместителем был хлор вместо дейтерия. Две молекулы нелегко взаимопревращаются и имеют разные свойства, такие как их микроволновый спектр . [15]
Другим примером может служить замена одного атома дейтерия на один из атомов водорода в хлорфторметане ( ). Хотя исходная молекула не является хиральной и имеет один изомер, замена создает пару хиральных энантиомеров , которые можно различить (по крайней мере, теоретически) по их оптической активности. [16]
Когда два изомера были бы идентичны, если бы все изотопы каждого элемента были заменены одним изотопом, они описываются как изотопомеры или изотопные изомеры. [17] В двух приведенных выше примерах, если бы все были заменены на , два дидейтероэтана оба стали бы этаном, а два дейтерохлорфторметана оба стали бы .
Концепция изотопомеров отличается от изотопологов или изотопных гомологов, которые различаются по своему изотопному составу. [17] Например, и являются изотопологами, а не изотопомерами, и, следовательно, не являются изомерами друг друга.
Спиновые изомеры
Другой тип изомерии, основанный на ядерных свойствах, — это спиновая изомерия , при которой молекулы различаются только относительными спиновыми магнитными квантовыми числами m s составляющих атомных ядер. Это явление имеет значение для молекулярного водорода, который можно частично разделить на два долгоживущих состояния, описываемых как спиновые изомеры [18] или ядерные спиновые изомеры: [19] параводород, в котором спины двух ядер направлены в противоположных направлениях, и ортоводород, в котором спины направлены в одном направлении.
Приложения
Изомеры, имеющие различные биологические свойства, являются обычным явлением; например, размещение метильных групп . В замещенных ксантинах теобромин , содержащийся в шоколаде, является вазодилататором с некоторыми общими с кофеином эффектами ; но если одна из двух метильных групп перемещается в другое положение на двухкольцевом ядре, изомер становится теофиллином , который оказывает множество эффектов, включая бронходилатацию и противовоспалительное действие. Другой пример этого встречается в стимулирующих препаратах на основе фенэтиламина . Фентермин является нехиральным соединением с более слабым эффектом, чем у амфетамина . Он используется в качестве лекарства, снижающего аппетит, и обладает мягкими или нулевыми стимулирующими свойствами. Однако альтернативное расположение атомов дает декстрометамфетамин , который является более сильным стимулятором, чем амфетамин.
В медицинской химии и биохимии энантиомеры представляют особый интерес, поскольку они могут обладать различной биологической активностью . Многие препаративные процедуры позволяют получить смесь равных количеств обеих энантиомерных форм. В некоторых случаях энантиомеры разделяют с помощью хроматографии с использованием хиральных неподвижных фаз. Их также можно разделить путем образования диастереомерных солей . В других случаях был разработан энантиоселективный синтез .
В качестве неорганического примера можно привести цисплатин (структуру см. выше), который является важным препаратом, используемым в химиотерапии рака, тогда как его транс-изомер (трансплатин) не обладает полезной фармакологической активностью.
История
Изомерия была впервые обнаружена в 1827 году, когда Фридрих Вёлер приготовил цианат серебра и обнаружил, что, хотя его элементный состав был идентичен гремучему серебру (приготовленному Юстусом фон Либихом годом ранее), [20] его свойства были другими. Это открытие бросило вызов преобладающему химическому пониманию того времени, которое считало, что химические соединения могут быть разными только тогда, когда их элементный состав отличается. (Теперь мы знаем, что связывающие структуры гремучего и цианата можно приблизительно описать как ≡ и , соответственно.)
Дополнительные примеры были найдены в последующие годы, такие как открытие Вёлером в 1828 году того, что мочевина имеет тот же атомный состав ( ), что и химически отличный цианат аммония . (Их структуры, как теперь известно, являются и , соответственно.) В 1830 году Йенс Якоб Берцелиус ввел термин изомерия для описания этого явления. [4] [21] [22] [23]
В 1848 году Луи Пастер заметил, что кристаллы винной кислоты имеют две формы, которые являются зеркальными отражениями друг друга. Разделяя кристаллы вручную, он получил две версии винной кислоты, каждая из которых кристаллизовалась только в одной из двух форм, и вращала плоскость поляризованного света в одинаковой степени, но в противоположных направлениях. [24] [25] В 1860 году Пастер явно выдвинул гипотезу, что молекулы изомеров могут иметь одинаковый состав, но разное расположение атомов. [26]
Смотрите также
Ссылки
- ^ Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2002). Общая химия: принципы и современные приложения (8-е изд.). Верхняя Сэддл-Ривер, Нью-Джерси: Prentice Hall. стр. 91]. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
- ^ Merriam-Webster: "изомер" Архивировано 21 октября 2020 г. в статье онлайн-словаря Wayback Machine . Доступ 26.08.2020 г.
- ^ Merriam-Webster: "изомерный" Архивировано 26 октября 2020 г. в статье онлайн-словаря Wayback Machine . Доступ 26.08.2020 г.
- ^ аб Жак. Берцелиус (1830): «Om säure aus den Voghesen, om blyoxydensatomvigt, samt allmänna anmärkningar om sådana kroppar som hafva lika sammansättning, men skiljaktiga egenskaper» («На состав винной кислоты и рацемической кислоты (Вогезовская кислота Иоанна) о молекулярной массе оксида свинца вместе с общими наблюдениями над теми телами, которые имеют одинаковый состав, но различные свойства»). Kongliga Svenska Vetenskaps Academiens Handling ( Труды Шведской королевской академии наук ), том 49, страницы 49–80
- ^ Смит, Джанис Горжински (2010). Общая, органическая и биологическая химия (1-е изд.). McGraw-Hill. стр. 450. ISBN 978-0-07-302657-2.
- ^ "таутомерия". IUPAC Gold Book . IUPAC. 2014. doi : 10.1351/goldbook.T06252 . Архивировано из оригинала 6 апреля 2019 года . Получено 21 апреля 2019 года .
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 136, ISBN 978-0-471-72091-1
- ^ Петруччи, Харвуд и Херринг 2002, стр. 996–997.
- ^ Whitten KW, Gailey KD и Davis RE «Общая химия» (4-е изд., Saunders College Publishing 1992), стр. 976–7 ISBN 978-0-03-072373-5
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «оптические изомеры». doi :10.1351/goldbook.O04308
- ^ Эрнест Л. Элиель и Сэмюэл Х. Вилен (1994). Стереохимия органических соединений . Wiley Interscience. стр. 1203.
- ^ ab Эрнест Л. Элиель и Сэмюэл Х. Вилен (1994). Стереохимия органических соединений . Wiley Interscience. С. 52–53 .
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «геометрическая изомерия». doi :10.1351/goldbook.G02620
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «цис, транс». doi :10.1351/goldbook.C01092
- ^ Эйзи Хирота (2012): "Микроволновая спектроскопия изотопно-замещенных неполярных молекул". Глава 5 в Molecular Spectroscopy: Modern Research , том 3. 466 страниц. ISBN 9780323149327
- ^ Кэмерон, Роберт П.; Гётте, Йорг Б.; Барнетт, Стивен М. (8 сентября 2016 г.). «Хиральная вращательная спектроскопия». Physical Review A. 94 ( 3): 032505. arXiv : 1511.04615 . Bibcode : 2016PhRvA..94c2505C. doi : 10.1103/physreva.94.032505 . ISSN 2469-9926.
- ^ ab Seeman, Jeffrey I.; Paine, III, JB (7 декабря 1992 г.). «Письмо редактору: 'Изотопомеры, изотопологи'». Chemical & Engineering News . 70 (2). Американское химическое общество. doi : 10.1021/cen-v070n049.p002 .
- ^ Matthews, MJ; Petitpas, G.; Aceves, SM (23 августа 2011 г.). "Исследование кинетики конверсии спиновых изомеров в сверхкритическом флюидном водороде для технологий хранения криогенного топлива". Appl. Phys. Lett . 99 (8): 081906. Bibcode :2011ApPhL..99h1906M. doi :10.1063/1.3628453. Архивировано из оригинала 2 мая 2022 г. Получено 1 мая 2022 г.
- ^ Чен, Джуди Ю.-К.; Ли, Юнджун; Фрунзи, Майкл; Лей, Сюэгун; Мурата, Ясудзиро; Лоулер, Рональд Г.; Турро, Николас (13 сентября 2013 г.). «Ядерные спиновые изомеры гостевых молекул в H2@C60, H2O@C60 и других эндофуллеренах». Философские труды Королевского общества А. 371 (1998). Бибкод : 2013RSPTA.37110628C. дои : 10.1098/rsta.2011.0628 . PMID 23918710. S2CID 20443766.
- ^ F. Kurzer (2000). "Fulminic Acid in the History of Organic Chemistry". J. Chem. Educ. 77 (7): 851– 857. Bibcode :2000JChEd..77..851K. doi :10.1021/ed077p851. Архивировано из оригинала 18 февраля 2009 года . Получено 27 июля 2012 года .
- ^ Дж. Дж. Берцелиус (1831): «Über die Zusammensetzung der Weinsäure und Traubensäure (John's säure aus den Voghesen), über das Atomengewicht des Bleioxyds, nebst allgemeinen Bemerkungen über solche Körper, die gleiche Zusammensetzung, aber ungleiche Эйгеншафтен безитцен». Annalen der Physik und Chemie , том 19, страницы 305–335.
- ^ Дж. Дж. Берцелиус (1831): «Композиция тартарной кислоты и расовой кислоты (traubensäure); атомные частицы оксида пломба и общие замечания о корпусе, который составляет состав мема, и возможно, различные свойства собственности ". Annales de Chimie et de Physique , том 46, страницы 113–147.
- ^ Эстебан, Соледад (2008). «Противоречие Либиха–Вёлера и концепция изомерии». J. Chem. Educ . 85 (9): 1201. Bibcode :2008JChEd..85.1201E. doi :10.1021/ed085p1201. Архивировано из оригинала 23 августа 2008 года . Получено 9 сентября 2008 года .
- ^ Л. Пастер (1848) «Мемуар о связи, которая может существовать между кристаллической формой и химической композицией, и о причине вращения вращающейся поляризации» (Мемуары о взаимосвязи, которая может существовать между кристаллической формой и химическим составом, а также о связи причина вращательной поляризации), Comptes rendus de l'Académie des Sciences (Париж), т. 26, стр. 535–538.
- ^ Л. Пастер (1848) «Sur les Relations qui Peuvent Exister Entre La Forme Cristalline, La Composition Chimique et le sens de La Polarization Rotatoire» («Об отношениях, которые могут существовать между кристаллической формой, химическим составом и ощущением вращения). поляризация»), Annales de Chimie et de Physique , 3-я серия, том 24, выпуск 6, страницы 442–459.
- ^ Пуллман (1998). Атом в истории человеческой мысли, стр. 230
































![{\displaystyle {\ce {[NH+4][O=C=N^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d88ac58af5dbab726d06cd37724e55e9cac30ba)

