Изофермент
В биохимии изоферменты (также известные как изоферменты или более широко как множественные формы ферментов ) — это ферменты , которые различаются по аминокислотной последовательности, но катализируют одну и ту же химическую реакцию. Изоферменты обычно имеют разные кинетические параметры (например, разные значения K M ) или регулируются по-разному. Они позволяют тонко настраивать метаболизм для удовлетворения конкретных потребностей данной ткани или стадии развития.
Во многих случаях изоферменты кодируются гомологичными генами, которые со временем разошлись. Строго говоря, ферменты с разными аминокислотными последовательностями, катализирующие одну и ту же реакцию, являются изоферментами, если кодируются разными генами, или аллозимами, если кодируются разными аллелями одного и того же гена ; эти два термина часто используются взаимозаменяемо.
Введение
Изоферменты были впервые описаны RL Hunter и Clement Markert (1957), которые определили их как различные варианты одного и того же фермента, имеющие идентичные функции и присутствующие у одного и того же человека . [1] Это определение охватывает (1) варианты фермента, которые являются продуктами разных генов и, таким образом, представляют разные локусы (описываемые как изоферменты ) и (2) ферменты, которые являются продуктами разных аллелей одного и того же гена (описываемые как аллозимы ). [2]
Изоферменты обычно являются результатом дупликации генов , но также могут возникать в результате полиплоидизации или гибридизации нуклеиновых кислот . С течением времени эволюции, если функция нового варианта остается идентичной исходной, то вполне вероятно, что один или другой будет утрачен по мере накопления мутаций , что приведет к появлению псевдогена . Однако, если мутации не сразу препятствуют функционированию фермента, а вместо этого изменяют либо его функцию, либо его характер экспрессии , то оба варианта могут быть одобрены естественным отбором и стать специализированными для разных функций. [3] Например, они могут быть выражены на разных стадиях развития или в разных тканях. [4]
Аллозимы могут быть результатом точечных мутаций или событий вставки-делеции ( индел ), которые влияют на кодирующую последовательность гена. Как и в случае с любыми другими новыми мутациями, с новым аллозимом могут произойти три вещи:
- Вероятнее всего, новый аллель окажется нефункциональным, и в этом случае он, вероятно, приведет к низкой приспособленности и будет удален из популяции естественным отбором . [5]
- В качестве альтернативы, если аминокислотный остаток, который изменяется, находится в относительно незначительной части фермента (например, далеко от активного центра ), то мутация может быть селективно нейтральной и подверженной генетическому дрейфу . [6]
- В редких случаях мутация может привести к появлению фермента, который более эффективен, или фермента, который может катализировать немного другую химическую реакцию , в этом случае мутация может привести к повышению приспособленности и быть благоприятной для естественного отбора. [6]
Примеры
Примером изофермента является глюкокиназа , вариант гексокиназы , который не ингибируется глюкозо-6-фосфатом . Его различные регуляторные особенности и более низкое сродство к глюкозе (по сравнению с другими гексокиназами) позволяют ему выполнять различные функции в клетках определенных органов, такие как контроль высвобождения инсулина бета-клетками поджелудочной железы или инициация синтеза гликогена клетками печени . Оба эти процесса должны происходить только при избытке глюкозы.
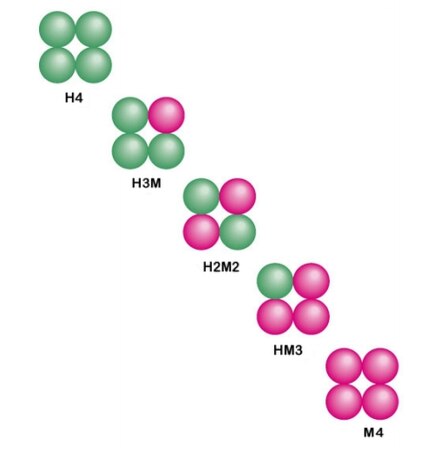

1.) Фермент лактатдегидрогеназа представляет собой тетрамер, состоящий из двух различных субъединиц, H-формы и M-формы. Они объединяются в различных комбинациях в зависимости от ткани: [7]
| Тип | Состав | Расположение | Электрофоретическая подвижность | Будь то уничтоженный Тепло (при 60 °C) | Процент от нормы сыворотка у людей |
|---|---|---|---|---|---|
| ЛДГ 1 | ХХХХ | Сердце и эритроциты | Самый быстрый | Нет | 25% |
| ЛДГ 2 | ЧЧЧМ | Сердце и эритроциты | Быстрее | Нет | 35% |
| ЛДГ 3 | ЧЧММ | Мозг и почки | Быстрый | Частично | 27% |
| ЛДГ 4 | ХМ | Скелетные мышцы и печень | Медленный | Да | 8% |
| ЛДГ 5 | ММММ | Скелетные мышцы и печень | Самый медленный | Да | 5% |
2.) Изоферменты креатинфосфокиназы: [7] Креатинкиназа (КК) или креатинфосфокиназа (КФК) катализирует взаимопревращение фосфокреатина в креатин.
КФК существует в 3 изоферментах. Каждый изофермент представляет собой димер из 2 субъединиц M (мышцы), B (мозг) или обеих [7]
| Изофермент | Субъединица | Ткань происхождения |
|---|---|---|
| КПК 1 | ВВ | Мозг |
| КПК 2 | МБ | Сердце |
| КПК 3 | ММ | Скелетные мышцы |
3.) Изоферменты щелочной фосфатазы: [7] Было идентифицировано шесть изоферментов. Фермент является мономером, изоферменты обусловлены различиями в содержании углеводов (остатков сиаловой кислоты). Наиболее важными изоферментами ЩФ являются α1 - ЩФ, α2 - термолабильная ЩФ, α2 - термостабильная ЩФ, пре-β ЩФ и γ-ЩФ. Повышение α2 - термолабильной ЩФ предполагает гепатит, тогда как пре-β ЩФ указывает на заболевания костей.
Различение изоферментов
Изозимы (и аллозимы) являются вариантами одного и того же фермента. Если они не идентичны по своим биохимическим свойствам, например, по субстратам и кинетике фермента , их можно различить с помощью биохимического анализа . Однако такие различия обычно незначительны, особенно между аллозимами , которые часто являются нейтральными вариантами . Эта тонкость ожидаема, поскольку два фермента, которые существенно различаются по своей функции, вряд ли были идентифицированы как изозимы .
Хотя изоферменты могут быть почти идентичны по функциям, они могут отличаться в других отношениях. В частности, замены аминокислот , которые изменяют электрический заряд фермента, легко идентифицируются с помощью гель-электрофореза , и это формирует основу для использования изоферментов в качестве молекулярных маркеров . Для идентификации изоферментов сырой белковый экстракт получают путем измельчения животной или растительной ткани с экстракционным буфером, а компоненты экстракта разделяют в соответствии с их зарядом с помощью гель-электрофореза. Исторически это обычно делалось с использованием гелей, изготовленных из картофельного крахмала , но акриламидные гели обеспечивают лучшее разрешение.
Все белки из ткани присутствуют в геле, поэтому отдельные ферменты должны быть идентифицированы с помощью анализа, который связывает их функцию с реакцией окрашивания. Например, обнаружение может быть основано на локальном осаждении растворимых индикаторных красителей, таких как соли тетразолия , которые становятся нерастворимыми, когда они восстанавливаются такими кофакторами , как НАД или НАДФ , которые образуются в зонах активности ферментов. Этот метод анализа требует, чтобы ферменты оставались функциональными после разделения ( нативного гель-электрофореза ), и представляет наибольшую сложность для использования изоферментов в качестве лабораторной техники.
Изоферменты различаются по кинетике (имеют разные значения K M и V max ).
Изоферменты и аллозимы как молекулярные маркеры
Популяционная генетика по сути является изучением причин и следствий генетической изменчивости внутри и между популяциями, и в прошлом изоферменты были одними из наиболее широко используемых молекулярных маркеров для этой цели. Хотя в настоящее время они в значительной степени вытеснены более информативными подходами на основе ДНК (такими как прямое секвенирование ДНК , полиморфизмы отдельных нуклеотидов и микросателлиты ), они по-прежнему являются одними из самых быстрых и дешевых в разработке маркерных систем и остаются (по состоянию на 2005 год [обновлять]) отличным выбором для проектов, в которых необходимо идентифицировать только низкие уровни генетической изменчивости, например, количественная оценка систем спаривания .
Другие важные примеры
- Изоферменты цитохрома P450 играют важную роль в метаболизме и стероидогенезе .
- Множественные формы фосфодиэстеразы также играют важную роль в различных биологических процессах. Хотя в отдельных клетках было обнаружено более одной формы этих ферментов, эти изоформы фермента неравномерно распределены в различных клетках организма. С клинической точки зрения было обнаружено, что они избирательно активируются и ингибируются, что привело к их использованию в терапии.
Ссылки
- Хантер, Р. Л.; Меркерт, К. Л. (1957). «Гистохимическая демонстрация ферментов, разделенных зонным электрофорезом в крахмальных гелях». Science . 125 (3261): 1294– 1295. doi :10.1126/science.125.3261.1294-a. PMID 13432800.
- Weiss, B.; Hait, WN (1977). «Селективные ингибиторы циклической нуклеотидной фосфодиэстеразы как потенциальные терапевтические агенты». Annu. Rev. Pharmacol. Toxicol . 17 : 441– 477. doi :10.1146/annurev.pa.17.040177.002301. PMID 17360.
- Вендель, Дж. Ф. и Н. Ф. Виден. 1990. «Визуализация и интерпретация изоферментов растений». стр. 5–45 в DE Soltis и PS Soltis , ред. Изоферменты в биологии растений. Chapman and Hall, Лондон.
- Weeden, NF, и JF Wendel. 1990. "Генетика изоферментов растений". стр. 46–72 в DE Soltis и PS Soltis , ред. Изоферменты в биологии растений. Chapman and Hall, Лондон
- Crawford, DJ. 1989. «Электрофорез ферментов и систематика растений». стр. 146–164 в DE Soltis и PS Soltis , ред. Изоферменты в биологии растений. Dioscorides, Портленд, Орегон.
- Hamrick, JL и MJW Godt. 1990. «Аллозимное разнообразие у видов растений». стр. 43–63 в AHD Brown, MT Clegg, AL Kahler и BS Weir, ред. Генетика популяций растений, селекция и генетические ресурсы. Sinauer, Sunderland
- Биохимия Джереми М. Берга, Джона Л. Тимочко, Люберта Страйера (Введение взято из этого учебника)
- Специфический
- ^ Маркерт, Клемент Л.; Моллер, Фредди (1959). «Множественные формы ферментов: тканевые, онтогенетические и видоспецифичные закономерности». Труды Национальной академии наук Соединенных Штатов Америки . 45 (5): 753–763 . doi : 10.1073/pnas.45.5.753 . PMC 222630. PMID 16590440 .
- ^ Кирни (2014). Фундаментальная генетика (3-е изд.). McNaughton Publishing. С. 413–414 .
- ^ Джеральд, Джеральд (2015). Книга по биологии: от происхождения жизни до эпигенетики, 250 вех в истории биологии . Стерлинг. стр. 79.
- ^ Хуан, Ле (2009). Геном . Грейди-Макферсон. стр. 299.
- ^ Альбертс (2017). Молекулярная биология клетки (6-е изд.). Garland Science. стр. 649.
- ^ ab Walstrom, Ford; et al. (2014). «Модели генетики и естественного отбора: современное биомолекулярное понимание». Биомолекулярная экология . 70 (2): 1021– 1034.
- ^ abcd Сатьянараяна, У. (2002). Биохимия (2-е изд.). Калькутта, Индия: Книги и сопутствующие товары. ISBN 8187134801. OCLC 71209231.
Внешние ссылки
- Методы аллозимного электрофореза – полное руководство по электрофорезу в крахмальном геле
- Разработка новых изоферментных терапевтических средств – диоксигеназы жирных кислот и эйкозаноидные гормоны (Эстония)