Псевдоген

Псевдогены — это нефункциональные сегменты ДНК , которые напоминают функциональные гены . Большинство из них возникают как избыточные копии функциональных генов, либо напрямую путем дупликации генов , либо косвенно путем обратной транскрипции транскрипта мРНК . Псевдогены обычно идентифицируются, когда анализ последовательности генома обнаруживает геноподобные последовательности, в которых отсутствуют регуляторные последовательности, необходимые для транскрипции или трансляции , или чьи кодирующие последовательности явно дефектны из-за сдвигов рамки считывания или преждевременных стоп-кодонов . Псевдогены — это тип мусорной ДНК .
Большинство небактериальных геномов содержат много псевдогенов, часто столько же, сколько и функциональных генов. Это неудивительно, поскольку ожидается, что различные биологические процессы будут случайно создавать псевдогены, и не существует специализированных механизмов для их удаления из геномов. В конечном итоге псевдогены могут быть удалены из их геномов случайно из-за ошибок репликации ДНК или репарации ДНК , или они могут накопить так много мутационных изменений, что их больше нельзя будет распознать как бывшие гены. Анализ этих событий дегенерации помогает прояснить эффекты неселективных процессов в геномах.
Последовательности псевдогенов могут транскрибироваться в РНК на низких уровнях из-за элементов промотора, унаследованных от гена предка или возникших в результате новых мутаций. Хотя большинство этих транскриптов не будут иметь большего функционального значения, чем случайные транскрипты из других частей генома, некоторые из них дали начало полезным регуляторным РНК и новым белкам.
Характеристики
В этом разделе отсутствует информация о более быстром накоплении мутации. ( Декабрь 2023 ) |
Псевдогены обычно характеризуются сочетанием сходства или гомологии с известным геном вместе с потерей некоторой функциональности. То есть, хотя каждый псевдоген имеет последовательность ДНК , которая похожа на какой-то функциональный ген, они обычно не способны производить функциональные конечные белковые продукты. [1] Псевдогены иногда трудно идентифицировать и характеризовать в геномах, потому что два требования сходства и потери функциональности обычно подразумеваются через выравнивание последовательностей, а не доказаны биологически.
- Гомология подразумевается через сходство последовательностей между последовательностями ДНК псевдогена и известного гена. После выравнивания двух последовательностей вычисляется процент идентичных пар оснований . Высокая идентичность последовательностей означает, что весьма вероятно, что эти две последовательности разошлись с общей предковой последовательностью (гомологичны), и крайне маловероятно, что эти две последовательности эволюционировали независимо (см. Конвергентная эволюция ).
- Нефункциональность может проявляться многими способами. Обычно ген должен пройти несколько этапов для получения полностью функционального белка: транскрипция , пре-мРНК-обработка , трансляция и сворачивание белка — все это необходимые части этого процесса. Если какой-либо из этих этапов не удается, то последовательность может считаться нефункциональной. При высокопроизводительной идентификации псевдогенов наиболее часто выявляемыми нарушениями являются преждевременные стоп-кодоны и сдвиги рамки считывания , которые почти всегда предотвращают трансляцию функционального белкового продукта.
Псевдогены для генов РНК обычно сложнее обнаружить, поскольку их не нужно транслировать, и, таким образом, у них нет «рамок считывания». Ряд псевдогенов рРНК были идентифицированы на основе изменений в концах массива рДНК. [2]
Псевдогены могут усложнять молекулярно-генетические исследования. Например, амплификация гена с помощью ПЦР может одновременно амплифицировать псевдоген, который разделяет схожие последовательности. Это известно как смещение ПЦР или смещение амплификации. Аналогично псевдогены иногда аннотируются как гены в последовательностях генома .
Обработанные псевдогены часто представляют проблему для программ предсказания генов , часто ошибочно идентифицируясь как настоящие гены или экзоны. Было высказано предположение, что идентификация обработанных псевдогенов может помочь повысить точность методов предсказания генов. [3]
В 2014 году было показано, что транслируются 140 человеческих псевдогенов. [4] Однако функция белковых продуктов, если таковая имеется, неизвестна.
Типы и происхождение
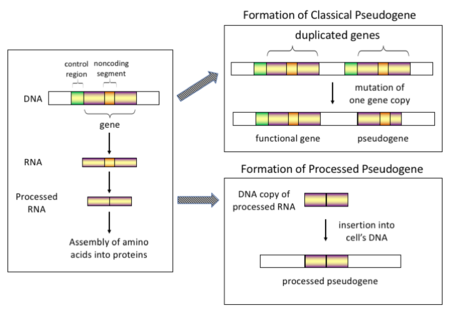
Существует четыре основных типа псевдогенов, все с различными механизмами происхождения и характерными чертами. Классификации псевдогенов следующие:
Обработано

У высших эукариот , особенно млекопитающих , ретротранспозиция является довольно распространенным событием, которое оказало огромное влияние на состав генома. Например, где-то от 30 до 44% человеческого генома состоит из повторяющихся элементов, таких как SINE и LINE (см. ретротранспозоны ). [7] [8] В процессе ретротранспозиции часть транскрипта мРНК или гнРНК гена спонтанно обратно транскрибируется обратно в ДНК и вставляется в хромосомную ДНК. Хотя ретротранспозоны обычно создают копии самих себя, в системе in vitro было показано , что они также могут создавать ретротранспонированные копии случайных генов. [9] После того, как эти псевдогены вставляются обратно в геном, они обычно содержат поли-А-хвост , и обычно их интроны вырезаются ; это обе отличительные черты кДНК . Однако, поскольку они получены из продукта РНК, обработанные псевдогены также не имеют восходящих промоутеров нормальных генов; таким образом, они считаются «мертвыми по прибытии», становясь нефункциональными псевдогенами сразу после события ретротранспозиции. [10] Однако эти вставки иногда вносят экзоны в существующие гены, обычно через альтернативно сплайсированные транскрипты. [11] Еще одной характеристикой обработанных псевдогенов является обычное усечение 5'-конца относительно родительской последовательности, что является результатом относительно непроцессивного механизма ретротранспозиции, который создает обработанные псевдогены. [12] Обработанные псевдогены постоянно создаются у приматов. [13] Например, человеческие популяции имеют различные наборы обработанных псевдогенов среди своих особей. [14]
Было показано, что обработанные псевдогены накапливают мутации быстрее, чем необработанные псевдогены. [15]
Необработанный (дублированный)

Дупликация генов — еще один распространенный и важный процесс в эволюции геномов. Копия функционального гена может возникнуть в результате события дупликации гена, вызванного гомологичной рекомбинацией , например, в повторяющихся последовательностях SINE на смещенных хромосомах, и впоследствии приобрести мутации , которые заставляют копию терять функцию исходного гена. Дуплицированные псевдогены обычно имеют все те же характеристики, что и гены, включая неповрежденную структуру экзон - интрона и регуляторные последовательности. Потеря функциональности дуплицированного гена обычно мало влияет на приспособленность организма , поскольку неповрежденная функциональная копия все еще существует. Согласно некоторым эволюционным моделям, общие дублированные псевдогены указывают на эволюционное родство людей и других приматов. [16] Если псевдогенизация вызвана дупликацией гена, она обычно происходит в первые несколько миллионов лет после дупликации гена, при условии, что ген не подвергался какому-либо давлению отбора . [17] Дупликация гена создает функциональную избыточность , и обычно невыгодно нести два идентичных гена. Мутации, которые нарушают либо структуру, либо функцию любого из двух генов, не являются вредными и не будут удалены в процессе отбора. В результате мутировавший ген постепенно становится псевдогеном и будет либо невыраженным, либо бесфункциональным. Такого рода эволюционная судьба показана с помощью популяционного генетического моделирования [18] [19] , а также геномного анализа . [17] [20] Согласно эволюционному контексту, эти псевдогены будут либо удалены, либо станут настолько отличными от родительских генов, что их больше нельзя будет идентифицировать. Относительно молодые псевдогены можно распознать благодаря сходству их последовательностей. [21]
Унитарные псевдогены

Различные мутации (такие как индели и бессмысленные мутации ) могут помешать гену нормально транскрибироваться или транслироваться , и, таким образом, ген может стать менее- или нефункциональным или «дезактивированным». Это те же механизмы, посредством которых необработанные гены становятся псевдогенами, но разница в этом случае заключается в том, что ген не был дублирован до псевдогенизации. Обычно такой псевдоген вряд ли закрепится в популяции, но различные популяционные эффекты, такие как генетический дрейф , бутылочное горлышко популяции или, в некоторых случаях, естественный отбор , могут привести к фиксации. Классическим примером унитарного псевдогена является ген, который предположительно кодирует фермент L-гулоно-γ-лактоноксидазу (GULO) у приматов. У всех изученных млекопитающих, кроме приматов (кроме морских свинок), GULO помогает в биосинтезе аскорбиновой кислоты (витамина С), но он существует как отключенный ген (GULOP) у людей и других приматов. [22] [23] Другой более недавний пример неработающего гена связывает деактивацию гена каспазы 12 (через бессмысленную мутацию ) с положительным отбором у людей. [24]
Примеры функции псевдогена
Хотя подавляющее большинство псевдогенов утратили свою функцию, появились некоторые случаи, в которых псевдоген либо восстановил свою первоначальную или похожую функцию, либо развил новую функцию. В геноме человека было выявлено несколько примеров, которые изначально были классифицированы как псевдогены, но позже было обнаружено, что они имеют функциональную, хотя и не обязательно кодирующую белок, роль. [25] [26]
Вот несколько примеров:
Кодирование белка: "псевдопсевдогены"
.jpg/440px-Drosophila_melanogaster_-_side_(aka).jpg)
Быстрое распространение технологий секвенирования ДНК привело к идентификации многих очевидных псевдогенов с использованием методов предсказания генов . Псевдогены часто идентифицируются по появлению преждевременного стоп-кодона в предсказанной последовательности мРНК, что, теоретически, должно было бы предотвратить синтез ( трансляцию ) нормального белкового продукта исходного гена. Были некоторые сообщения о трансляционном считывании таких преждевременных стоп-кодонов у млекопитающих. Как указано на рисунке выше, небольшое количество белкового продукта такого считывания все еще может быть распознаваемым и функционировать на каком-то уровне. Если это так, псевдоген может быть подвергнут естественному отбору . Это, по-видимому, произошло во время эволюции видов Drosophila .
В 2016 году было сообщено, что четыре предсказанных псевдогена в нескольких видах Drosophila на самом деле кодируют белки с биологически важными функциями, [27] «предполагая, что такие «псевдопсевдогены» могут представлять собой широко распространенное явление». Например, функциональный белок ( обонятельный рецептор глутамата ) из гена Ir75a обнаружен только в нейронах . Это обнаружение тканеспецифичных биологически-функциональных генов, которые могли бы быть классифицированы как псевдогены с помощью анализа in silico, усложняет анализ данных о последовательностях. [27] Другим псевдопсевдогеном Drosophila является jingwei , [28] [29] , который кодирует функциональный фермент алкогольдегидрогеназу in vivo . [30]
По состоянию на 2012 год, в геноме человека насчитывается около 12 000–14 000 псевдогенов. [31] Протеогеномный анализ 2016 года с использованием масс-спектрометрии пептидов выявил по меньшей мере 19 262 человеческих белка, полученных из 16 271 гена или кластеров генов, при этом было идентифицировано 8 новых генов, кодирующих белки, которые ранее считались псевдогенами. [32] Более ранний анализ показал, что человеческий PGAM4 (фосфоглицератмутаза), [33] ранее считавшийся псевдогеном, не только функционален, но и вызывает бесплодие в случае мутации. [34] [35]
Ряд псевдопсевдогенов также были обнаружены у прокариот, где некоторые замены стоп-кодонов в основных генах, по-видимому, сохраняются, даже при положительном отборе. [36] [37]
Некодирующий белок
siRNAs . Некоторые эндогенные siRNAs , по-видимому, происходят от псевдогенов, и, таким образом, некоторые псевдогены играют роль в регуляции транскриптов, кодирующих белки, как было рассмотрено. [38] Одним из многих примеров является psiPPM1K. Обработка РНК, транскрибированных с psiPPM1K, дает siRNAs, которые могут подавлять наиболее распространенный тип рака печени, гепатоцеллюлярную карциному . [39] Это и многие другие исследования привели к значительному волнению относительно возможности нацеливания псевдогенов с помощью/в качестве терапевтических агентов [40]
piRNAs . Некоторые piRNAs происходят из псевдогенов, расположенных в кластерах piRNA. [41] Эти piRNAs регулируют гены через путь piRNA в яичках млекопитающих и имеют решающее значение для ограничения повреждения генома мобильными элементами . [42]

микроРНК . Существует множество сообщений о транскриптах псевдогенов, действующих как приманки микроРНК . Возможно, самым ранним определенным примером такого псевдогена, вовлеченного в рак, является псевдоген BRAF . Ген BRAF является протоонкогеном , который при мутации связан со многими видами рака. Обычно количество белка BRAF контролируется в клетках с помощью действия микроРНК. В обычных ситуациях количество РНК из BRAF и псевдогена BRAFP1 конкурируют за микроРНК, но баланс двух РНК таков, что клетки растут нормально. Однако, когда экспрессия РНК BRAFP1 увеличивается (либо экспериментально, либо в результате естественных мутаций), меньше микроРНК доступно для контроля экспрессии BRAF, и увеличенное количество белка BRAF вызывает рак. [43] Такого рода конкуренция за регуляторные элементы со стороны РНК, которые являются эндогенными для генома, привела к появлению термина ce RNA .
PTEN . Ген PTEN — известный ген-супрессор опухолей . Псевдоген PTEN, PTENP1 — это обработанный псевдоген, который по своей генетической последовательности очень похож на ген дикого типа. Однако PTENP1 имеет миссенс-мутацию, которая устраняет кодон для инициирующего метионина и, таким образом, предотвращает трансляцию нормального белка PTEN. [44] Несмотря на это, PTENP1, по-видимому, играет роль в онкогенезе . 3'- UTR мРНК PTENP1 функционирует как приманка мРНК PTEN, нацеливаясь на микроРНК из-за ее сходства с геном PTEN, а сверхэкспрессия 3'-UTR приводит к повышению уровня белка PTEN. [45] То есть сверхэкспрессия 3'-UTR PTENP1 приводит к повышению регуляции и подавлению раковых опухолей. Биология этой системы в основном является обратной по отношению к системе BRAF, описанной выше.
Потогены . Псевдогены могут, в эволюционных временных масштабах, участвовать в генной конверсии и других мутационных событиях, которые могут привести к появлению новых или вновь функциональных генов. Это привело к концепции, что псевдогены можно рассматривать как потогены : потенциальные гены для эволюционной диверсификации. [46]
Бактериальные псевдогены
Псевдогены обнаружены в бактериях . [47] Большинство из них обнаружено в бактериях, которые не являются свободноживущими; то есть они являются либо симбионтами , либо облигатными внутриклеточными паразитами . Таким образом, им не требуется много генов, которые необходимы свободноживущим бактериям, например, гены, связанные с метаболизмом и репарацией ДНК. Однако не существует порядка, в котором функциональные гены теряются в первую очередь. Например, самые старые псевдогены в Mycobacterium leprae находятся в РНК-полимеразах и биосинтезе вторичных метаболитов , тогда как самые старые в Shigella flexneri и Shigella typhi находятся в репликации ДНК , рекомбинации и репарации . [48]
Поскольку большинство бактерий, несущих псевдогены, являются либо симбионтами, либо облигатными внутриклеточными паразитами, размер генома в конечном итоге уменьшается. Крайним примером является геном Mycobacterium leprae , облигатного паразита и возбудителя проказы . Сообщается, что он имеет 1133 псевдогена, которые дают начало примерно 50% его транскриптома . [48] Эффект псевдогенов и сокращения генома можно еще больше увидеть при сравнении с Mycobacterium marinum , патогеном из того же семейства. Mycobacteirum marinum имеет больший геном по сравнению с Mycobacterium leprae , потому что он может выживать вне хозяина; следовательно, геном должен содержать гены, необходимые для этого. [49]
Хотя редукция генома фокусируется на том, какие гены не нужны, избавляясь от псевдогенов, селективное давление со стороны хозяина может повлиять на то, что сохраняется. В случае симбионта из типа Verrucomicrobiota существует семь дополнительных копий гена, кодирующего путь манделалида. [50] Хозяин, вид из Lissoclinum , использует манделалиды как часть своего защитного механизма. [50]
Связь между эпистазом и теорией домино потери генов наблюдалась у Buchnera aphidicola . Теория домино предполагает, что если один ген клеточного процесса становится инактивированным, то отбор в других вовлеченных генах ослабевает, что приводит к потере генов. [48] При сравнении Buchnera aphidicola и Escherichia coli было обнаружено , что положительный эпистаз способствует потере генов, тогда как отрицательный эпистаз препятствует этому.

This article is missing information about archaea. (December 2023) |
Смотрите также
- Список отключенных человеческих псевдогенов
- Молекулярная эволюция
- Молекулярная палеонтология
- Псевдоген (база данных)
- Ретропозон
- Ретротранспозон
Ссылки
- ^ Mighell AJ, Smith NR, Robinson PA, Markham AF (февраль 2000 г.). «Псевдогены позвоночных». FEBS Letters . 468 (2–3): 109–114. doi : 10.1016/S0014-5793(00)01199-6 . PMID 10692568. S2CID 42204036.
- ^ Robicheau BM, Susko E, Harrigan AM, Snyder M (февраль 2017 г.). «Гены рибосомальной РНК способствуют формированию псевдогенов и мусорной ДНК в геноме человека». Genome Biology and Evolution . 9 (2): 380–397. doi :10.1093/gbe/evw307. PMC 5381670. PMID 28204512 .
- ^ van Baren MJ, Brent MR (май 2006). «Итеративное предсказание генов и удаление псевдогенов улучшают аннотацию генома». Genome Research . 16 (5): 678–685. doi :10.1101/gr.4766206. PMC 1457044 . PMID 16651666.
- ^ Kim MS, Pinto SM, Getnet D, Nirujogi RS, Manda SS, Chaerkady R и др. (май 2014 г.). «Черновик карты человеческого протеома». Nature . 509 (7502): 575–581. Bibcode :2014Natur.509..575K. doi :10.1038/nature13302. PMC 4403737 . PMID 24870542.
- ^ Макс Э. Э. (1986). «Ошибки плагиата и молекулярная генетика». Creation Evolution Journal . 6 (3): 34–46.
- ^ Чандрасекаран С, Бетран Э (2008). «Происхождение новых генов и псевдогенов». Nature Education . 1 (1): 181.
- ^ Jurka J (декабрь 2004 г.). «Эволюционное влияние повторяющихся элементов Alu человека». Current Opinion in Genetics & Development . 14 (6): 603–608. doi :10.1016/j.gde.2004.08.008. PMID 15531153.
- ^ Dewannieux M, Heidmann T (2005). «LINEs, SINEs и обработанные псевдогены: паразитические стратегии для моделирования генома». Cytogenetic and Genome Research . 110 (1–4): 35–48. doi :10.1159/000084936. PMID 16093656. S2CID 25083962.
- ^ Dewannieux M, Esnault C, Heidmann T (сентябрь 2003 г.). «LINE-опосредованная ретротранспозиция маркированных последовательностей Alu». Nature Genetics . 35 (1): 41–48. doi :10.1038/ng1223. PMID 12897783. S2CID 32151696.
- ^ Graur D, Shuali Y, Li WH (апрель 1989). «Делеции в обработанных псевдогенах накапливаются быстрее у грызунов, чем у людей». Journal of Molecular Evolution . 28 (4): 279–285. Bibcode : 1989JMolE..28..279G. doi : 10.1007/BF02103423. PMID 2499684. S2CID 22437436.
- ^ Baertsch R, Diekhans M, Kent WJ, Haussler D, Brosius J (октябрь 2008 г.). «Вклад ретрокопий в эволюцию генома человека». BMC Genomics . 9 : 466. doi : 10.1186/1471-2164-9-466 . PMC 2584115. PMID 18842134 .
- ^ Павличек А., Пейс Дж., Зика Р., Хейнар Дж. (октябрь 2002 г.). «Распределение длин длинных вставленных нуклеотидных элементов (LINEs) и обработанных псевдогенов эндогенных ретровирусов человека: последствия для ретротранспозиции и обнаружения псевдогенов». Gene . 300 (1–2): 189–194. doi :10.1016/S0378-1119(02)01047-8. PMID 12468100.
- ^ Navarro FC, Galante PA (июль 2015 г.). «Полногеномный ландшафт ретрокопий в геномах приматов». Genome Biology and Evolution . 7 (8): 2265–2275. doi :10.1093/gbe/evv142. PMC 4558860. PMID 26224704 .
- ^ Schrider DR, Navarro FC, Galante PA, Parmigiani RB, Camargo AA, Hahn MW, de Souza SJ (2013-01-24). "Полиморфизм числа копий генов, вызванный ретротранспозицией у людей". PLOS Genetics . 9 (1): e1003242. doi : 10.1371/journal.pgen.1003242 . PMC 3554589 . PMID 23359205.
- ^ Zheng D, Frankish A, Baertsch R, Kapranov P, Reymond A, Choo SW и др. (июнь 2007 г.). «Псевдогены в регионах ENCODE: консенсусная аннотация, анализ транскрипции и эволюция». Genome Research . 17 (6): 839–851. doi :10.1101/gr.5586307. PMC 1891343 . PMID 17568002.
- ^ Макс ЭЭ (2003-05-05). "Ошибки плагиата и молекулярная генетика". Архив TalkOrigins . Получено 22-07-2008 .
- ^ ab Lynch M, Conery JS (ноябрь 2000 г.). «Эволюционная судьба и последствия дублирования генов». Science . 290 (5494): 1151–1155. Bibcode :2000Sci...290.1151L. doi :10.1126/science.290.5494.1151. PMID 11073452.
- ^ Уолш Дж. Б. (январь 1995 г.). «Как часто у дублированных генов развиваются новые функции?». Генетика . 139 (1): 421–428. doi :10.1093/genetics/139.1.421. PMC 1206338. PMID 7705642 .
- ^ Lynch M, O'Hely M, Walsh B, Force A (декабрь 2001 г.). «Вероятность сохранения вновь возникшего генного дубликата». Genetics . 159 (4): 1789–1804. doi :10.1093/genetics/159.4.1789. PMC 1461922 . PMID 11779815.
- ^ Harrison PM, Hegyi H, Balasubramanian S, Luscombe NM, Bertone P, Echols N и др. (февраль 2002 г.). «Молекулярные ископаемые в геноме человека: идентификация и анализ псевдогенов в хромосомах 21 и 22». Genome Research . 12 (2): 272–280. doi :10.1101/gr.207102. PMC 155275 . PMID 11827946.
- ^ Чжан Дж (2003). «Эволюция путем дупликации генов: обновление». Тенденции в экологии и эволюции . 18 (6): 292–298. doi :10.1016/S0169-5347(03)00033-8.
- ^ Nishikimi M, Kawai T, Yagi K (октябрь 1992 г.). «Морские свинки обладают сильно мутировавшим геном L-гулоно-гамма-лактоноксидазы, ключевого фермента для биосинтеза L-аскорбиновой кислоты, отсутствующего у этого вида». Журнал биологической химии . 267 (30): 21967–21972. doi : 10.1016/S0021-9258(19)36707-9 . PMID 1400507.
- ^ Nishikimi M, Fukuyama R, Minoshima S, Shimizu N, Yagi K (май 1994). «Клонирование и хромосомное картирование человеческого нефункционального гена L-гулоно-гамма-лактоноксидазы, фермента для биосинтеза L-аскорбиновой кислоты, отсутствующего у человека». Журнал биологической химии . 269 (18): 13685–13688. doi : 10.1016/S0021-9258(17)36884-9 . PMID 8175804.
- ^ Xue Y, Daly A, Yngvadottir B, Liu M, Coop G, Kim Y и др. (апрель 2006 г.). «Распространение неактивной формы каспазы-12 у людей обусловлено недавним положительным отбором». American Journal of Human Genetics . 78 (4): 659–670. doi :10.1086/503116. PMC 1424700 . PMID 16532395.
- ^ Cheetham SW, Faulkner GJ, Dinger ME (март 2020 г.). «Преодоление проблем и догм для понимания функций псевдогенов». Nature Reviews. Genetics . 21 (3): 191–201. doi :10.1038/s41576-019-0196-1. PMID 31848477. S2CID 209393216.
- ^ Зербино DR, Фрэнкиш А, Фличек П (август 2020 г.). «Прогресс, проблемы и сюрпризы в аннотировании генома человека». Ежегодный обзор геномики и генетики человека . 21 (1): 55–79. doi : 10.1146/annurev-genom-121119-083418 . PMC 7116059. PMID 32421357 .
- ^ ab Прието-Годино Л.Л., Ритц Р., Баржетон Б., Абуин Л., Аргуэлло Дж.Р., Пераро М.Д., Бентон Р. (ноябрь 2016 г.). «Псевдопсевдогены обонятельных рецепторов». Природа . 539 (7627): 93–97. Бибкод :2016Natur.539...93P. дои : 10.1038/nature19824. ПМК 5164928 . ПМИД 27776356.
- ^ Джеффс П., Эшбёрнер М. (май 1991 г.). «Обработанные псевдогены у дрозофилы». Труды. Биологические науки . 244 (1310): 151–159. Bibcode : 1991RSPSB.244..151J. doi : 10.1098/rspb.1991.0064. PMID 1679549. S2CID 1665885.
- ^ Wang W, Zhang J, Alvarez C, Llopart A, Long M (сентябрь 2000 г.). «Происхождение гена Jingwei и сложная модульная структура его родительского гена, yellow Emperor, у Drosophila melanogaster». Молекулярная биология и эволюция . 17 (9): 1294–1301. doi : 10.1093/oxfordjournals.molbev.a026413 . PMID 10958846.
- ^ Long M, Langley CH (апрель 1993 г.). «Естественный отбор и происхождение jingwei, химерного процессированного функционального гена у Drosophila». Science . 260 (5104): 91–95. Bibcode :1993Sci...260...91L. doi :10.1126/science.7682012. PMID 7682012.
- ^ Pei B, Sisu C, Frankish A, Howald C, Habegger L, Mu XJ и др. (сентябрь 2012 г.). «Ресурс псевдогенов GENCODE». Genome Biology . 13 (9): R51. doi : 10.1186/gb-2012-13-9-r51 . PMC 3491395. PMID 22951037 .
- ^ Wright JC, Mudge J, Weisser H, Barzine MP, Gonzalez JM, Brazma A и др. (июнь 2016 г.). «Улучшение аннотации референтных генов GENCODE с использованием высокострогого рабочего процесса протеогеномики». Nature Communications . 7 : 11778. Bibcode :2016NatCo...711778W. doi :10.1038/ncomms11778. PMC 4895710 . PMID 27250503.
- ^ Dierick HA, Mercer JF, Glover TW (октябрь 1997 г.). "Псевдоген мозговой изоформы фосфоглицератмутазы (PGAM 1) локализован в гене болезни Менкеса человека (ATP7 A)". Gene . 198 (1–2): 37–41. doi :10.1016/s0378-1119(97)00289-8. PMID 9370262.
- ^ Betrán E, Wang W, Jin L, Long M (май 2002 г.). «Эволюция гена, обработанного фосфоглицератмутазой, у человека и шимпанзе, раскрывающая происхождение нового гена приматов». Молекулярная биология и эволюция . 19 (5): 654–663. doi : 10.1093/oxfordjournals.molbev.a004124 . PMID 11961099.
- ^ Окуда Х., Цудзимура А., Ирие С., Ямамото К., Фукухара С., Мацуока И. и др. (2012). «Полиморфизм одного нуклеотида в новом сцепленном с полом тестикулярно-специфическом ретротранспонированном гене PGAM4 влияет на мужскую фертильность человека». PLOS ONE . 7 (5): e35195. Bibcode :2012PLoSO...735195O. doi : 10.1371/journal.pone.0035195 . PMC 3348931 . PMID 22590500.
- ^ Белинки Ф., Гангули И., Поляков Е., Юрченко В., Рогозин ИБ. (февраль 2021 г.). «Анализ стоп-кодонов в генах, кодирующих прокариотические белки, предполагает частые события считывания». Международный журнал молекулярных наук . 22 (4): 1876. doi : 10.3390/ijms22041876 . PMC 7918605. PMID 33672790.
- ^ Feng Y, Wang Z, Chien KY, Chen HL, Liang YH, Hua X, Chiu CH (май 2022 г.). «Псевдопсевдогены в бактериальных геномах: протеогеномика выявляет широкую, но низкую экспрессию белка псевдогенов в Salmonella enterica». Nucleic Acids Research . 50 (9): 5158–5170. doi : 10.1093/nar/gkac302 . PMC 9122581. PMID 35489061 .
- ^ Чан ВЛ, Чан ДЖГ (2014). "Эндогенные siRNA, полученные из псевдогенов, и их функция". Псевдогены . Методы в молекулярной биологии. Т. 1167. С. 227–39. doi :10.1007/978-1-4939-0835-6_15. ISBN 978-1-4939-0834-9. PMID 24823781.
- ^ Chan WL, Yuo CY, Yang WK, Hung SY, Chang YS, Chiu CC и др. (апрель 2013 г.). «Транскрибированный псевдоген ψPPM1K генерирует эндогенную siRNA для подавления онкогенного роста клеток при гепатоцеллюлярной карциноме». Nucleic Acids Research . 41 (6): 3734–3747. doi :10.1093/nar/gkt047. PMC 3616710. PMID 23376929 .
- ^ Roberts TC, Morris KV (декабрь 2013 г.). «Больше не псевдо: псевдогены как терапевтические мишени». Pharmacogenomics . 14 (16): 2023–2034. doi :10.2217/pgs.13.172. PMC 4068744 . PMID 24279857.
- ^ Оловников И, Ле Томас А, Аравин АА (2014). "Структура для манипуляции кластерами piRNA". PIWI-взаимодействующие РНК . Методы в молекулярной биологии. Т. 1093. С. 47–58. doi :10.1007/978-1-62703-694-8_5. ISBN 978-1-62703-693-1. PMID 24178556.
- ^ Siomi MC, Sato K, Pezic D, Aravin AA (апрель 2011 г.). «PIWI-взаимодействующие малые РНК: авангард защиты генома». Nature Reviews. Молекулярная клеточная биология . 12 (4): 246–258. doi :10.1038/nrm3089. PMID 21427766. S2CID 5710813.
- ^ Каррет Ф.А., Решке М., Руокко А., Нг С., Чапуи Б., Леопольд В. и др. (апрель 2015 г.). «Псевдоген BRAF действует как конкурентная эндогенная РНК и индуцирует лимфому in vivo». Клетка . 161 (2): 319–332. дои : 10.1016/j.cell.2015.02.043. ПМК 6922011 . ПМИД 25843629.
- ^ Dahia PL, FitzGerald MG, Zhang X, Marsh DJ, Zheng Z, Pietsch T и др. (май 1998 г.). «Высококонсервативный обработанный псевдоген PTEN расположен на участке хромосомы 9p21». Oncogene . 16 (18): 2403–2406. doi : 10.1038/sj.onc.1201762 . PMID 9620558.
- ^ Poliseno L, Salmena L, Zhang J, Carver B, Haveman WJ, Pandolfi PP (июнь 2010 г.). «Независимая от кодирования функция мРНК генов и псевдогенов регулирует биологию опухолей». Nature . 465 (7301): 1033–1038. Bibcode :2010Natur.465.1033P. doi :10.1038/nature09144. PMC 3206313 . PMID 20577206.
- ^ Балакирев ES, Ayala FJ (2003). «Псевдогены: являются ли они «мусорной» или функциональной ДНК?». Annual Review of Genetics . 37 : 123–151. doi :10.1146/annurev.genet.37.040103.103949. PMID 14616058.
- ^ Goodhead I, Darby AC (февраль 2015 г.). «Извлечение псевдо из псевдогенов» (PDF) . Current Opinion in Microbiology . 23 : 102–109. doi : 10.1016/j.mib.2014.11.012. PMID 25461580.
- ^ abc Dagan T, Blekhman R, Graur D (февраль 2006 г.). «Теория «домино» смерти генов: события постепенного и массового вымирания генов в трех линиях облигатных симбиотических бактериальных патогенов». Молекулярная биология и эволюция . 23 (2): 310–316. doi : 10.1093/molbev/msj036 . PMID 16237210.
- ^ Malhotra S, Vedithi SC, Blundell TL (август 2017 г.). «Расшифровка сходств и различий между видами микобактерий». PLOS Neglected Tropical Diseases . 11 (8): e0005883. doi : 10.1371/journal.pntd.0005883 . PMC 5595346. PMID 28854187 .
- ^ ab Lopera J, Miller IJ, McPhail KL, Kwan JC (21 ноября 2017 г.). «Увеличение дозы биосинтетического гена в защитном бактериальном симбионте с уменьшенным геномом». mSystems . 2 (6): 1–18. doi :10.1128/msystems.00096-17. PMC 5698493 . PMID 29181447.
- ^ Cole ST, Eiglmeier K, Parkhill J, James KD, Thomson NR, Wheeler PR и др. (февраль 2001 г.). «Массовый распад генов в лепрозной палочке». Nature . 409 (6823): 1007–1011. Bibcode :2001Natur.409.1007C. doi :10.1038/35059006. PMID 11234002. S2CID 4307207.
Дальнейшее чтение
- Gerstein M, Zheng D (август 2006). «Настоящая жизнь псевдогенов». Scientific American . 295 (2): 48–55. Bibcode : 2006SciAm.295b..48G. doi : 10.1038/scientificamerican0806-48. PMID 16866288.
- Torrents D, Suyama M, Zdobnov E, Bork P (декабрь 2003 г.). «Обзор человеческих псевдогенов по всему геному». Genome Research . 13 (12): 2559–2567. doi :10.1101/gr.1455503. PMC 403797 . PMID 14656963.
- Bischof JM, Chiang AP, Scheetz TE, Stone EM, Casavant TL, Sheffield VC, Braun TA (июнь 2006 г.). «Идентификация псевдогенов, способных вызывать генную конверсию, на уровне генома». Human Mutation . 27 (6): 545–552. doi : 10.1002/humu.20335 . PMID 16671097. S2CID 20219423.
- Syberg-Olsen MJ, Garber AI, Keeling PJ, McCutcheon JP, Husnik F (июль 2022 г.). «Pseudofinder: обнаружение псевдогенов в прокариотических геномах». Молекулярная биология и эволюция . 39 (7). doi : 10.1093/molbev/msac153. PMC 9336565. PMID 35801562 .
Внешние ссылки
- База данных взаимодействия псевдогенов, база данных карт взаимодействия miRNA-псевдоген и белок-псевдоген
- База данных псевдогенов Йельского университета
- База данных Hoppsigen (гомологично обработанные псевдогены)
- RCPedia - Обработанная база данных псевдогенов
