УТФ — глюкозо-1-фосфат уридилилтрансфераза
| УТФ — глюкозо-1-фосфат уридилилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Человеческий UTP — глюкозо-1-фосфат уридилилтрансфераза, мультфильм, созданный в pymol | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.7.7.9 | ||||||||
| Номер CAS | 9026-22-6 | ||||||||
| Базы данных | |||||||||
| ИнтЭнз | IntEnz вид | ||||||||
| БРЕНДА | запись BRENDA | ||||||||
| ExPASy | NiceZyme вид | ||||||||
| КЕГГ | запись KEGG | ||||||||
| МетаЦик | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
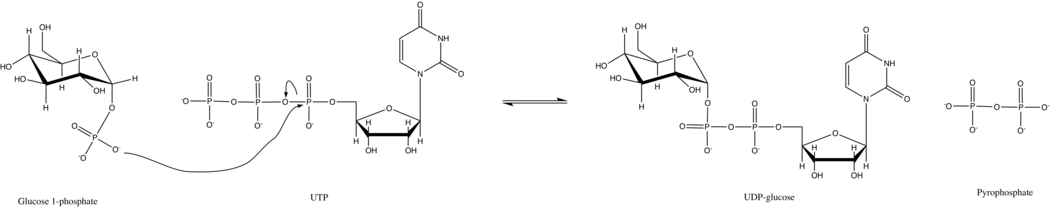
УТФ — глюкозо-1-фосфат уридилилтрансфераза, также известная как глюкозо-1-фосфат уридилилтрансфераза (или УДФ–глюкозопирофосфорилаза ) — фермент, участвующий в углеводном обмене . Он синтезирует УДФ-глюкозу из глюкозо-1-фосфата и УТФ ; т.е.
UTP — глюкозо-1-фосфат уридилилтрансфераза — это фермент, обнаруженный во всех трех доменах ( бактерии , эукариоты и археи ), поскольку он играет ключевую роль в гликогенезе и синтезе клеточной стенки . Его роль в метаболизме сахара была тщательно изучена на растениях с целью понимания роста растений и увеличения сельскохозяйственного производства. Недавно была изучена и кристаллизована человеческая UTP — глюкозо-1-фосфат уридилилтрансфераза, что выявило другой тип регуляции, чем у других ранее изученных организмов. Его значение вытекает из многочисленных применений UDP-глюкозы, включая метаболизм галактозы , синтез гликогена , синтез гликопротеина и синтез гликолипидов . [1] [2]
Структура
Структура UTP — глюкозо-1-фосфат уридилилтрансферазы существенно различается у прокариот и эукариот , но у эукариот первичная, вторичная и третичная структуры фермента довольно консервативны. [3] У многих видов UTP — глюкозо-1-фосфат уридилилтрансфераза встречается в виде гомополимера, состоящего из идентичных субъединиц в симметричной четвертичной структуре. [4] [5] Количество субъединиц варьируется в зависимости от вида: например, у Escherichia coli фермент встречается в виде тетрамера, тогда как у Burkholderia xenovorans фермент является димерным. [5] [6] У людей и дрожжей фермент активен в виде октамера, состоящего из двух тетрамеров, уложенных друг на друга, с консервативными гидрофобными остатками на границах между субъединицами. [7] [8] Напротив, фермент в растениях имеет сохраненные заряженные остатки, образующие интерфейс между субъединицами.
У людей каждая субъединица фермента содержит несколько остатков (L113, N251 и N328), которые высококонсервативны у эукариот. Мотив складки Россмана участвует в связывании нуклеотида UTP , а домен связывания сахара (остатки T286–G293) координируется с кольцом глюкозы. [9] Миссенс -мутация (G115D) в области фермента, содержащей активный сайт (который консервативен у эукариот), вызывает резкое снижение ферментативной активности in vitro. [10]
- Кристаллическая структура UTP—глюкозо-1-фосфатуридилилтрансферазы из Burkholderia xenovorans
- Человеческая UTP — глюкозо-1-фосфат уридилилтрансфераза изоформа 1 субъединица со связанной UDP-глюкозой
Примеры
Гены человека, кодирующие белки с активностью уридилилтрансферазы УТФ-глюкозо-1-фосфата, включают две изоформы с молекулярными массами 56,9 и 55,7 кДа соответственно. [11]
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||
Функция
UTP — глюкозо-1-фосфат уридилилтрансфераза повсеместно распространена в природе из-за ее важной роли в образовании UDP-глюкозы , центрального соединения в метаболизме углеводов. В листьях растений UTP — глюкозо-1-фосфат уридилилтрансфераза является ключевой частью пути биосинтеза сахарозы , поставляя уридиндифосфатглюкозу в сахарозо-фосфатсинтазу , которая преобразует UDP-глюкозу и D- фруктозо-6-фосфат в сахарозо-6-фосфат. [12] Она также может частично отвечать за расщепление сахарозы в других тканях с использованием UDP-глюкозы.
У высших животных фермент высокоактивен в тканях, участвующих в гликогенезе , включая печень и мышцы . [13] Исключением является мозг , в котором высокий уровень гликогена , но низкая удельная активность УТФ — глюкозо-1-фосфат уридилилтрансферазы. [14] В клетках животных УТФ — глюкозо-1-фосфат уридилилтрансфераза обнаруживается преимущественно в цитоплазме.
УТФ — глюкозо-1-фосфат уридилилтрансфераза также необходима для метаболизма галактозы у животных и микроорганизмов. В метаболизме галактозы фермент галактозо-1-фосфат уридилилтрансфераза переносит фосфат из УДФ-глюкозы в галактозо-1-фосфат для получения УДФ-галактозы, которая затем преобразуется в УДФ-глюкозу. [15] Бактерии с дефектной УТФ — глюкозо-1-фосфат уридилилтрансферазой не способны включать галактозу в свои клеточные стенки. [16]
Механизм
В первичной реакции этого фермента фосфатная группа на глюкозо-1-фосфате заменяет фосфоангидридную связь на UTP. Эта реакция легко обратима, и свободная энергия Гиббса близка к нулю. Однако в типичных клеточных условиях неорганическая пирофосфатаза быстро гидролизует пирофосфатный продукт и продвигает реакцию вперед по принципу Ле Шателье .
УТФ — глюкозо-1-фосфатуридилилтрансфераза использует упорядоченный последовательный механизм Bi Bi как для прямой, так и для обратной реакции. [17] У дрожжей фермент следует простой кинетике Михаэлиса-Ментен и не проявляет кооперативности между субъединицами в октамере. [8]
Подобно другим сахарным нуклеотидилтрансферазам , активность уридилилтрансферазы UTP-глюкозо-1-фосфат требует двух двухвалентных катионов для стабилизации связывания отрицательно заряженных фосфатных групп. [18] Обычно в этой роли выступает магний , но другие ионы, такие как марганец (II), кобальт (II) и никель (II), также могут замещать его с ~75% снижением оптимальной активности. [19] Эксперименты по рентгеновской кристаллографии показали, что один ион Mg2 + координируется фосфорильным кислородом на глюкозо-1-фосфате и α-фосфорильным кислородом на UTP. [5] В дополнение к стабилизации отрицательно заряженных фосфатов, Mg2 +, как полагают, ориентирует глюкозо-1-фосфат для нуклеофильной атаки α-фосфора UTP. [20]
Регулирование
Несмотря на функциональное сходство у разных видов, УДФ-глюкозопирофосфорилаза имеет разные структуры и механизмы регуляции у разных организмов.
Микроорганизмы
У дрожжей УТФ — глюкозо-1-фосфат уридилилтрансфераза регулируется фосфорилированием PAS-киназой . [21] Это фосфорилирование обратимо и контролирует распределение потока сахара в сторону синтеза гликогена и клеточной стенки.
Растения
УТФ — глюкозо-1-фосфат уридилилтрансфераза в растениях регулируется посредством олигомеризации и, возможно, фосфорилирования . [22] В ячмене было показано, что УДФ-глюкозопирофосфорилаза активна только в мономерной форме, но легко образует олигомеры , что предполагает, что олигомеризация может быть формой регуляции фермента. В рисе холодовой стресс снижает N- гликозилирование фермента, что, как полагают, изменяет активность фермента в ответ на холод. [23]
В Arabidopsis есть два изофермента UTP — глюкозо-1-фосфат уридилилтрансферазы: UGP1 и UGP2. [24] Эти два изофермента имеют почти идентичную активность и отличаются только 32 аминокислотами, все из которых расположены на внешней поверхности белка вдали от активного центра. Эти незначительные различия могут позволить дифференциальную аллостерическую регуляцию активности изоферментов. UGP1 и UGP2 дифференциально экспрессируются в разных частях растения. Экспрессия UGP1 широко экспрессируется в большинстве тканей, в то время как UGP2 экспрессируется в основном в цветах, что предполагает, что UGP1 является основной формой фермента, а UGP2 выполняет вспомогательную функцию. Действительно, экспрессия UGP2 увеличивается в ответ на стрессоры, такие как дефицит фосфата, что указывает на то, что UGP2, вероятно, функционирует как резервная копия UGP1, когда растение находится в условиях экологического стресса.
Животные
Контроль активности UTP—глюкозо-1-фосфат уридилилтрансферазы в первую очередь достигается генетическими средствами (т. е. регуляцией транскрипции и трансляции ). Подобно большинству ферментов, UTP—глюкозо-1-фосфат уридилилтрансфераза ингибируется своим продуктом, UDP-глюкозой. Однако фермент не подвергается значительной аллостерической регуляции , что логично, учитывая широкое использование UDP-глюкозы в различных метаболических путях.
Люди
У людей UDP-глюкозопирофосфорилаза активна в виде октамера. [7] Активность фермента также изменяется при O- гликозилировании . [25] Подобно другим видам млекопитающих, у людей существуют две различные изоформы, которые производятся путем альтернативного сплайсинга гена. [3] [11] [26] Изоформы отличаются только 11 аминокислотами на N-конце, и существенных различий в их функциональной активности не выявлено.
Актуальность заболевания
У людей галактоземия — это расстройство, которое влияет на развитие новорожденных и детей, поскольку они не могут правильно метаболизировать сахар галактозу . Предполагается, что повышенная экспрессия UDP-глюкозопирофосфорилазы может облегчить симптомы у людей с галактоземией. [27]
В раковых клетках, которые обычно имеют высокие показатели гликолиза и сниженное содержание гликогена , активность УТФ — глюкозо-1-фосфат уридилилтрансферазы часто снижается на 50-60% по сравнению с нормальными клетками. [28] Аномально низкая активность УТФ — глюкозо-1-фосфат уридилилтрансферазы обусловлена снижением уровня фермента и снижением активности других ферментов в гликогенном пути, включая гликогенсинтазу и фосфоглюкомутазу .
Было обнаружено, что UTP — глюкозо-1-фосфат уридилилтрансфераза является важным фактором вирулентности у различных патогенов, включая бактерии и простейшие. [29] [30] Например, было обнаружено, что фермент необходим для биосинтеза капсульного полисахарида, важного фактора вирулентности Streptococcus pneumoniae , бактериальной причины пневмонии, бронхита и других проблем с дыханием. [31] В результате фермент привлек внимание как потенциальная цель для фармацевтических препаратов. Однако для достижения специфичности препараты должны быть разработаны так, чтобы специально нацеливаться на аллостерические сайты на поверхности белка, поскольку активный сайт высококонсервативен у разных видов. [3]
Недавно было обнаружено, что UDP-глюкозопирофосфорилаза ( UGP2 ) участвует в новом нейроразвивающем расстройстве у людей, известном как [32], также называемом синдромом Бараката-Перенталера . [33] Это расстройство было впервые описано у 22 человек из 15 семей, проявляясь тяжелой эпилептической энцефалопатией, задержкой нейроразвития с отсутствием практически всех этапов развития, трудноизлечимыми припадками, прогрессирующей микроцефалией, нарушением зрения и аналогичными незначительными дисморфизмами. Баракат и коллеги выявили повторяющуюся гомозиготную мутацию у всех затронутых людей (chr2:64083454A > G), которая мутирует в месте начала трансляции более короткой изоформы белка UGP2. Следовательно, более короткая изоформа белка больше не может вырабатываться у пациентов, имеющих гомозиготную мутацию. Функциональные исследования той же группы показали, что короткая изоформа белка обычно преимущественно экспрессируется в мозге человека. Таким образом, повторяющаяся мутация приводит к тканеспецифическому отсутствию UGP2 в мозге, что приводит к изменению метаболизма гликогена, повышенной регуляции реакции развернутого белка и преждевременной нейронной дифференцировке. Другие биаллельные мутации потери функции в UGP2, вероятно, летальны, поскольку человеческие эмбриональные стволовые клетки, истощенные как короткими, так и длинными изоформами UGP2, не могут дифференцироваться в кардиомиоциты и клетки крови. Таким образом, идентификация этого нового заболевания также показывает, что специфичные для изоформ мутации start-loss, вызывающие потерю экспрессии тканерелевантной изоформы необходимого белка, могут вызывать генетическое заболевание, даже когда отсутствие белка во всем организме несовместимо с жизнью. Терапии синдрома Бараката-Перенталера в настоящее время не существует.
Ссылки
- ^ Sandhoff K, van Echten G, Schröder M, Schnabel D, Suzuki K (август 1992). «Метаболизм гликолипидов: роль гликолипид-связывающих белков в функции и патобиохимии лизосом». Biochemical Society Transactions . 20 (3): 695–9. doi :10.1042/bst0200695. PMID 1426613.
- ^ Alonso MD, Lomako J, Lomako WM, Whelan WJ (сентябрь 1995 г.). «Новый взгляд на биогенез гликогена». FASEB Journal . 9 (12): 1126–37. doi : 10.1096/fasebj.9.12.7672505 . PMID 7672505. S2CID 40281321.
- ^ abc Führing JI, Cramer JT, Schneider J, Baruch P, Gerardy-Schahn R, Fedorov R (апрель 2015 г.). "Четвертичный механизм обеспечивает сложные биологические функции октамерной человеческой UDP-глюкозопирофосфорилазы, ключевого фермента в клеточном метаболизме". Scientific Reports . 5 (1): 9618. Bibcode :2015NatSR...5E9618F. doi :10.1038/srep09618. PMC 5381698 . PMID 25860585.
- ^ Kim H, Choi J, Kim T, Lokanath NK, Ha SC, Suh SW, Hwang HY, Kim KK (апрель 2010 г.). «Структурная основа механизма реакции UDP-глюкозопирофосфорилазы». Molecules and Cells . 29 (4): 397–405. doi : 10.1007/s10059-010-0047-6 . PMID 20238176. S2CID 25022544.
- ^ abc Thoden JB, Holden HM (июль 2007 г.). «Геометрия активного центра глюкозо-1-фосфат уридилилтрансферазы». Protein Science . 16 (7): 1379–88. doi :10.1110/ps.072864707. PMC 2206702 . PMID 17567737.
- ^ Болезнь, Сиэтлский центр структурной геномики инфекционных заболеваний (2016). "Кристаллическая структура UDP-глюкозопирофосфорилазы / UTP-глюкозо-1-фосфат уридилилтрансферазы из Burkholderia xenovorans". Всемирный банк данных белков . doi :10.2210/pdb5j49/pdb.
- ^ ab Yu Q, Zheng X (март 2012 г.). «Кристаллическая структура человеческой UDP-глюкозопирофосфорилазы выявляет эффект защелки, который влияет на ферментативную активность». Биохимический журнал . 442 (2): 283–91. doi :10.1042/BJ20111598. PMID 22132858.
- ^ ab Roeben A, Plitzko JM, Körner R, Böttcher UM, Siegers K, Hayer-Hartl M, Bracher A (декабрь 2006 г.). "Структурная основа сборки субъединиц в UDP-глюкозопирофосфорилазе из Saccharomyces cerevisiae". Журнал молекулярной биологии . 364 (4): 551–60. doi :10.1016/j.jmb.2006.08.079. PMID 17010990.
- ^ Kleczkowski LA, Geisler M, Fitzek E, Wilczynska M (ноябрь 2011 г.). «Общая структурная схема для пирофосфорилаз, продуцирующих UDP-сахар в растениях». The Biochemical Journal . 439 (3): 375–9. doi :10.1042/BJ20110730. PMID 21992098.
- ^ Flores-Díaz M, Alape-Girón A, Persson B, Pollesello P, Moos M, von Eichel-Streiber C, Thelestam M, Florin I (сентябрь 1997 г.). «Клеточный дефицит UDP-глюкозы, вызванный единичной точечной мутацией в гене UDP-глюкозопирофосфорилазы». Журнал биологической химии . 272 (38): 23784–91. doi : 10.1074/jbc.272.38.23784 . PMID 9295324.
- ^ ab "UGP2 - UTP--глюкозо-1-фосфат уридилилтрансфераза - Homo sapiens (человек) - ген и белок UGP2". www.uniprot.org . Получено 2017-03-06 .
- ^ Mendicino J (декабрь 1960 г.). «Синтез фосфата сахарозы в зародышах пшеницы и зеленых листьях». Журнал биологической химии . 235 (12): 3347–52. doi : 10.1016/S0021-9258(18)64469-2 . PMID 13769376.
- ^ Turnquist, Richard L.; Hansen, R. Gaurth (1973-01-01). "2-Уридиндифосфорилглюкозопирофосфорилаза". В Boyer, Paul D. (ред.). Ферменты . Перенос группы, часть A: перенос нуклеотидов, перенос нуклеозидилов, перенос ацилов, перенос фосфорилов. Том 8. Academic Press. стр. 51–71. doi :10.1016/S1874-6047(08)60062-1. ISBN 9780121227081.
- ^ Villar-Palasi C, Larner J (март 1960). «Влияние инсулина на активность UDPG-гликогентрансглюкозилазы мышц». Biochimica et Biophysica Acta . 39 : 171–3. doi :10.1016/0006-3002(60)90142-6. PMID 13842294.
- ^ Bosch AM (август 2006 г.). «Классическая галактоземия снова в моде». Журнал наследственных метаболических заболеваний . 29 (4): 516–25. doi :10.1007/s10545-006-0382-0. PMID 16838075. S2CID 16382462.
- ^ Sundararajan TA, Rapin AM, Kalckar HM (декабрь 1962 г.). «Биохимические наблюдения за мутантами E. coli, дефектными по уридиндифосфоглюкозе». Труды Национальной академии наук Соединенных Штатов Америки . 48 (12): 2187–93. Bibcode :1962PNAS...48.2187S. doi : 10.1073/pnas.48.12.2187 . PMC 221142 . PMID 13979281.
- ^ Tsuboi KK, Fukunaga K, Petricciani JC (февраль 1969). «Очистка и специфические кинетические свойства эритроцитарной уридиндифосфатглюкозопирофосфорилазы». Журнал биологической химии . 244 (3): 1008–15. doi : 10.1016/S0021-9258(18)91886-7 . PMID 5782905.
- ^ Zea CJ, Camci-Unal G, Pohl NL (июль 2008 г.). «Термодинамика связывания двухвалентного магния и марганца с фосфатами уридина: последствия для диабетической гипомагниемии и биокатализа углеводов». Chemistry Central Journal . 2 (1): 15. doi : 10.1186/1752-153x-2-15 . PMC 2490692. PMID 18627619 .
- ^ Gustafson GL, Gander JE (март 1972). "Уридиндифосфатглюкозопирофосфорилаза из Sorghum vulgare. Очистка и кинетические свойства". Журнал биологической химии . 247 (5): 1387–97. doi : 10.1016/S0021-9258(19)45571-3 . PMID 5012314.
- ^ Sivaraman J, Sauvé V, Matte A, Cygler M (ноябрь 2002 г.). «Кристаллическая структура глюкозо-1-фосфат тимидилтрансферазы Escherichia coli (RffH) в комплексе с dTTP и Mg2+». Журнал биологической химии . 277 (46): 44214–9. doi : 10.1074/jbc.M206932200 . PMID 12171937.
- ^ Rutter J, Probst BL, McKnight SL (октябрь 2002 г.). «Координированная регуляция потока сахара и трансляции киназой PAS». Cell . 111 (1): 17–28. doi : 10.1016/s0092-8674(02)00974-1 . PMID 12372297. S2CID 6883785.
- ^ Kleczkowski LA, Geisler M, Ciereszko I, Johansson H (март 2004 г.). «UDP-глюкозопирофосфорилаза. Старый белок с новыми трюками». Plant Physiology . 134 (3): 912–8. doi : 10.1104/pp.103.036053. PMC 523891. PMID 15020755.
- ^ Комацу С., Ямада Э., Фурукава К. (январь 2009 г.). «Холодный стресс изменяет конканавалин А-положительный паттерн гликозилирования белков, экспрессируемых в базальных частях влагалищ листьев риса». Аминокислоты . 36 (1): 115–23. doi :10.1007/s00726-008-0039-4. PMID 18278531. S2CID 1797342.
- ^ Meng M, Geisler M, Johansson H, Harholt J, Scheller HV, Mellerowicz EJ, Kleczkowski LA (май 2009). «UDP-глюкозопирофосфорилаза не является ограничивающей скорость, но необходима в Arabidopsis». Plant & Cell Physiology . 50 (5): 998–1011. doi : 10.1093/pcp/pcp052 . PMID 19366709.
- ^ Уэллс, Лэнс; Харт, Джеральд В. (2003-07-03). «O-GlcNAc исполняется двадцать: функциональные последствия для посттрансляционной модификации ядерных и цитозольных белков с сахаром». FEBS Letters . 546 (1): 154–158. doi : 10.1016/S0014-5793(03)00641-0 . ISSN 1873-3468. PMID 12829252. S2CID 24587552.
- ^ Duggleby RG, Chao YC, Huang JG, Peng HL, Chang HY (январь 1996 г.). «Различия в последовательностях между кДНК мышц и печени человека для UDP-глюкозопирофосфорилазы и кинетические свойства рекомбинантных ферментов, экспрессируемых в Escherichia coli». European Journal of Biochemistry . 235 (1–2): 173–9. doi :10.1111/j.1432-1033.1996.00173.x. PMID 8631325.
- ^ Lai K, Elsas LJ (май 2000). «Сверхэкспрессия человеческой UDP-глюкозопирофосфорилазы спасает дрожжи с дефицитом галактозо-1-фосфатуридилтрансферазы». Biochemical and Biophysical Research Communications . 271 (2): 392–400. doi :10.1006/bbrc.2000.2629. PMID 10799308.
- ^ Nigam VN, Macdonald HL, Cantero A (февраль 1962). «Ограничивающие факторы для хранения гликогена в опухолях. I. Ограничивающие ферменты». Cancer Research . 22 (2): 131–8. PMID 14479721.
- ^ Jiang SS, Lin TY, Wang WB, Liu MC, Hsueh PR, Liaw SJ (май 2010 г.). «Характеристика мутантов UDP-глюкозодегидрогеназы и UDP-глюкозопирофосфорилазы Proteus mirabilis: дефектность устойчивости к полимиксину B, роение и вирулентность». Antimicrobial Agents and Chemotherapy . 54 (5): 2000–9. doi :10.1128/AAC.01384-09. PMC 2863647 . PMID 20160049.
- ^ Klein KA, Fukuto HS, Pelletier M, Romanov G, Grabenstein JP, Palmer LE, Ernst R, Bliska JB (февраль 2012 г.). «Скрининг гибридизации транспозонных участков выявляет galU и wecBC как важные для выживания Yersinia pestis в макрофагах мышей». Журнал бактериологии . 194 (3): 653–62. doi :10.1128/JB.06237-11. PMC 3264090. PMID 22139502 .
- ^ Bonofiglio L, García E, Mollerach M (октябрь 2005 г.). «Биохимическая характеристика пневмококковой глюкозо-1-фосфат уридилилтрансферазы (GalU), необходимой для биосинтеза капсулы». Current Microbiology . 51 (4): 217–21. doi :10.1007/s00284-005-4466-0. PMID 16132460. S2CID 13591083.
- ^ Perenthaler E, Nikoncuk A, Yousefi S, Berdowski WM, Alsagob M, Capo I и др. (март 2020 г.). «Потеря UGP2 в мозге приводит к тяжелой эпилептической энцефалопатии, подчеркивая, что биаллельные изоформ-специфические мутации start-loss основных генов могут вызывать генетические заболевания». Acta Neuropathologica . 139 (3): 415–442. doi :10.1007/s00401-019-02109-6. PMC 7035241 . PMID 31820119.
- ^ "#618744: Эпилептическая энцефалопатия, ранняя детская 83; EIEE83". Онлайн Менделевское наследование у человека (OMIM) .
Внешние ссылки
- UDP+Глюкоза+Пирофосфорилаза в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)




