Гамма-секретаза
| Гамма-секретаза (субъединица никастрина) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
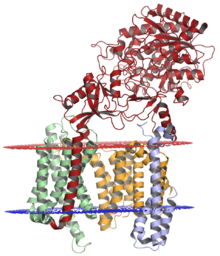 Комплекс гамма-секретазы с никастрином (красный), пресенилином-1 (оранжевый), PEN-2 (синий) и APH-1 (зеленый); люменальная мембрана показана красным, а цитоплазматическая мембрана показана синим. Структура была решена с помощью криоэлектронной микроскопии . [1] | |||||||||
| Идентификаторы | |||||||||
| Символ | Гамма-секретаза, γ-секретаза | ||||||||
| Пфам | ПФ05450 | ||||||||
| ИнтерПро | IPR008710 | ||||||||
| суперсемейство OPM | 244 | ||||||||
| белок ОПМ | [ 5фн5[ | ||||||||
| Мембраном | 155 | ||||||||
| |||||||||
Гамма-секретаза — это многосубъединичный протеазный комплекс, интегральный мембранный белок , который расщепляет однопроходные трансмембранные белки по остаткам внутри трансмембранного домена. Протеазы этого типа известны как внутримембранные протеазы . Наиболее известным субстратом гамма-секретазы является белок-предшественник амилоида , большой интегральный мембранный белок, который при расщеплении как гамма-, так и бета-секретазой образует короткий пептид из 37-43 [ требуется проверка ] аминокислот, называемый бета-амилоидом , чья аномально свернутая фибриллярная форма является основным компонентом амилоидных бляшек, обнаруженных в мозге пациентов с болезнью Альцгеймера . Гамма-секретаза также имеет решающее значение в связанной обработке нескольких других интегральных мембранных белков типа I, таких как Notch , [2] ErbB4 , [3] E-кадгерин , [4] N-кадгерин , [5] эфрин-B2 , [6] или CD44 . [7]
Субъединицы и сборки
Комплекс гамма-секретазы состоит из четырех отдельных белков: PSEN1 (пресенилин-1), [8] никастрин , APH-1 (дефект передней части глотки 1) и PEN-2 (усилитель пресенилина 2). [9] Последние данные свидетельствуют о том, что пятый белок, известный как CD147 , является необязательным регулятором комплекса, отсутствие которого увеличивает активность. [10] [11] Пресенилин , аспартилпротеаза , является каталитической субъединицей; мутации в гене пресенилина являются основным генетическим фактором риска болезни Альцгеймера [12] и модулируют активность иммунных клеток. [13] У людей в геноме были идентифицированы две формы пресенилина и две формы APH-1 ; один из гомологов APH также может быть выражен в двух изоформах посредством альтернативного сплайсинга , что приводит к образованию по меньшей мере шести различных возможных комплексов гамма-секретазы, которые могут иметь специфичность к типу ткани или клетки. [14]
Белки в комплексе гамма-секретазы сильно модифицируются протеолизом во время сборки и созревания комплекса; требуемый этап активации заключается в автокаталитическом расщеплении пресенилина на N- и C-концевые фрагменты. Основная роль никастрина заключается в поддержании стабильности собранного комплекса и регулировании внутриклеточного перемещения белков. [15] PEN-2 ассоциируется с комплексом посредством связывания трансмембранного домена пресенилина [16] и, среди других возможных ролей, помогает стабилизировать комплекс после того, как протеолиз пресенилина сгенерировал активированные N-концевые и C-концевые фрагменты. [17] APH-1, который необходим для протеолитической активности, связывается с комплексом посредством консервативного мотива взаимодействия альфа-спирали и помогает инициировать сборку преждевременных компонентов. [18]
Недавние исследования показали, что взаимодействие комплекса гамма-секретазы с белком, активирующим γ-секретазу, облегчает гамма-расщепление белка-предшественника амилоида в β-амилоид . [19]
Сотовый трафик
Предполагается, что комплекс гамма-секретазы собирается и созревает посредством протеолиза в раннем эндоплазматическом ретикулуме . [20] Затем комплексы транспортируются в поздний ЭР, где они взаимодействуют с субстратными белками и расщепляют их. [21] Комплексы гамма-секретазы также были обнаружены локализованными в митохондриях , где они могут играть роль в продвижении апоптоза . [22]
Функция
Гамма-секретаза — это внутренняя протеаза, которая расщепляет в мембрано-проникающем домене свои субстратные белки, включая белок-предшественник амилоида (APP) и Notch . Распознавание субстрата происходит посредством связывания эктодомена никастрина с N-концом мишени, который затем передается через плохо изученный процесс между двумя фрагментами пресенилина в содержащий воду активный центр , где находится каталитический остаток аспартата . Активный центр должен содержать воду для проведения гидролиза в гидрофобной среде внутри клеточной мембраны , хотя не совсем понятно, как осуществляется обмен водой и протонами , и пока еще нет рентгеновской кристаллографической структуры гамма-секретазы. [23] Реконструкции с помощью электронной микроскопии низкого разрешения позволили визуализировать предполагаемые внутренние поры размером около 2 нанометров. [24] В 2014 году трехмерная структура интактного комплекса гамма-секретазы человека была определена с помощью криоэлектронного микроскопического анализа отдельных частиц с разрешением 4,5 ангстрема [25] , а в 2015 году было сообщено о крио-ЭМ структуре с атомным разрешением (3,4 ангстрема). [1]
Гамма-секретазный комплекс необычен среди протеаз тем, что имеет «небрежный» сайт расщепления на С-концевом участке в образовании бета-амилоида ; гамма-секретаза может расщеплять APP в любом из нескольких участков, чтобы генерировать пептид переменной длины, чаще всего длиной от 39 до 42 аминокислот, причем Aβ40 является наиболее распространенной изоформой, а Aβ42 наиболее восприимчив к конформационным изменениям, ведущим к фибриллогенезу амилоида . Определенные мутации как в APP, так и в обоих типах человеческого пресенилина связаны с повышенной продукцией Aβ42 и ранней генетической формой семейной болезни Альцгеймера . [26] Хотя более старые данные предполагали, что различные формы комплекса гамма-секретазы могут быть по-разному ответственны за образование различных изоформ бета-амилоида, [27] современные данные указывают на то, что C-конец бета-амилоида образуется в результате серии расщеплений одного остатка одним и тем же комплексом гамма-секретазы. [28] [29] [30] Более ранние сайты расщепления производят пептиды длиной 46 (дзета-расщепление) и 49 (эпсилон-расщепление). [29]
Смотрите также
- DAPT (химический) , ингибитор γ-секретазы
- Нирогацестат , ингибитор γ-секретазы
- Семагацестат , ингибитор γ-секретазы
Ссылки
- ^ Аб Бай, Сяо-чен; Ян, Чуангье; Ян, Гуанхуэй; Лу, Пейлонг; Ма, Дэн; Сунь, Линьфэн; Чжоу, Руи; Шерес, Сьорс HW ; Ши, Игун (17 августа 2015 г.). «Атомная структура γ-секретазы человека». Природа . 525 (7568): 212–217. дои : 10.1038/nature14892. ПМЦ 4568306 . ПМИД 26280335.
- ^ Де Струпер Б, Аннаерт В, Куперс П, Сафтиг П, Краессертс К, Мумм Дж. С., Шретер Э. Х., Шрийверс В., Вулф М. С., Рэй В. Дж., Гоат А, Копан Р. (1999). «Пресенилин-1-зависимая гамма-секретазоподобная протеаза опосредует высвобождение внутриклеточного домена Notch». Природа . 398 (6727): 518–22. дои : 10.1038/19083. PMID 10206645. S2CID 4346474.
- ^ Ni CY, Murphy MP, Golde TE, Carpenter G (2001). «расщепление гамма-секретазы и ядерная локализация рецепторной тирозинкиназы ErbB-4». Science . 294 (5549): 2179–81. doi :10.1126/science.1065412. PMID 11679632. S2CID 23227013.
- ^ Марамбо П., Шиой Дж., Сербан Г., Георгакопулос А., Сарнер С., Надь В., Баки Л., Вен П., Эфтимиопулос С., Шао З., Вишневски Т., Робакис Н.К. (2002). «Расщепление пресенилин-1/гамма-секретазой высвобождает внутриклеточный домен E-кадгерина и регулирует разборку слипчивых соединений». ЭМБО Дж . 21 (8): 1948–56. дои : 10.1093/emboj/21.8.1948. ПМЦ 125968 . ПМИД 11953314.
- ^ Марамбо П., Вэнь П.Х., Датт А., Шиой Дж., Такашима А., Симан Р., Робакис Н.К. (2003). «Связывающий CBP репрессор транскрипции, продуцируемый PS1/эпсилон-расщеплением N-кадгерина, ингибируется мутациями PS1 FAD». Клетка . 114 (5): 635–45. дои : 10.1016/j.cell.2003.08.008 . PMID 13678586. S2CID 7265454.
- ^ Георгакопулос А, Литтерст С, Герси Е, Баки Л, Сюй С, Сербан Г, Робакис НК (2006). «Обработка ephrinB металлопротеиназой/пресенилином1 регулирует EphB-индуцированное фосфорилирование и передачу сигналов Src». ЭМБО Дж . 25 (6): 1242–52. дои : 10.1038/sj.emboj.7601031. ПМЦ 1422162 . ПМИД 16511561.
- ^ Lammich S, Okochi M, Takeda M, Kaether C, Capell A, Zimmer AK, Edbauer D, Walter J, Steiner H, Haass C (2002). «Пресенилин-зависимый внутримембранный протеолиз CD44 приводит к освобождению его внутриклеточного домена и секреции Abeta-подобного пептида». J Biol Chem . 277 (47): 44754–9. doi : 10.1074/jbc.M206872200 . PMID 12223485.
- ^ Sobhanifar, S; Schneider, B; Löhr, F; Gottstein, D; Ikeya, T; Mlynarczyk, K; Pulawski, W; Ghoshdastider, U; Kolinski, M; Filipek, S; Güntert, P; Bernhard, F; Dötsch, V (25 мая 2010 г.). "Структурное исследование C-концевого каталитического фрагмента пресенилина 1". Труды Национальной академии наук Соединенных Штатов Америки . 107 (21): 9644–9. doi : 10.1073/pnas.1000778107 . PMC 2906861. PMID 20445084 .
- ^ Kaether C, Haass C, Steiner H (2006). «Сборка, транспортировка и функция гамма-секретазы» (PDF) . Neurodegener Dis . 3 (4–5): 275–83. doi :10.1159/000095267. PMID 17047368. S2CID 17324271.
- ^ Zhou S, Zhou H, Walian PJ, Jap BK (апрель 2006 г.). «Открытие и роль CD147 как субъединицы комплекса гамма-секретазы». Drug News Perspect . 19 (3): 133–8. doi :10.1358/dnp.2006.19.3.985932. PMID 16804564.
- ^ Zhou S, Zhou H, Walian PJ, Jap BK (май 2005 г.). «CD147 является регуляторной субъединицей комплекса γ-секретазы при продукции β-амилоидного пептида при болезни Альцгеймера». Proc. Natl. Acad. Sci. USA . 102 (21): 7499–504. doi : 10.1073/pnas.0502768102 . PMC 1103709 . PMID 15890777.
- ^ Чен Ф, Хасегава Х, Шмитт-Ульмс Г, Кавараи Т, Бом С, Катаяма Т, Гу Ю, Сандзё Н, Глиста М, Рогаева Е, Вакутани Ю, Пардосси-Пикард Р, Руан Х, Тандон А, Чеклер Ф, Марамбо П., Хансен К., Вестэуэй Д., Сент-Джордж-Хислоп П., Фрейзер П. (апрель 2006 г.). «TMP21 представляет собой компонент комплекса пресенилина, который модулирует гамма-секретазу, но не активность эпсилон-секретазы». Природа . 440 (7088): 1208–12. дои : 10.1038/nature04667. PMID 16641999. S2CID 4349251.
- ^ Farfara D, Trudler D, Segev-Amzaled N, Galron R, Stein R, Frenkel D (ноябрь 2010 г.). "компонент g-секретазы пресенилин важен для очистки микроглии b-амилоида". Annals of Neurology . 69 (1): 170–80. doi :10.1002/ana.22191. PMID 21280087. S2CID 20603724.
- ^ Широтани К, Эдбауэр Д, Прокоп С, Хаас К, Штайнер Х (2004). «Идентификация отдельных комплексов гамма-секретазы с различными вариантами APH-1». J Biol Chem . 279 (40): 41340–5. doi : 10.1074/jbc.M405768200 . PMID 15286082.
- ^ Zhang YW, Luo WJ, Wang H, Lin P, Vetrivel KS, Liao F, Li F, Wong PC, Farquhar MG, Thinakaran G, Xu H (апрель 2005 г.). «Никастрин имеет решающее значение для стабильности и трафика, но не для ассоциации других компонентов пресенилина/γ-секретазы». J. Biol. Chem . 280 (17): 17020–6. doi : 10.1074/jbc.M409467200 . PMC 1201533. PMID 15711015 .
- ^ Watanabe N, Tomita T, Sato C, Kitamura T, Morohashi Y, Iwatsubo T (декабрь 2005 г.). «Pen-2 включается в комплекс гамма-секретазы посредством связывания с трансмембранным доменом 4 пресенилина 1». J. Biol. Chem . 280 (51): 41967–75. doi : 10.1074/jbc.M509066200 . PMID 16234244.
- ^ Prokop S, Shirotani K, Edbauer D, Haass C, Steiner H (май 2004 г.). «Необходимость PEN-2 для стабилизации гетеродимера N-/C-концевого фрагмента пресенилина в комплексе гамма-секретазы». J. Biol. Chem . 279 (22): 23255–61. doi : 10.1074/jbc.M401789200 . PMID 15039426.
- ^ Lee SF, Shah S, Yu C, Wigley WC, Li H, Lim M, Pedersen K, Han W, Thomas P, Lundkvist J, Hao YH, Yu G (февраль 2004 г.). «Консервативный мотив GXXXG в APH-1 имеет решающее значение для сборки и активности комплекса гамма-секретазы». J. Biol. Chem . 279 (6): 4144–52. doi : 10.1074/jbc.M309745200 . PMID 14627705.
- ^ He G, Luo W, Li P, Remmers C, Netzer WJ, Hendrick J, Bettayeb K, Flajolet M, Gorelick F, Wennogle LP, Greengard P (сентябрь 2010 г.). «Белок, активирующий гамма-секретазу, терапевтическая мишень для болезни Альцгеймера». Nature . 467 (2): 95–98. doi :10.1038/nature09325. PMC 2936959 . PMID 20811458.
- Джина Колата (1 сентября 2010 г.). «Открытие предлагает новую цель для лекарств от болезни Альцгеймера» . The New York Times .
- ^ Capell A, Beher D, Prokop S, Steiner H, Kaether C, Shearman MS, Haass C (февраль 2005 г.). «Сборка комплекса гамма-секретазы в раннем секреторном пути». J. Biol. Chem . 280 (8): 6471–8. doi : 10.1074/jbc.M409106200 . PMID 15591316.
- ^ Ким SH, Yin YI, Li YM, Sisodia SS (ноябрь 2004 г.). «Доказательства того, что сборка активного комплекса гамма-секретазы происходит в ранних компартментах секреторного пути». J. Biol. Chem . 279 (47): 48615–9. doi : 10.1074/jbc.C400396200 . PMID 15456788.
- ^ Ханссон Калифорния, Фрикман С., Фармери М.Р., Тьернберг Л.О., Нильсберт С., Персглов С.Е., Ито А., Винблад Б., Коуберн РФ, Тайберг Дж., Анкаркрона М. (декабрь 2004 г.). «Никастрин, пресенилин, АПН-1 и ПЕН-2 образуют активные комплексы гамма-секретазы в митохондриях». Ж. Биол. Хим . 279 (49): 51654–60. дои : 10.1074/jbc.M404500200 . ПМИД 15456764.
- ^ Wolfe MS (июль 2006 г.). «Комплекс гамма-секретазы: встроенный в мембрану протеолитический ансамбль». Биохимия . 45 (26): 7931–9. doi :10.1021/bi060799c. PMID 16800619.
- ^ Лазаров ВК, Фреринг ПЦ, Йе В, Вольфе М.С., Селко Д.Дж., Ли Х (май 2006). «Электронно-микроскопическая структура очищенной активной γ-секретазы выявляет водную внутримембранную камеру и две поры». Proc. Natl. Acad. Sci. USA . 103 (18): 6889–94. doi : 10.1073/pnas.0602321103 . PMC 1458989 . PMID 16636269.
- ^ Lu P, Bai XC, Ma D, Xie T, Yan C, Sun L, Yang G, Zhao Y, Zhou R, Scheres SH, Shi Y (август 2014 г.). «Трехмерная структура человеческой γ-секретазы». Nature . 512 (7513): 166–170. doi :10.1038/nature13567. PMC 4134323 . PMID 25043039.
- ^ Wiley JC, Hudson M, Kanning KC, Schecterson LC, Bothwell M (сентябрь 2005 г.). «Семейные мутации болезни Альцгеймера ингибируют опосредованное гамма-секретазой высвобождение карбоксиконцевого фрагмента белка-предшественника бета-амилоида». J. Neurochem . 94 (5): 1189–201. doi : 10.1111/j.1471-4159.2005.03266.x . PMID 15992373.
- ^ Jankowsky JL, Fadale DJ, Anderson J, Xu GM, Gonzales V, Jenkins NA, Copeland NG, Lee MK, Younkin LH, Wagner SL, Younkin SG, Borchelt DR (январь 2004 г.). «Мутантные пресенилины специфически повышают уровни 42-остаточного бета-амилоидного пептида in vivo: доказательства увеличения 42-специфической гамма-секретазы». Hum. Mol. Genet . 13 (2): 159–70. doi : 10.1093/hmg/ddh019 . PMID 14645205.
- ^ Zhao G, Tan J, Mao G, Cui MZ, Xu X (март 2007). «Та же гамма-секретаза отвечает за множественные внутримембранные расщепления APP». J. Neurochem . 100 (5): 1234–46. doi : 10.1111/j.1471-4159.2006.04302.x . PMID 17241131.
- ^ ab Zhang, H; Ma, Q; Zhang, YW; Xu, H (январь 2012 г.). «Протеолитическая обработка белка-предшественника β-амилоида болезни Альцгеймера». Журнал нейрохимии . 120 Suppl 1: 9–21. doi :10.1111/j.1471-4159.2011.07519.x. PMC 3254787. PMID 22122372 .
- ^ Хаас, C; Кэтер, C; Тинакаран, G; Сисодия, S (май 2012 г.). «Торговля и протеолитическая обработка APP». Cold Spring Harbor Perspectives in Medicine . 2 (5): a006270. doi :10.1101/cshperspect.a006270. PMC 3331683. PMID 22553493 .
