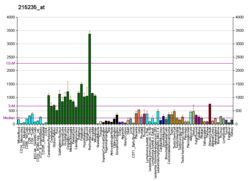
СПТАН1
| СПТАН1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SPTAN1 , EIEE5, NEAS, SPTA2, спектрин альфа, неэритроцитарный 1, DEE5 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 182810; МГИ : 98386; Гомологен : 2353; Генные карты : SPTAN1; OMA :SPTAN1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Альфа II-спектрин , также известный как альфа-цепь спектрина, мозг — это белок , который у людей кодируется геном SPTAN1 . [ 5] [6] [7] Альфа II-спектрин экспрессируется в различных тканях и высоко экспрессируется в сердечной мышце в структурах Z-диска , костамерах и на мембране сарколеммы . Мутации в альфа II-спектрине были связаны с ранней детской эпилептической энцефалопатией-5 , и альфа II-спектрин может быть ценным биомаркером синдрома Гийена-Барре и детского врожденного порока сердца .
Структура
Альтернативный сплайсинг альфа II-спектрина был задокументирован и приводит к множественным вариантам транскрипта; в частности, кардиомиоциты имеют четыре идентифицированных варианта сплайсинга альфа II-спектрина . [8] [9] В отличие от альфа I-спектрина, который в основном обнаруживается в эритроцитах, [10] альфа II-спектрин экспрессируется в большинстве тканей. В сердечной ткани альфа II-спектрин обнаруживается в миоцитах в Z-дисках , костамерах и мембране сарколеммы , [11] [12] [13] и в сердечных фибробластах вдоль поверхности цитоскелетной сети. [14] Альфа II-спектрин чаще всего существует в гетеродимере с субъединицами альфа II и бета II спектрина; и димеры обычно самоассоциируются и гетеротетрамеризуются. [5] [15] [16]
Функция
Спектрины представляют собой семейство широко распространенных цитоскелетных белков, которые участвуют в сшивании актина , клеточной адгезии, межклеточной коммуникации и регуляции клеточного цикла. [17] [18] [19] Хотя роль в сердечной мышце не совсем понятна, вероятно, что альфа II-спектрин участвует в организации субсарколеммальных доменов и стабилизации сарколеммальных мембран против стрессов, связанных с непрерывным сердечным сокращением. [16] Функциональное разнообразие альфа II-спектрина проявляется через его четыре варианта сплайсинга. Во-первых, специфичная для сердца вставка из 21 аминокислотной последовательности в 21-м повторе спектрина, названная альфа II-cardi+, была идентифицирована как вставка, которая модулирует сродство альфа II-спектрина к связыванию бета-спектринов и регулирует рост и дифференцировку миоцитов . [8] Во-вторых, другая вставка из 20 аминокислот в 10-м спектриновом повторе, называемая SH3i+, содержит участки фосфорилирования протеинкиназы А и протеинкиназы С и модулирует Ca2+-зависимое расщепление спектрина и свойства белок-белкового взаимодействия . [20] В-третьих, вставка из пяти аминокислот в пятнадцатом спектриновом мотиве несет высокоантигенный эпитоп, напоминающий анкирин-подобный участок связывания белка p53. [8] [21] В-четвертых, сообщалось о вставке из шести аминокислот в двадцать первом спектриновом мотиве с неизвестной функцией. [11] [22]
Было показано, что экспрессия гена альфа II-спектрина повышается в сердечных фибробластах в ответ на ремоделирование сердца, вызванное ангиотензином II . [23]
В животных моделях заболеваний и травм альфа II-спектрин был вовлечен в различные функции. В собачьей модели гипотермической остановки кровообращения продукты распада альфа II-спектрина оказались значимыми маркерами неврологических повреждений после операции на сердце. [24]
Клиническое значение
Мутации в SPTAN1 являются причиной ранней детской эпилептической энцефалопатии-5 . [25]
Альфа II-спектрин показал многообещающую полезность в качестве биомаркера некроза мозга и апоптоза у младенцев с врожденным пороком сердца ; продукты распада альфа II-спектрина были обнаружены в сыворотке новорожденных в периоперационный период и после операции на открытом сердце . [26] Повышенная экспрессия белка альфа II-спектрина была обнаружена в спинномозговой жидкости у пациентов с синдромом Гийена-Барре . [27]
Взаимодействия
Было показано, что SPTAN1 взаимодействует с:
- Ген Abl , [28]
- ФАНКА , [29] [30] [31]
- Анемия Фанкони, группа комплементации C , [29] [30]
- GRIA2 , [32]
- Плектин , [33] [34]
- ШЭНК1 , [35] и
- Виментин . [33]
Смотрите также
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000197694 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000057738 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ ab Leto TL, Fortugno-Erikson D, Barton D, Yang-Feng TL, Francke U, Harris AS, Morrow JS, Marchesi VT, Benz EJ (февраль 1988 г.). "Сравнение неэритроидных генов альфа-спектрина выявляет строгую гомологию среди различных видов". Mol Cell Biol . 8 (1): 1– 9. doi :10.1128/MCB.8.1.1. PMC 363070 . PMID 3336352.
- ^ Лето, TL; Фортуньо-Эриксон, Д.; Бартон, Д.; Ян-Фенг, TL; Франке, У.; Харрис, А.С.; Морроу, Дж. С.; Маркези, ВТ; Бенц, Э.Дж. (1988). «Ген Энтреза: спектрин SPTAN1, альфа, неэритроцитарный 1 (альфа-фодрин)». Молекулярная и клеточная биология . 8 (1): 1–9 . doi :10.1128/MCB.8.1.1. ПМК 363070 . ПМИД 3336352.
- ^ McMahon AP, Giebelhaus DH, Champion JE, Bailes JA, Lacey S, Carritt B, Henchman SK, Moon RT (1987). "cDNA cloning, sequencing andchromosome mapping of a non-erythroid spectrin, human alpha-fodrin". Differentiation . 34 (1): 68–78 . doi :10.1111/j.1432-0436.1987.tb00052.x. PMID 3038643.
- ^ abc Zhang Y, Resneck WG, Lee PC, Randall WR, Bloch RJ, Ursitti JA (июнь 2010 г.). «Характеристика и экспрессия селективного для сердца альтернативно сплайсированного варианта альфа II-спектрина, cardi+, во время развития у крысы». Журнал молекулярной и клеточной кардиологии . 48 (6): 1050– 9. doi :10.1016/j.yjmcc.2010.01.001. PMC 3537504. PMID 20114050 .
- ^ Cianci CD, Zhang Z, Pradhan D, Morrow JS (ноябрь 1999). «Мозг и мышцы экспрессируют уникальный альтернативный транскрипт альфаII спектрина». Биохимия . 38 (48): 15721– 30. doi :10.1021/bi991458k. PMID 10625438.
- ^ Ursitti JA, Kotula L, DeSilva TM, Curtis PJ, Speicher DW (март 1996). «Картирование сайта инициации димера бета-спектрина эритроцитов человека с использованием рекомбинантных пептидов и корреляция его фазирования с сайтом димера альфа-актинина». Журнал биологической химии . 271 (12): 6636– 44. doi : 10.1074/jbc.271.12.6636 . PMID 8636080.
- ^ ab Du A, Sanger JM, Sanger JW (июнь 2008 г.). «Сердечный миофибриллогенез внутри неповрежденных эмбриональных сердец». Developmental Biology . 318 (2): 236–46 . doi :10.1016/j.ydbio.2008.03.011. PMC 2496890. PMID 18455713 .
- ^ Bennett PM, Maggs AM, Baines AJ, Pinder JC (апрель 2006 г.). «Переходное соединение: новый функциональный субклеточный домен в интеркалированном диске». Молекулярная биология клетки . 17 (4): 2091– 100. doi :10.1091/mbc.E05-12-1109. PMC 1415289. PMID 16481394 .
- ^ Bennett PM, Baines AJ, Lecomte MC, Maggs AM, Pinder JC (2004). «Не просто белок плазматической мембраны: в клетках сердечной мышцы альфа-II спектрин также показывает тесную связь с миофибриллами». Journal of Muscle Research and Cell Motility . 25 (2): 119– 26. doi :10.1023/b:jure.0000035892.77399.51. PMID 15360127. S2CID 10297147.
- ^ Sormunen R (сентябрь 1993 г.). «Альфа-спектрин в детергентно-экстрагированных тотальных цитоскелетах фибробластов сердца куриного эмбриона». The Histochemical Journal . 25 (9): 678–86 . doi :10.1007/bf00157882. PMID 8226104. S2CID 34132236.
- ^ Bignone PA, Baines AJ (сентябрь 2003 г.). «Изоформы Spectrin alpha II и beta II взаимодействуют с высокой степенью сродства в месте тетрамеризации». The Biochemical Journal . 374 (Pt 3): 613–24 . doi :10.1042/BJ20030507. PMC 1223645 . PMID 12820899.
- ^ ab Baines AJ, Pinder JC (1 сентября 2005 г.). «Спектрин-ассоциированный цитоскелет в сердце млекопитающих». Frontiers in Bioscience . 10 ( 1– 3): 3020– 33. doi : 10.2741/1759 . PMID 15970557.
- ^ Ursitti JA, Petrich BG, Lee PC, Resneck WG, Ye X, Yang J, Randall WR, Bloch RJ, Wang Y (март 2007 г.). «Роль альтернативно сплайсированной формы альфаII-спектрина в локализации коннексина 43 в кардиомиоцитах и регуляции активируемой стрессом протеинкиназой». Журнал молекулярной и клеточной кардиологии . 42 (3): 572– 81. doi :10.1016/j.yjmcc.2006.11.018. PMC 1983066. PMID 17276456 .
- ^ Metral S, Machnicka B, Bigot S, Colin Y, Dhermy D, Lecomte MC (январь 2009 г.). «АльфаII-спектрин имеет решающее значение для клеточной адгезии и клеточного цикла» (PDF) . Журнал биологической химии . 284 (4): 2409– 18. doi : 10.1074/jbc.M801324200 . PMID 18978357. S2CID 18821519.
- ^ Sridharan DM, McMahon LW, Lambert MW (ноябрь 2006 г.). «альфаII-Спектрин взаимодействует с пятью группами функционально важных белков в ядре». Cell Biology International . 30 (11): 866–78 . doi :10.1016/j.cellbi.2006.06.005. PMID 16889989. S2CID 28863657.
- ^ Nedrelow JH, Cianci CD, Morrow JS (февраль 2003 г.). "c-Src связывает домен Src homology 3 (SH3) альфа II спектрина и блокирует восприимчивость к кальпаину путем фосфорилирования Tyr1176". Журнал биологической химии . 278 (9): 7735– 41. doi : 10.1074/jbc.M210988200 . PMID 12446661.
- ^ Kennedy SP, Warren SL, Forget BG, Morrow JS (октябрь 1991 г.). «Анкирин связывается с 15-й повторяющейся единицей эритроидного и неэритроидного бета-спектрина». Журнал клеточной биологии . 115 (1): 267–77 . doi :10.1083/jcb.115.1.267. PMC 2289929. PMID 1833409 .
- ^ Moorthy S, Chen L, Bennett V (май 2000 г.). «Caenorhabditis elegans beta-G spectrin необязателен для установления эпителиальной полярности, но необходим для мышечной и нейронной функции». The Journal of Cell Biology . 149 (4): 915– 30. doi :10.1083/jcb.149.4.915. PMC 2174577 . PMID 10811831.
- ^ Wang XF, Gao GD, Liu J, Guo R, Lin YX, Chu YL, Han FC, Zhang WH, Bai YJ (2006). «Идентификация дифференциально экспрессируемых генов, индуцированных ангиотензином II в сердечных фибробластах крыс». Клиническая и экспериментальная фармакология и физиология . 33 ( 1– 2): 41– 6. doi : 10.1111/j.1440-1681.2006.04321.x . PMID 16445697. S2CID 21008341.
- ^ Weiss ES, Wang KK, Allen JG, Blue ME, Nwakanma LU, Liu MC, Lange MS, Berrong J, Wilson MA, Gott VL, Troncoso JC, Hayes RL, Johnston MV, Baumgartner WA (август 2009 г.). «Продукты распада альфа-II-спектрина служат новыми маркерами тяжести повреждения мозга в модели гипотермической остановки кровообращения у собак». Анналы торакальной хирургии . 88 (2): 543–50 . doi :10.1016/j.athoracsur.2009.04.016. PMC 3412404. PMID 19632410 .
- ^ Writzl K, Primec ZR, Стражишар Б.Г., Осредкар Д., Печарич-Меглич Н., Краньц Б.С., Нисияма К., Мацумото Н., Сайтсу Х (июнь 2012 г.). «Синдром Веста с ранним началом с тяжелой гипомиелинизацией и колобомоподобными дисками зрительного нерва у девочки с мутацией SPTAN1». Эпилепсия . 53 (6): e106–10. дои : 10.1111/j.1528-1167.2012.03437.x. PMID 22429196. S2CID 20216273.
- ^ Jain P, Spaeder MC, Donofrio MT, Sinha P, Jonas RA, Levy RJ (март 2014 г.). «Обнаружение продуктов распада альфа II-спектрина в сыворотке новорожденных с врожденным пороком сердца*». Pediatric Critical Care Medicine . 15 (3): 229– 35. doi :10.1097/PCC.00000000000000059. PMC 4059536. PMID 24395002 .
- ^ Леменсик В., Зюссмут С.Д., Бреттшнейдер Дж., Таушер Г., Фелк С., Гиллардон Ф., Тумани Х. (апрель 2007 г.). «Протеомный анализ спинномозговой жидкости при синдроме Гийена-Барре (СГБ)». Журнал нейроиммунологии . 185 ( 1–2 ): 190–4 . doi :10.1016/j.jneuroim.2007.01.022. PMID 17367871. S2CID 28987593.
- ^ Ziemnicka-Kotula D, Xu J, Gu H, Potempska A, Kim KS, Jenkins EC, Trenkner E, Kotula L (май 1998). «Идентификация кандидата на связывание домена Src homology 3 человеческого спектрина предполагает общий механизм ассоциации тирозинкиназ с мембранным скелетом на основе спектрина». J. Biol. Chem . 273 (22): 13681– 92. doi : 10.1074/jbc.273.22.13681 . PMID 9593709.
- ^ ab McMahon LW, Sangerman J, Goodman SR, Kumaresan K, Lambert MW (июнь 2001 г.). "Человеческий альфа-спектрин II и белки FANCA, FANCC и FANCG связываются с ДНК, содержащей межцепочечные поперечные связи псоралена". Биохимия . 40 (24): 7025– 34. doi :10.1021/bi002917g. PMID 11401546.
- ^ ab McMahon LW, Walsh CE, Lambert MW (ноябрь 1999 г.). «Человеческий альфа-спектрин II и белки анемии Фанкони FANCA и FANCC взаимодействуют, образуя ядерный комплекс». J. Biol. Chem . 274 (46): 32904– 8. doi : 10.1074/jbc.274.46.32904 . PMID 10551855.
- ^ Шридхаран Д., Браун М., Ламберт В.К., Макмахон Л.В., Ламберт М.В. (март 2003 г.). «Неэритроидный альфаII-спектрин необходим для привлечения FANCA и XPF в ядерные фокусы, индуцированные межцепочечными сшивками ДНК». J. Cell Sci . 116 (Pt 5): 823–35 . doi : 10.1242/jcs.00294 . PMID 12571280.
- ^ Хираи Х, Мацуда С (сентябрь 1999). «Взаимодействие С-концевого домена рецептора дельта-глутамата со спектрином в дендритных шипиках культивируемых клеток Пуркинье». Neurosci. Res . 34 (4): 281– 7. doi :10.1016/s0168-0102(99)00061-9. PMID 10576550. S2CID 45794233.
- ^ ab Brown MJ, Hallam JA, Liu Y, Yamada KM, Shaw S (июль 2001 г.). «Передовая грань: интеграция цитоскелета человеческих Т-лимфоцитов цитолинкером плектином». J. Immunol . 167 (2): 641– 5. doi : 10.4049/jimmunol.167.2.641 . PMID 11441066.
- ^ Herrmann H, Wiche G (январь 1987). "Плектин и IFAP-300K являются гомологичными белками, связывающимися с белками 1 и 2, ассоциированными с микротрубочками, и с 240-килодальтонной субъединицей спектрина". J. Biol. Chem . 262 (3): 1320– 5. doi : 10.1016/S0021-9258(19)75789-5 . PMID 3027087.
- ^ Böckers TM, Mameza MG, Kreutz MR, Bockmann J, Weise C, Buck F, Richter D, Gundelfinger ED, Kreienkamp HJ (октябрь 2001 г.). «Синаптические белки каркаса в мозге крысы. Анкириновые повторы семейства многодоменных белков Shank взаимодействуют с цитоскелетным белком альфа-фодрин». J. Biol. Chem . 276 (43): 40104– 12. doi : 10.1074/jbc.M102454200 . PMID 11509555.
Дальнейшее чтение
- Chow CW (1999). «Регуляция и внутриклеточная локализация эпителиальных изоформ Na+/H+-обменников NHE2 и NHE3». Клиническая и исследовательская медицина . 22 (5): 195–206 . PMID 10579058.
- Хаяши Y, Аракаки R, Ишимару N (2003). «Роль каскада каспаз в развитии первичного синдрома Шегрена». J. Med. Invest . 50 ( 1– 2): 32– 8. PMID 12630566.
- Беннетт В. (1979). «Иммунореактивные формы анкирина эритроцитов человека присутствуют в различных клетках и тканях». Nature . 281 (5732): 597– 9. Bibcode :1979Natur.281..597B. doi :10.1038/281597a0. PMID 492324. S2CID 263106.
- Frappier T, Stetzkowski-Marden F, Pradel LA (1991). "Взаимодействие доменов легкой цепи нейрофиламента и мозгового спектрина". Biochem. J . 275. ( Pt 2) (2): 521– 7. doi :10.1042/bj2750521. PMC 1150082 . PMID 1902666.
- Bennett AF, Hayes NV, Baines AJ (1991). "Специфичность сайта во взаимодействиях синапсина 1 с тубулином". Biochem. J . 276. ( Pt 3) (3): 793– 9. doi :10.1042/bj2760793. PMC 1151074 . PMID 1905928.
- Davis LH, Bennett V (1990). «Картирование участков связывания анкирина эритроцитов человека для анионообменника и спектрина». J. Biol. Chem . 265 (18): 10589– 96. doi : 10.1016/S0021-9258(18)86987-3 . PMID 2141335.
- Moon RT, McMahon AP (1990). "Создание разнообразия в неэритроидных спектринах. Множественные полипептиды предсказаны с помощью анализа последовательности кДНК, охватывающих кодирующую область человеческого неэритроидного альфа-спектрина". J. Biol. Chem . 265 (8): 4427– 33. doi : 10.1016/S0021-9258(19)39582-1 . PMID 2307671.
- Langley RC, Cohen CM (1986). «Связь спектрина с промежуточными филаментами десмина». J. Cell. Biochem . 30 (2): 101– 9. doi :10.1002/jcb.240300202. PMID 2939097. S2CID 25080821.
- Cianci CD, Giorgi M, Morrow JS (1988). «Фосфорилирование анкирина подавляет его кооперативное взаимодействие со спектрином и белком 3». J. Cell. Biochem . 37 (3): 301– 15. doi :10.1002/jcb.240370305. PMID 2970468. S2CID 42349239.
- Steiner JP, Bennett V (1988). "Независимые от анкирина сайты связывания мембранных белков для спектрина мозга и эритроцитов". J. Biol. Chem . 263 (28): 14417– 25. doi : 10.1016/S0021-9258(18)68236-5 . PMID 2971657.
- Herrmann H, Wiche G (1987). "Плектин и IFAP-300K являются гомологичными белками, связывающимися с белками 1 и 2, ассоциированными с микротрубочками, и с субъединицей спектрина массой 240 килодальтон". J. Biol. Chem . 262 (3): 1320– 5. doi : 10.1016/S0021-9258(19)75789-5 . PMID 3027087.
- McMahon AP, Giebelhaus DH, Champion JE, Bailes JA, Lacey S, Carritt B, Henchman SK, Moon RT (1987). "cDNA cloning, sequencing andchromosome mapping of a non-erythroid spectrin, human alpha-fodrin". Дифференциация . 34 (1): 68– 78. doi :10.1111/j.1432-0436.1987.tb00052.x. PMID 3038643.
- Frappier T, Regnouf F, Pradel LA (1988). «Связывание мозгового спектрина с белком субъединицы нейрофиламента 70 кДа». Eur. J. Biochem . 169 (3): 651– 7. doi : 10.1111/j.1432-1033.1987.tb13657.x . PMID 3121319.
- McMahon AP, Moon RT (1988). «Структура и эволюция неэритроидного спектрина, человеческого альфа-фодрина». Biochem. Soc. Trans . 15 (5): 804– 7. doi :10.1042/bst0150804. PMID 3691949.
- Lundberg S, Björk J, Löfvenberg L, Backman L (1995). «Клонирование, экспрессия и характеристика двух предполагаемых участков связывания кальция в человеческом неэритроидном альфа-спектрине». Eur. J. Biochem . 230 (2): 658– 65. doi : 10.1111/j.1432-1033.1995.0658h.x . PMID 7607240.
- Хьюз К.А., Беннетт В. (1995). «Аддуцин: физическая модель с последствиями для функции сборки спектрин-актиновых комплексов». J. Biol. Chem . 270 (32): 18990– 6. doi : 10.1074/jbc.270.32.18990 . PMID 7642559.
- Gregorio CC, Repasky EA, Fowler VM, Black JD (1994). "Динамические свойства анкирина в Т-лимфоцитах: колокализация со спектрином и протеинкиназой C бета". J. Cell Biol . 125 (2): 345–58 . doi :10.1083/jcb.125.2.345. PMC 2120020. PMID 8163551 .
- Ли X, Беннетт В (1996). «Идентификация субъединицы спектрина и доменов, необходимых для образования комплексов спектрин/аддуцин/актин». J. Biol. Chem . 271 (26): 15695– 702. doi : 10.1074/jbc.271.26.15695 . PMID 8663089.
- Stabach PR, Cianci CD, Glantz SB, Zhang Z, Morrow JS (1997). «Сайт-направленный мутагенез альфа II спектрина в кодоне 1175 модулирует его восприимчивость к мю-кальпаину». Биохимия . 36 (1): 57– 65. doi :10.1021/bi962034i. PMID 8993318.