С1ПР1
| С1ПР1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | S1PR1 , CD363, CHEDG1, D1S3362, ECGF1, EDG-1, EDG1, S1P1, рецептор сфингозин-1-фосфата 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 601974; МГИ : 1096355; гомологен : 1071; Генные карты : S1PR1; ОМА :S1PR1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Рецептор сфингозин-1-фосфата 1 (рецептор S1P 1 или S1PR1), также известный как ген эндотелиальной дифференцировки 1 (EDG1), представляет собой белок , который у людей кодируется геном S1PR1 . S1PR1 представляет собой рецептор, сопряженный с G-белком , который связывает биоактивную сигнальную молекулу сфингозин-1-фосфат (S1P). S1PR1 принадлежит к подсемейству рецепторов сфингозин-1-фосфата , состоящему из пяти членов (S1PR1-5). [5] S1PR1 изначально был идентифицирован как распространенный транскрипт в эндотелиальных клетках [6] и играет важную роль в регуляции структуры цитоскелета эндотелиальных клеток , миграции, формировании капилляроподобной сети и созревании сосудов. [7] [8] Кроме того, сигнализация S1PR1 важна в регуляции созревания, миграции и перемещения лимфоцитов . [9] [10]
Структура
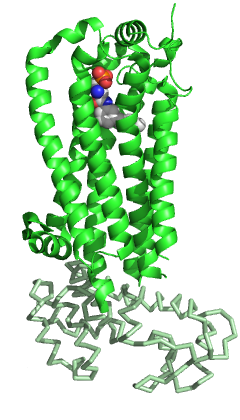
S1PR1, как и другие члены семейства GPCR , состоит из семи трансмембранных спиралей, организованных в структурно консервативный пучок. [5] Как и другие GPCR, во внеклеточной области S1PR1 состоит из трех петель: ECL1 между спиралями II и III, ECL2 между спиралями IV и V и ECL3 между спиралями VI и VII. По сравнению с другими членами семейства, S1PR1 имеет некоторые специфические особенности. N-конец белка сворачивается в виде спиральной крышки над верхушкой рецептора и, следовательно, ограничивает доступ лигандов к амфипатическому связывающему карману. Эта выраженная амфипатичность действительно согласуется с цвиттерионной природой S1P. Кроме того, спирали ECL1 и ECL2 плотно прилегают к N-концевой спирали, еще больше преграждая доступ лиганда из внеклеточного пространства. S1P или аналоги S1P, вероятно, достигают связывающего кармана изнутри клеточной мембраны, а не из внеклеточного пространства, возможно, через отверстие между спиралями I и VII. По сравнению с другими GPCR, эта область более открыта из-за различного расположения спиралей I и II по отношению к спирали III. [5] Эта окклюзия пространства доступа лиганда из внеклеточного пространства также может объяснить медленное насыщение связывания рецептора в присутствии избытка лиганда. [11]
Функция
Как и другие члены семейства GPCR, S1PR1 ощущает свой лиганд извне клетки и активирует внутриклеточные сигнальные пути, которые в конечном итоге приводят к клеточным ответам. Сигнал передается через ассоциацию рецептора с различными G-белками , что задействует ряд систем для нисходящей амплификации сигнала. [12]
Иммунная система
Перемещение иммунных клеток
S1P и его рецепторы играют ключевую роль в регуляции перемещения иммунных клеток, формируя градиенты, направляющие иммунные клетки между тканями и сосудистыми отсеками. S1PR1 играет ключевую роль в содействии выходу Т-клеток из лимфоидных органов , в то время как изменения уровней S1P могут влиять на миграцию и позиционирование иммунных клеток в лимфоидных и нелимфоидных тканях во время воспаления или иммунного надзора. [13]
S1PR1, в первую очередь расположенный на клеточной мембране большинства лимфоцитов, связывается с обильным лигандом S1P в кровотоке, способствуя выходу лимфоцитов из лимфоидных органов, позволяя им перемещаться в пораженные ткани. S1PR1 реагирует на градиент S1P между лимфоидными тканями (низкий S1P) и лимфой ( высокий S1P), облегчая перемещение Т-клеток через эндотелиальный барьер. [14] Однако при активации Т-клеток в лимфоидных органах посредством сигнализации цитокинов и рецепторов Т-клеток экспрессируется белок Cluster of Differentiation 69 ( CD69 ), который образует комплекс с S1PR1. Это взаимодействие, включающее трансмембранный домен CD69 и спираль-4 S1PR1, приводит к интернализации и деградации S1PR1, предотвращая связывание S1P и нисходящую сигнализацию. [15] Этот механизм приводит к временному удержанию лимфоцитов в лимфатических органах, повышая шансы успешной активации лимфоцитов, особенно если первоначальный сигнал активации был слабым. При столкновении с антигеном или стимуляции интерфероном типа I в лимфоидных органах экспрессия S1PR1 снижается за счет взаимодействия с CD69 и снижения регуляции фактора транскрипции Круппеля-подобного фактора 2. [16] Эффекторные Т-клетки в конечном итоге повторно экспрессируют S1PR1, чтобы выйти из лимфатического узла и войти в периферические ткани. Однако повышенные уровни S1P в лимфоидных тканях из-за ингибирования лиазы S1P, воспаления или синтетических лигандов S1PR1, таких как FTY720 , могут блокировать выход Т-клеток путем рассеивания градиента S1P, вызывая интернализацию S1PR1 и усиливая контакты эндотелиальных соединений для закрытия выходных портов. [16]
Регуляция иммунных клеток
Активация S1PR1 активно участвует в регуляции и развитии иммунных клеток . Рецептор сфингозин-1-фосфата 1 также участвует в иммуномодуляции и напрямую участвует в подавлении врожденных иммунных реакций Т-клеток. [17] В зависимости от белка G, связанного с S1PR1, достигаются различные клеточные эффекты: G αi и G αo модулируют выживание, пролиферацию и подвижность клеток ; G α12 и G α13 модулируют ремоделирование цитоскелета и изменения формы клеток, а G αq модулирует несколько клеточных эффекторных функций. [12] Все внутриклеточные функции происходят посредством взаимодействия с Gαi и Gαo: эти два белка привлекают другие белки для нисходящей амплификации сигнала. [12] Основные нисходящие эффекторные функции системы S1P-S1PR1 следующие:
- Сигнальный путь фосфатидилинозитол -3-киназы (PI3K) и липидзависимой протеинкиназы B (PKB) повышает выживаемость лимфоцитов и других иммунных клеток за счет ингибирования апоптоза .
- Фосфоинозитид 3-киназа (PI3K) и ГТФаза RAC отвечают за миграцию лимфоцитов и их взаимодействие с другими клетками или с поверхностями соединительной ткани. [12] Тимоциты с дефицитом S1PR1 не эмигрируют из тимуса, что приводит к увеличению числа зрелых тимоцитов в тимусе и медуллярной гиперплазии, и в этих мышиных моделях в крови, лимфатических узлах , селезенке или нелимфоидных органах можно обнаружить небольшое количество Т-клеток с дефицитом S1PR1. [9] [10] Пролиферация иммунных клеток происходит из-за сигналов, опосредованных S1P, через ГТФазу RAS и киназу, регулируемую внеклеточным сигналом (ERK). IV) Вызванное фосфолипазой C (PLC) повышение внутриклеточного уровня кальция позволяет секрецию цитокинов и других иммунных медиаторов. [12]
Васкулогенез
S1PR1 является одним из основных рецепторов, ответственных за рост и развитие сосудов , по крайней мере, во время эмбриогенеза . [18] В сосудистых эндотелиальных клетках связывание S1P с S1PR1 индуцирует миграцию, пролиферацию, выживание клеток и морфогенез в капилляроподобные структуры. [19] Более того, связывание S1P с S1PR1 участвует в формировании межклеточных адгезионных соединений , тем самым ингибируя парацеллюлярную проницаемость растворенных веществ и макромолекул . [20] [21] Также было показано in vivo, что S1P действует синергично с ангиогенными факторами, такими как FGF-2 и VEGF, в индукции ангиогенеза и созревания сосудов через S1PR1. [21] [22] показали, что мыши S1PR1 -KO погибли во время развития из-за дефекта стабилизации сосудов, что позволяет предположить, что этот рецептор необходим для развития сосудов. В заключение следует отметить, что ряд доказательств подтверждает, что S1P через S1PR1 является мощным регулятором роста и развития сосудов, по крайней мере, в период эмбриогенеза. [18]
Клиническое значение
Рак
S1PR1 участвует в подвижности раковых клеток при стимуляции S1P. Сигнальный путь включает RAC-CDC42 и коррелирует с активацией ERK1 и ERK2 . Путь RAC-CDC42 приводит к миграции клеток, тогда как путь ERK приводит к пролиферации и неоваскуляризации [23] [24] продемонстрировали, что S1PR1 сильно индуцируется в эндотелиальных клетках во время ангиогенеза опухоли, а siRNA против S1PR1 способна ингибировать ангиогенез и рост опухоли. S1PR1 также участвует в других типах рака: клетки фибросаркомы мигрируют при активации S1PR1 S1P через зависимый от RAC1–CDC42 путь) [25] [26] и инвазия клеток рака яичников включает S1PR1 или S1PR3 и мобилизацию кальция. [27]
Рассеянный склероз
S1PR1 участвует в рассеянном склерозе . Финголимод , препарат, который интернализует рецептор, одобрен в качестве агента, модифицирующего заболевание при рассеянном склерозе. Существуют и другие модуляторы рецептора сфингозин-1-фосфата . Ван Доорн и др. (2010) [28] наблюдали сильное увеличение экспрессии S1PR1 (и S1PR3) в гипертрофированных астроцитах как в активных, так и в неактивных очагах рассеянного склероза у пациентов по сравнению с незатронутыми пациентами.
Эволюция
Взаимодействия
Было показано, что S1PR1 взаимодействует с рецептором 5-HT1A , [30] GNAI1 , [31] и GNAI3 . [31]
Смотрите также
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000170989 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000045092 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ abc Hanson MA, Roth CB, Jo E, Griffith MT, Scott FL, Reinhart G и др. (февраль 2012 г.). «Кристаллическая структура рецептора, связанного с липидным G-белком». Science . 335 (6070): 851– 855. Bibcode :2012Sci...335..851H. doi :10.1126/science.1215904. PMC 3338336 . PMID 22344443.
- ^ Hla T, Maciag T (июнь 1990). «Обильный транскрипт, индуцированный в дифференцирующихся человеческих эндотелиальных клетках, кодирует полипептид со структурным сходством с рецепторами, связанными с G-белком». Журнал биологической химии . 265 (16): 9308– 9313. doi : 10.1016/S0021-9258(19)38849-0 . PMID 2160972.
- ^ Lee MJ, Van Brocklyn JR, Thangada S, Liu CH, Hand AR, Menzeleev R и др. (март 1998 г.). «Сфингозин-1-фосфат как лиганд для рецептора, связанного с G-белком EDG-1». Science . 279 (5356): 1552– 1555. Bibcode :1998Sci...279.1552L. doi :10.1126/science.279.5356.1552. PMID 9488656.
- ^ Liu CH, Thangada S, Lee MJ, Van Brocklyn JR, Spiegel S, Hla T (апрель 1999). «Лиганд-индуцированный трафик рецептора сфингозин-1-фосфата EDG-1». Молекулярная биология клетки . 10 (4): 1179– 1190. doi : 10.1091 /mbc.10.4.1179. PMC 25247. PMID 10198065.
- ^ ab Allende ML, Dreier JL, Mandala S, Proia RL (апрель 2004 г.). «Экспрессия рецептора сфингозин-1-фосфата, S1P1, на Т-клетках контролирует тимическую эмиграцию». Журнал биологической химии . 279 (15): 15396– 15401. doi : 10.1074/jbc.M314291200 . PMID 14732704.
- ^ ab Matloubian M, Lo CG, Cinamon G, Lesneski MJ, Xu Y, Brinkmann V и др. (январь 2004 г.). «Выход лимфоцитов из тимуса и периферических лимфоидных органов зависит от рецептора S1P 1». Nature . 427 (6972): 355– 360. Bibcode :2004Natur.427..355M. doi :10.1038/nature02284. PMID 14737169. S2CID 4371877.
- ^ Rosen H, Gonzalez-Cabrera PJ, Sanna MG, Brown S (2009). «Сигнализация рецептора сфингозина 1-фосфата». Annual Review of Biochemistry . 78 : 743–768 . doi :10.1146/annurev.biochem.78.072407.103733. PMID 19231986.
- ^ abcde Rosen H (сентябрь 2005 г.). «Химические подходы к лизофосфолипидным рецепторам». Простагландины и другие липидные медиаторы . 77 ( 1– 4): 179– 184. doi :10.1016/j.prostaglandins.2004.09.011. PMID 16099402.
- ^ Garris CS, Blaho VA, Hla T, Han MH (июль 2014 г.). «Сигнализация рецептора сфингозин-1-фосфата 1 в Т-клетках: трафик и далее». Иммунология . 142 (3): 347–353 . doi :10.1111/imm.12272. PMC 4080950. PMID 24597601 .
- ^ Chi H (январь 2011 г.). «Сфингозин-1-фосфат и иммунная регуляция: торговля и не только». Тенденции в фармакологических науках . 32 (1): 16– 24. doi :10.1016/j.tips.2010.11.002. PMC 3017656. PMID 21159389 .
- ^ Cibrián D, Sánchez-Madrid F (июнь 2017 г.). «CD69: от маркера активации до метаболического привратника». European Journal of Immunology . 47 (6): 946–953 . doi :10.1002/eji.201646837. PMC 6485631. PMID 28475283 .
- ^ ab Rivera J, Proia RL, Olivera A (октябрь 2008 г.). «Сотрудничество сфингозин-1-фосфата и его рецепторов в иммунитете». Nature Reviews. Иммунология . 8 (10): 753– 763. doi :10.1038/nri2400. PMC 2600775. PMID 18787560 .
- ^ Sharma N, Akhade AS, Qadri A (апрель 2013 г.). «Сфингозин-1-фосфат подавляет секрецию CXCL8, вызванную TLR, из человеческих Т-клеток». Journal of Leukocyte Biology . 93 (4): 521– 528. doi :10.1189/jlb.0712328. PMID 23345392. S2CID 21897008.
- ^ ab Chae SS, Paik JH, Allende ML, Proia RL, Hla T (апрель 2004 г.). «Регуляция развития конечностей с помощью рецептора сфингозин-1-фосфата S1p1/EDG-1 происходит через ось гипоксия/VEGF». Developmental Biology . 268 (2): 441– 447. doi : 10.1016/j.ydbio.2004.01.001 . PMID 15063179.
- ^ Lee MJ, Thangada S, Claffey KP, Ancellin N, Liu CH, Kluk M и др. (октябрь 1999 г.). «Сборка адгезивных соединений сосудистых эндотелиальных клеток и морфогенез, индуцированные сфингозин-1-фосфатом». Cell . 99 (3): 301– 312. doi : 10.1016/S0092-8674(00)81661-X . PMID 10555146. S2CID 1126846.
- ^ Sanchez T, Estrada-Hernandez T, Paik JH, Wu MT, Venkataraman K, Brinkmann V и др. (ноябрь 2003 г.). «Фосфорилирование и действие иммуномодулятора FTY720 ингибируют сосудистую проницаемость, вызванную фактором роста эндотелиальных клеток». Журнал биологической химии . 278 (47): 47281– 47290. doi : 10.1074/jbc.M306896200 . PMID 12954648.
- ^ ab Garcia JG, Liu F, Verin AD, Birukova A, Dechert MA, Gerthoffer WT и др. (сентябрь 2001 г.). «Сфингозин 1-фосфат способствует целостности барьера эндотелиальных клеток путем Edg-зависимой перестройки цитоскелета». Журнал клинических исследований . 108 (5): 689– 701. doi :10.1172/JCI12450. PMC 209379. PMID 11544274 .
- ^ Liu Y, Wada R, Yamashita T, Mi Y, Deng CX, Hobson JP и др. (октябрь 2000 г.). «Edg-1, рецептор сфингозин-1-фосфата, связанный с G-белком, необходим для созревания сосудов». Журнал клинических исследований . 106 (8): 951– 961. doi :10.1172/JCI10905. PMC 314347. PMID 11032855 .
- ^ Pyne NJ, Pyne S (июль 2010 г.). «Сфингозин-1-фосфат и рак» (PDF) . Nature Reviews. Рак . 10 (7): 489– 503. doi :10.1038/nrc2875. PMID 20555359. S2CID 32955497.
- ^ Chae SS, Paik JH, Furneaux H, Hla T (октябрь 2004 г.). «Потребность в рецепторе сфингозин-1-фосфата-1 при ангиогенезе опухолей, продемонстрированная с помощью РНК-интерференции in vivo». Журнал клинических исследований . 114 (8): 1082– 1089. doi :10.1172/JCI22716. PMC 522258. PMID 15489955.
- ^ Fisher KE, Pop A, Koh W, Anthis NJ, Saunders WB, Davis GE (декабрь 2006 г.). «Инвазия опухолевых клеток в коллагеновые матрицы требует координированного липидного агониста-индуцированного G-белка и мембранного типа матриксной металлопротеиназы-1-зависимого сигнала». Molecular Cancer . 5 : 69. doi : 10.1186/1476-4598-5-69 . PMC 1762019 . PMID 17156449.
- ^ Nyalendo C, Michaud M, Beaulieu E, Roghi C, Murphy G, Gingras D и др. (май 2007 г.). "Src-зависимое фосфорилирование матриксной металлопротеиназы мембранного типа I на цитоплазматическом тирозине 573: роль в миграции эндотелиальных и опухолевых клеток" . The Journal of Biological Chemistry . 282 (21): 15690– 15699. doi : 10.1074/jbc.M608045200 . PMID 17389600.
- ^ Park KS, Kim MK, Lee HY, Kim SD, Lee SY, Kim JM и др. (апрель 2007 г.). «S1P стимулирует хемотаксическую миграцию и инвазию в клетках рака яичников OVCAR3». Biochemical and Biophysical Research Communications . 356 (1): 239– 244. doi :10.1016/j.bbrc.2007.02.112. PMID 17349972.
- ^ Ван Доорн Р., Ван Хорссен Дж., Верзийл Д., Витте М., Ронкен Э., Ван Хет Хоф Б. и др. (сентябрь 2010 г.). «Рецепторы сфингозин-1-фосфата 1 и 3 активируются при поражениях рассеянного склероза». Глия . 58 (12): 1465–1476 . doi :10.1002/glia.21021. PMID 20648639. S2CID 26000783.
- ^ «GeneCards®: База данных генов человека».
- ^ Салим К, Фентон Т, Бача Дж, Уриен-Родригес Х, Боннерт Т, Скайнер ХА и др. (Май 2002). «Олигомеризация рецепторов, связанных с G-белком, показанная с помощью селективной коиммунопреципитации». Журнал биологической химии . 277 (18): 15482– 15485. doi : 10.1074/jbc.M201539200 . PMID 11854302.
- ^ ab Lee MJ, Evans M, Hla T (май 1996). «Сигналы индуцируемого рецептора, связанного с G-белком, edg-1 через путь G(i)/митоген-активируемой протеинкиназы». Журнал биологической химии . 271 (19): 11272– 11279. doi : 10.1074/jbc.271.19.11272 . PMID 8626678.
Внешние ссылки
- "Лизофосфолипидные рецепторы: S1P1". База данных рецепторов и ионных каналов IUPHAR . Международный союз фундаментальной и клинической фармакологии. Архивировано из оригинала 7 января 2015 г. Получено 5 декабря 2008 г.
- Лизофосфолипид+рецепторы в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
В данной статье использован текст из Национальной медицинской библиотеки США , являющийся общественным достоянием .






