ЕДДС
 | |
| Имена | |
|---|---|
| Название ИЮПАК Этилендиамин- N , N′ -диянтарная кислота [ требуется ссылка ] | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| МеШ | N,N'-этилендиамин+диянтарная+кислота |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| С10Н16Н2О8 | |
| Молярная масса | 292,244 г·моль −1 |
| Плотность | 1,44 г мл −1 |
| Температура плавления | 220–222 °C (428–432 °F; 493–495 K) |
| Кислотность ( pK a ) | 2.4 |
| Основность (p K b ) | 11.6 |
| Термохимия | |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −1,9541–−1,9463 МДж моль −1 |
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −4,2755–−4,2677 МДж моль −1 |
| Родственные соединения | |
Родственные алкановые кислоты | ЭДТА |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Этилендиамин - N , N'- диянтарная кислота ( EDDS ) является аминополикарбоновой кислотой . Это бесцветное твердое вещество, которое используется в качестве хелатирующего агента , который может предложить биоразлагаемую альтернативу EDTA , которая в настоящее время широко используется в многочисленных приложениях.
Структура и свойства
EDDS имеет два хиральных центра и, как таковые, три стереоизомера. [1] Это энантиомерные (R,R) и (S,S) изомеры и ахиральный мезо (R,S) изомер. В качестве биоразлагаемой замены EDTA интерес представляет только (S,S) стереоизомер. (R,S) и (R,R) стереоизомеры менее биоразлагаемы, тогда как (S,S) стереоизомер, как было показано, очень эффективно биоразлагается даже в сильно загрязненных почвах. [2]
Синтез
EDDS был впервые синтезирован из малеиновой кислоты и этилендиамина . [3] [4] Некоторые микроорганизмы были использованы для промышленного синтеза (S,S)-EDDS из этилендиамина и фумаровой кислоты или малеиновой кислоты, который протекает следующим образом: [5]
Из аспарагиновой кислоты
(S,S)-EDDS производится стереоспецифически путем алкилирования этилендибромида L- аспарагиновой кислотой . Рацемический EDDS производится путем реакции этилендиамина с фумаровой кислотой или малеиновой кислотой.
Координационная химия
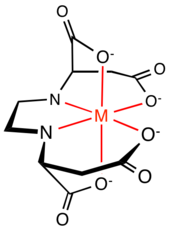
При сравнении эффективности (S,S)-EDDS и EDTA в качестве хелатирующих агентов для железа (III) :
| Реакция образования | Константа образования |
|---|---|
| [Fe(H 2 O) 6 ] 3+ + (S,S)-EDDS 4− → Fe[(S,S)-EDDS] − + 6 H 2 O | К ЕДДС = 10 20,6 |
| [Fe(H 2 O) 6 ] 3+ + ЭДТА 4− → Fe(ЭДТА) − + 6 H 2 O | К ЭДТА = 10 25,1 |
Из-за более низкой стабильности [Fe(S,S)-EDDS] − полезный диапазон составляет примерно 3< pH (S,S)-EDDS <9 и 2<pH EDTA <11. Однако этот диапазон достаточен для большинства применений. [6]
Другое сравнение, которое можно провести между (S,S)-EDDS и EDTA, — это структура хелатного комплекса. Шесть донорных участков EDTA образуют пять пятичленных хелатных колец вокруг иона металла, четыре кольца NC 2 OFe и одно кольцо C 2 N 2 Fe. Кольцо C 2 N 2 Fe и два кольца NC 2 OFe определяют плоскость , а два кольца NC 2 OFe перпендикулярны плоскости, содержащей ось симметрии C 2 . Пятичленные кольца слегка напряжены. Шесть донорных участков EDDS образуют как пяти-, так и шестичленные хелатные кольца вокруг иона металла: два кольца NC 2 OFe, два кольца NC 3 OFe и одно кольцо C 2 N 2 Fe. Исследования кристаллической структуры комплекса Fe[(S,S)-EDDS] − показывают, что два пятичленных кольца NC 3 OFe выступают из плоскости комплекса, уменьшая экваториальную кольцевую деформацию, которая существует в комплексе Fe[EDTA] − . [7] Комплекс также имеет симметрию C 2 .
Использует
(S,S)-EDDS — это биоразлагаемый хелатирующий агент, который предлагает альтернативу EDTA, 80 миллионов килограммов которой производится ежегодно. Было обнаружено, что в естественных условиях EDTA преобразуется в этилендиаминтриуксусную кислоту, а затем циклизуется в дикетопиперазин , который накапливается в окружающей среде как стойкий органический загрязнитель . [8] [9] (S,S)-EDDS был разработан в коммерческих целях как биоразлагаемый хелатор и стабилизирующий агент в моющих и косметических составах. [10] Когда EDDS применяется при химической рекультивации почвы в чрезмерном случае (например, при применении для промывки почвы ex-situ), может быть достигнута более высокая эффективность извлечения тяжелых металлов, а объем извлечения менее зависит от дозировки EDDS; [11] С другой стороны, во время рекультивации почвы, которая включает непрерывную промывку, извлечение металлов часто ограничивается количеством EDDS. При дефиците EDDS наблюдалась первоначальная неселективная экстракция тяжелых металлов, за которой следовал обмен тяжелых металлов и повторная адсорбция тяжелых металлов, имеющих более низкую константу устойчивости с EDDS. [12]
Внешние ссылки
- Страница Sigma Aldrich на EDDS, содержащая ссылку на MSDS
Ссылки
- ^ Нил, JA; Роуз, NJ (1968). «Стереоспецифические лиганды и их комплексы. I. Комплекс кобальта(III) с этилендиаминдиянтарной кислотой». Неорганическая химия . 7 (11): 2405– 2412. doi :10.1021/ic50069a043.
- ^ Тэнди, С.; Амманн, А.; Шулин, Р.; Новак, Б. (2006). «Биодеградация и видообразование остаточной SS-этилендиаминдиянтарной кислоты (EDDS) в почвенном растворе, оставшемся после промывки почвы». Загрязнение окружающей среды . 142 (2): 191– 199. doi :10.1016/j.envpol.2005.10.013. PMID 16338042.
- ^ Барбье, М.; и др. (1963). «Синтез и собственные аналоги ликомарасмина и аспергилломарасмина». Либигс Аннален . 668 : 132–138 . doi : 10.1002/jlac.19636680115.
- ^ Патент США 3158635, Кезерян, Чарльз; Рэмси, Уильям М., «Бисаддукты диаминов и ненасыщенных кислот», выдан 24 ноября 1964 г.
- ^ Takahashi, R.; et al. (1999). «Производство (S,S)-этилендиамин-N,N'-диянтарной кислоты из этилендиамина и фумаровой кислоты бактериями». Biosci. Biotechnol. Biochem . 63 (7): 1269– 1273. doi : 10.1271/bbb.63.1269 . PMID 27380235.
- ^ Orama, M.; Hyvönen, H.; Saarinen, H.; Aksela, R. (2002). «Комплексообразование [S,S] и смешанных стереоизомеров N,N'-этилендиаминдиянтарной кислоты (EDDS) с ионами Fe(III), Cu(II), Zn(II) и Mn(II) в водном растворе». J. Chem. Soc., Dalton Trans. (24): 4644– 4648. doi :10.1039/b207777a.
- ^ Павелчик, Ф.; Майер, Й. (1978). «Кристаллическая и молекулярная структура тригидрата [(S,S)-N,N'-этилендиаминдисукцинато]кобальтата(III) лития». Acta Crystallographica B. 34 ( 12): 3582– 3585. doi :10.1107/S0567740878011644.
- ^ Юань, З.; ВанБризен, Дж. М. (2006). «Формирование промежуточных продуктов при биодеградации ЭДТА и НТА». Environmental Engineering Science . 23 (3): 533– 544. doi :10.1089/ees.2006.23.533.
- ^ Yip, TCM; Tsang, DCW; Ng, KTW; Lo, IMC (2009). «Кинетические взаимодействия EDDS с почвами. 1. Резорбция металлов и конкуренция при дефиците EDDS». Environ. Sci. Technol . 43 (3): 831– 836. Bibcode :2009EnST...43..831Y. doi :10.1021/es802030k. PMID 19245023.
- ^ Schowanek, D.; Feijtel, TCJ; Perkins, CM; Hartman, FA; Federle, TW; Larson, RJ (1997). «Биодеградация (S,S), (R,R) и смешанных стереоизомеров этилендиаминдиянтарной кислоты (EDDS), хелатора переходных металлов». Chemosphere . 34 (11): 2375– 2391. doi :10.1016/S0045-6535(97)00082-9. PMID 9192467.
- ^ Yip, TCM; Tsang, DCW; Ng, KTW; Lo, IMC (2009). «Эмпирическое моделирование извлечения тяжелых металлов с помощью EDDS из почв, загрязненных одним и несколькими металлами». Chemosphere . 74 (2): 301– 307. Bibcode :2009Chmsp..74..301Y. doi :10.1016/j.chemosphere.2008.09.006. PMID 18851868.
- ^ Tsang, DCW; Yip, TCM; Lo, IMC (2009). «Кинетические взаимодействия EDDS с почвами. 2. Комплексы металл-EDDS в незагрязненных и загрязненных металлами почвах». Environ. Sci. Technol . 43 (3): 837– 842. Bibcode :2009EnST...43..837T. doi :10.1021/es8020292. PMID 19245024.


