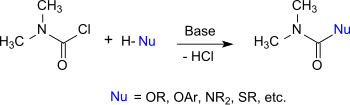Диметилкарбамоилхлорид
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Диметилкарбамоилхлорид | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
| Информационная карта ECHA | 100.001.099 |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| C3H6ClNO | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Диметилкарбамоилхлорид ( DMCC ) — реагент для переноса диметилкарбамоильной группы на спиртовые или фенольные гидроксильные группы, образующие диметилкарбаматы, обычно обладающие фармакологической или пестицидной активностью. Из-за его высокой токсичности и канцерогенных свойств, продемонстрированных в экспериментах на животных и, предположительно, также на людях, [1] диметилкарбамоилхлорид можно использовать только при соблюдении строгих мер безопасности.
Производство и возникновение
Производство диметилкарбамоилхлорида из фосгена и диметиламина было описано еще в 1879 году (зарегистрировано как «Dimethylharnstoffchlorid» – хлорид диметилмочевины). [2]
DMCC может быть получен с высоким выходом (90%) при 275 °C путем взаимодействия фосгена с газообразным диметиламином в проточном реакторе . [3] Для подавления образования мочевины используют избыток фосгена (в соотношении 3:1).
Реакция может быть также проведена в лабораторном масштабе с дифосгеном или трифосгеном и водным раствором диметиламина в двухфазной системе бензол – ксилол и вода в реакторе с перемешиванием с гидроксидом натрия в качестве поглотителя кислоты. Однако, значительно более низкие выходы (56%) достигаются из-за чувствительности DMCC к гидролизу. [4]
Диметилкарбамоилхлорид также образуется (вместе с метилхлоридом ) при реакции фосгена с триметиламином . [5]
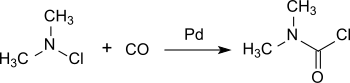
Более современный процесс основан на хлордиметиламине, который практически количественно преобразуется в диметилкарбамоилхлорид на палладиевом катализаторе под давлением с оксидом углерода при комнатной температуре . [6]
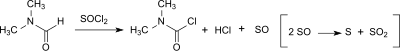
DMCC может также образовываться в небольших количествах (до 20 ppm) из диметилформамида (ДМФ) в реакции Вильсмейера-Хаака [7] или когда ДМФ используется в качестве катализатора в реакции карбоновых кислот с тионилхлоридом до соответствующего ацилхлорида . [8]
Тенденция к образованию DMCC зависит от реагента хлорирования ( тионилхлорид > оксалилхлорид > оксихлорид фосфора ) и выше в присутствии основания . Однако дикарбамоилхлорид очень быстро гидролизуется до диметиламина, соляной кислоты и диоксида углерода (с периодом полураспада около 6 минут при 0 °C), так что в продукте Вильсмейера после водной обработки обнаруживается менее 3 ppm дикарбамоилхлорида. [9]
Характеристики
Диметилкарбамоилхлорид — прозрачная, бесцветная, едкая и легковоспламеняющаяся жидкость с резким запахом и слезоточивым эффектом, которая быстро разлагается в воде. [10] Из-за своих неприятных, токсичных, мутагенных и канцерогенных свойств [11] [12] его следует использовать с крайними мерами предосторожности.
DMCC ведет себя как ацилхлорид, атом хлора которого может быть обменен на другие нуклеофилы . Поэтому он реагирует со спиртами , фенолами и оксимами в соответствующие N , N - диметилкарбаматы , с тиолами в тиолоуретаны, с аминами и гидроксиламинами в замещенные мочевины , а с имидазолами и триазолами в карбамоилазолы. [10]
DMCC менее реакционноспособен и менее селективен к субстратам с несколькими нуклеофильными центрами, чем обычные ацилхлориды.
Ненасыщенные сопряженные альдегиды, такие как кротоновый альдегид ( транс -бут-2-еналь), реагируют с DMCC, образуя диенилкарбаматы, которые можно использовать в качестве диенов в реакциях Дильса-Альдера . [13]
Карбоксилаты щелочных металлов реагируют с DMCC, образуя соответствующие диметиламиды. DMCC реагирует с безводным карбонатом натрия [14] или с избытком диметиламина, образуя тетраметилмочевину . [15]
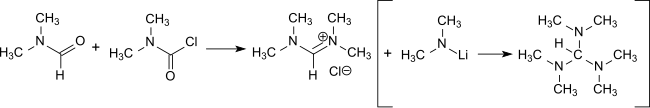
Реакция DMCC с DMF образует хлорид тетраметилформамидиния [16] , который является основным промежуточным продуктом в получении трис(диметиламино)метана , реагента для введения енаминовых функций в сочетании с активированными метиленовыми группами [17] и получения амидинов. [18]
DMCC является исходным материалом для инсектицидного класса диметилкарбаматов, которые действуют как ингибиторы ацетилхолинэстеразы , включая диметилан [19] и родственные ему соединения изолан, пиримикарб и триазамат.
Четвертичные аммониевые соединения неостигмин [20] находят фармацевтическое применение в качестве ингибиторов ацетилхолинэстеразы . Его получают из 3-(диметиламино)фенола и DMCC с последующей кватернизацией с метилбромидом или диметилсульфатом [21]
и пиридостигмин , который можно получить из 3-гидроксипиридина и DMCC и последующей реакции с метилбромидом. [22]
DMCC также используется в синтезе бензодиазепина камазепама . [23]
Смотрите также
Ссылки
- ^ Pohanish, RP (2011). Справочник Ситтига по токсичным и опасным химическим веществам и канцерогенам (6-е изд.). Амстердам: Elsevier. С. 1045–1047. ISBN 978-1-4377-7869-4.
- ^ Михлер, В.; Эшерих, К. (1879). «Ueber mehrfach substituirte Harnstoffe» [О многократно замещенных мочевинах]. Berichte der Deutschen Chemischen Gesellschaft (на немецком языке). 12 (1): 1162–1164. дои : 10.1002/cber.187901201303.
- ^ Слокомб, Р. Дж.; Харди, Е. А.; Сондерс, Дж. Х.; Дженкинс, Р. Л. (1950). «Производные фосгена. Получение изоцианатов, карбамилхлоридов и циануровой кислоты». Журнал Американского химического общества . 72 (5): 1888–1891. doi :10.1002/ja01161a009 (неактивен 2024-09-19).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на сентябрь 2024 г. ( ссылка ) - ^ Каримипур, Г.; Коукаби, С.; Нагиха, А. (2015). «Новые аминопорфирины, несущие заместители производных мочевины: синтез, характеристика, антибактериальная и противогрибковая активность». Бразильские архивы биологии и технологии . 58 (3): 431–442. doi : 10.1590/S1516-8913201500024 .
- ^ Бабад, Х.; Цайлер, АГ (1973). «Химия фосгена». Chemical Reviews . 73 (1): 75–91. doi :10.1021/cr60281a005.
- ^ Saegusa, T.; Tsuda, T.; Isegawa, Y. (1971). «Образование карбамоилхлорида из хлорамина и оксида углерода». Журнал органической химии . 36 (6): 858–860. doi :10.1021/jo00805a033.
- ^ Stare, M.; Laniewski, K.; Westermark, A.; Sjögren, M.; Tian, W. (2009). «Исследование образования и гидролиза N , N -диметилкарбамоилхлорида (DMCC) в реакциях Вильсмейера с использованием ГХ/МС в качестве метода аналитического обнаружения». Organic Process Research & Development . 13 (5): 857–862. doi :10.1021/op900018f.
- ^ Левин, Д. (1997). «Потенциальные токсикологические проблемы, связанные с хлорированием карбоновых кислот и другими реакциями». Organic Process Research & Development . 1 (2): 182. doi :10.1021/op970206t.
- ^ Куин, А. (1967). «Кинетика гидролиза ацилхлоридов в чистой воде». Канадский журнал химии . 45 (14): 1619–1629. doi : 10.1139/v67-264 .
- ^ ab Kreutzberger, CB; Olofson, RA (2001). "Диметилкарбамоилхлорид". Энциклопедия реагентов для органического синтеза e-EROS . doi :10.1002/047084289X.rd319. ISBN 0-471-93623-5.
- ^ Ягер, П.; Рентзеа, Китай; Кечка, Х. (2014). «Карбаматы и карбамоилхлорид». Тонкая химия Ульмана . Вайнхайм: Wiley-VCH. стр. 57–58. ISBN 978-3-527-33477-3.
- ^ "Диметилкарбамоилхлорид, CAS № 79-44-7" (PDF) . Отчет о канцерогенах (13-е изд.). Национальная токсикологическая программа, Министерство здравоохранения и социальных служб . Получено 25.09.2016 .
- ^ De Cusati, PF; Olofson, RA (1990). «Простой синтез 1-(1,3-бутадиенил)карбонатов и карбаматов». Tetrahedron Letters . 31 (10): 1405–1408. doi :10.1016/S0040-4039(00)88817-6.
- ^ Лоусон, Дж. К. Мл.; Крум, Дж. А. Т. (1963). «Диметиламиды из щелочных карбоксилатов и диметилкарбамоилхлорида». Журнал органической химии . 28 (1): 232–235. doi :10.1021/jo1036a513 (неактивен 2024-09-19).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на сентябрь 2024 г. ( ссылка ) - ↑ US 3597478, Weakly, ML, «Подготовка тетраметилмочевины», выдан 03.08.1971, передан Nipak Inc.
- ^ Арнольд, З. (1959). «Получение солей тетраметилформамидиния и их винилогов». Сборник чехословацких химических сообщений . 24 (3): 760–765. doi :10.1135/cccc19590760.
- ^ Меервейн, Х.; Флориан, В.; Шен, Н.; Стопп, Г. (1961). «Über Säureamidacetale, Harnstoffacetale und Lactamacetale» [О кислых ацеталях амидов, ацеталях мочевины и ацеталях лактама]. Юстус Либигс Annalen der Chemie (на немецком языке). 641 (1): 1–39. дои : 10.1002/jlac.19616410102.
- ^ Бредерек, Х.; Эффенбергер, Ф.; Брендл, Т. (1966). «Синтез и реакции трисдиметиламинометана» [Синтез и реакции трис (диметиламино) метана] (PDF) . Angewandte Chemie (на немецком языке). 78 (2): 147–148. Бибкод : 1966АнгЧ..78..147Б. дои : 10.1002/ange.19660780212.
- ^ US 3452043, Grauer, T. & Urwyler, H., "Производство 1- N , N -диметилкарбамоил-5-метил-3- N , N -диметилкарбамоилоксипиразола", выдан 24 июня 1969 г., передан JR Geigy AG
- ^ Эшлиманн, JA; Рейнерт, М. (1931). «Фармакологическое действие некоторых аналогов физостигмина». Журнал фармакологии и экспериментальной терапии . 43 (3): 413–444.
- ↑ US 1905990, Aeschlimann, JA, «Двузамещенные эфиры карбаминовой кислоты и фенолов, содержащие основной компонент», выдан 25 апреля 1933 г., передан Hoffmann-La Roche Inc.
- ↑ US 2572579, Urban, R., «Двузамещенные эфиры карбаминовой кислоты солей 3-гидрокси-1-алкилпиридиния», выдан 23 октября 1951 г., передан Hoffmann-La Roche Inc.
- ^ DE 2558015, "Verfahren zur Herstellung des 3- N , N -Dimethylcarbamoyl-oxy-1-methyl-5-phenyl-7-chlor-1,3-dihydro-2H- 1,4 -benzodiazepin-2-on (Способ получения 3- N , N -dimethylcarbamoyloxy-1-methyl-5-phenyl-7-chloro-1,3-dihydro-2H- 1,4 -benzodiazepin-2-one)", выдан 1976-09-16, назначен Siphar SA