Диабет и глухота
| Диабет и глухота (DAD) | |
|---|---|
| Другие имена | Сахарный диабет и глухота, наследуемые по материнской линии (MIDD); Синдром диабета-глухоты, передающийся по материнской линии; Синдром Баллингера-Уоллеса; Инсулиннезависимый сахарный диабет с глухотой; Сахарный диабет, тип II, с глухотой |
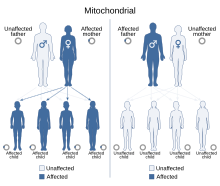 | |
| Это состояние наследуется по митохондриальному типу наследования. | |
| Симптомы | Инсулиннезависимый диабет, глухота, также могут наблюдаться системные симптомы, включая нарушения со стороны глаз, мышц, мозга, почек, сердца и желудочно-кишечного тракта, редко эндокринные нарушения и остеопороз. |
| Причины | Мутация в MT-TL1 , MT-TE или MT-TK |
| Дифференциальная диагностика | Митохондриальное заболевание |
Диабет и глухота ( DAD ) или наследуемый по материнской линии диабет и глухота ( MIDD ) или митохондриальный диабет — это подтип диабета , который вызывается мутацией в митохондриальной ДНК , которая состоит из кольцевого генома. Он связан с генами MT-TL1 , MT-TE и MT-TK . [1] Точечная мутация в позиции 3243A>G в гене MT-TL1, кодирующем тРНК лейцин 1, является наиболее распространенной. [1] [2] [3] Поскольку митохондриальная ДНК передается эмбриону ооцитом , а не сперматозоидами , это заболевание наследуется только от членов семьи по материнской линии. [2] Как следует из названия, MIDD характеризуется диабетом и нейросенсорной потерей слуха . [2] У некоторых людей также наблюдаются более системные симптомы, включая нарушения со стороны глаз, мышц, мозга, почек, сердца и желудочно-кишечного тракта, схожие с другими митохондриальными заболеваниями . [4] [5] [6]
Признаки и симптомы
Как следует из названия, пациенты с MIDD подвержены сенсоневральной потере слуха . [2] Это начинается со снижения восприятия частот выше примерно 5 кГц , которое постепенно снижается с годами до тяжелой потери слуха на всех частотах . [2] Диабет, который сопровождает потерю слуха, может быть похож на диабет 1-го типа или диабет 2-го типа ; однако диабет 1-го типа является более распространенной формой из двух. MIDD также был связан с рядом других проблем, включая дисфункцию почек , желудочно-кишечные проблемы и кардиомиопатию . [4]
В глазах MIDD характеризуется прогрессирующей атрофией пигментного эпителия сетчатки . Первоначально фовеа не затронута. Таким образом, у пациентов часто сохраняется хорошая острота зрения. Однако со временем области атрофии расширяются с возможной потерей центрального зрения. [7]
Таблица 1: Метаболически активные органы, которые могут быть затронуты митохондриальной точечной мутацией и связанными с ней осложнениями: [1] [2] [5] [6]
| Орган, пораженный | Сопутствующее осложнение |
|---|---|
| Ухо ( улитка ) | Сенсоневральная потеря слуха |
| Мозг ( Гипоталамус ) | Низкий рост |
| Мозг (общий) | Инсульты, судороги, атрофия мозжечка или головного мозга , атаксия , заболевания центральной нервной системы , энцефалотрофия, кальцификация базальных ганглиев , мигрень, инфаркт мозга , дизартрия |
| Глаз | Дистрофия желтого пятна, дегенерация желтого пятна , пролиферативная ретинопатия , наружная офтальмоплегия , птоз |
| Сердце | Застойная сердечная недостаточность , гипертрофия желудочков , аритмия |
| Почка | Фокально-сегментарный гломерулосклероз , нефропатия |
| Кишечник | Мальабсорбция или запор |
| Мышцы | Митохондриальная миопатия , периферическая нейропатия |
| Яички | Гипогонадизм |
| Надпочечники | Гипоальдостеронизм |
| Кости | Остеопороз |
Генетика
Пенетрантность и возраст начала
MIDD составляет 1% людей, страдающих диабетом . Более 85% людей, имеющих мутацию в митохондриальной ДНК в позиции 3243, проявляют симптомы диабета. Средний возраст, в котором обычно диагностируют людей с MIDD, составляет 37 лет, но, как было замечено, он колеблется от 11 до 68 лет. Из этих людей с диабетом, имеющих мутацию митохондриальной ДНК в позиции 3243, 75% испытывают нейросенсорную потерю слуха . [2] В этих случаях потеря слуха обычно появляется до начала диабета и характеризуется снижением восприятия высоких тональных частот. [4] Связанная с диабетом потеря слуха обычно встречается чаще и быстрее снижается у мужчин, чем у женщин. [8]
Влияние мутации на tRNALeu(UUR)
Митохондрии имеют собственный кольцевой геном , содержащий 37 генов , из которых 22 кодируют тРНК . [9] Эти тРНК играют важную роль в синтезе белка, транспортируя аминокислоты в рибосому . [2] MIDD вызван заменой A на G в митохондриальной ДНК в позиции 3243, которая кодирует тРНКLeu(UUR). [2] Эта мутация обычно находится в гетероплазматической форме. Мутация в этом гене (A3243G) приводит к дестабилизации нативной конформации , а также к димеризации в тРНКLeu(UUR). Уридин в первой позиции антикодона тРНКLeu(UUR) обычно посттранскрипционно модифицируется для обеспечения правильного распознавания кодона . Такая модификация известна как модификация таурина , которая уменьшается в результате неправильной структуры тРНКLeu(UUR). [10] Неправильная структура тРНКLeu(UUR) также приводит к снижению аминоацилирования . [9] Было также показано, что мутация приводит к снижению функции тРНК и , следовательно, синтеза белка . [11]
Характеристики диабета
Мутация A3243G в митохондриальной ДНК может присутствовать в любой ткани, однако она чаще присутствует в тканях с более низкой скоростью репликации , таких как мышцы . [4] Наличие этой мутации может привести к снижению потребления кислорода в результате снижения функции дыхательной цепи и снижения окислительного фосфорилирования . [12] Предполагается , что у некоторых людей это снижение функции дыхательной цепи вызвано несбалансированным количеством белков , которые кодируются митохондриальной ДНК , из-за наличия мутации A3243G. [4] Однако у других людей генерируется такое же количество митохондриальных белков , но их стабильность нарушена из-за неправильного включения аминокислот в кодоны UUR митохондриальных мРНК . Это является результатом мутировавшей тРНКLeu(UUR) с ее сниженной функцией в синтезе белка . [12] Снижение функции дыхательной цепи в результате мутации митохондриальной ДНК может привести к снижению выработки АТФ . Это снижение АТФ может иметь пагубные последствия для других процессов в организме. Одним из таких процессов является секреция инсулина бета-клетками поджелудочной железы . [4] В бета-клетках поджелудочной железы точные уровни АТФ / АДФ регулируют открытие и закрытие канала КАТФ, который контролирует секрецию инсулина . Когда мутации в митохондриях нарушают соотношение АТФ / АДФ , этот канал не может функционировать должным образом, и это может привести к дефициту инсулина у человека . [4] Поскольку возраст начала заболевания наступает позже в жизни человека, было высказано предположение, что возраст играет определенную роль в содействии, наряду со сниженным соотношением АТФ / АДФ , медленному ухудшению функции В-клеток . [4]
Характеристики глухоты
Потеря слуха , вызванная мутацией митохондриальной ДНК 3243 , проявляется в форме прогрессирующей кохлеарной дисфункции. Хотя механизм, посредством которого мутация в тРНКLeu(UUR) вызывает эту дисфункцию улитки, все еще изучается, была выдвинута гипотеза, что она задействует ионные насосы, необходимые для передачи звука . [13] Поскольку мутация в тРНКLeu(UUR) приводит к несбалансированному количеству или нестабильным ферментам дыхательной цепи , дыхание и окислительное фосфорилирование снижаются, что приводит к снижению уровня АТФ . [4] [12] Естественно, что наиболее метаболически активные органы человека будут затронуты этим дефицитом АТФ . В эти метаболически активные органы входит сосудистая полоска улитки . [2] Сосудистая полоска и волосковые клетки , которые необходимы для передачи звука, используют ионные насосы для регулирования концентрации ионов, включая K+, Na+ и Ca2+, используя АТФ . Без достаточного уровня АТФ эти градиенты концентрации не поддерживаются, и это может привести к гибели клеток как в сосудистой полоске, так и в волосковых клетках , вызывая потерю слуха. [13]
Диагноз
Физические осмотры, анализы крови, семейный анамнез, биопсия, ДНК-тестирование . [6] Мутации в митохондриальных генах MT-TE , MT-TL1 и MT-TK связаны с MIDD. [1] Наиболее распространенной мутацией является переход 3243A>G в митохондриальном гене тРНК-лейцина 1 (MT-TL1). [1]
Уход
Исходный
Первоначально человека лечат диетическими изменениями и гипогликемическими средствами. Это длится недолго, прежде чем человеку приходится начинать принимать инсулин (в течение 2 лет после постановки диагноза). [14]
Смотрите также
Ссылки
- ^ abcde "Диабет и глухота, наследуемые по материнской линии; MIDD". Онлайн Менделевское наследование у человека (OMIM) . Получено 2024-03-02 .
- ^ abcdefghij Murphy R, Turnbull DM, Walker M, Hattersley AT (апрель 2008 г.). «Клинические особенности, диагностика и лечение наследуемого по материнской линии диабета и глухоты (MIDD), связанных с митохондриальной точечной мутацией 3243A>G». Diabetic Medicine . 25 (4): 383–99 . doi :10.1111/j.1464-5491.2008.02359.x. PMID 18294221. S2CID 205548877.
- ^ de Andrade PB, Rubi B, Frigerio F, van den Ouweland JM, Maassen JA, Maechler P (август 2006 г.). «Связанная с диабетом мутация митохондриальной ДНК A3243G нарушает клеточные метаболические пути, необходимые для функционирования бета-клеток». Diabetologia . 49 (8): 1816– 1826. doi :10.1007/s00125-006-0301-9. PMID 16736129.
- ^ abcdefghi Маассен Дж.А., Т Харт Л.М., Ван Эссен Э., Хейне Р.Дж., Найпельс Г., Джахангир Тафречи Р.С. и др. (февраль 2004 г.). «Митохондриальный диабет: молекулярные механизмы и клиническая картина». Диабет . 53 (Дополнение 1): S103 – S109 . doi :10.2337/diabetes.53.2007.S103. ПМИД 14749274.
- ^ ab Finsterer J, Frank M (сентябрь 2018 г.). «Вершина айсберга в наследуемом по материнской линии диабете и глухоте». Oman Medical Journal . 33 (5): 437– 440. doi :10.5001/omj.2018.80. PMC 6131922. PMID 30210725 .
- ^ abc Yang M, Xu L, Xu C, Cui Y, Jiang S, Dong J и др. (ноябрь 2021 г.). «Мутации и клиническая изменчивость при наследуемом по материнской линии диабете и глухоте: анализ 161 пациента». Frontiers in Endocrinology . 12 : 728043. doi : 10.3389/fendo.2021.728043 . PMC 8654930. PMID 34899594.
- ^ Müller PL, Treis T, Pfau M, Esposti SD, Alsaedi A, Maloca P и др. (Май 2020 г.). «Прогрессирование ретинопатии, вторичной по отношению к унаследованному по материнской линии диабету и глухоте — оценка прогностических параметров». American Journal of Ophthalmology . 213 : 134–144 . doi : 10.1016/j.ajo.2020.01.013. PMID 31987901. S2CID 210935778.
- ^ Уймонен С., Мойланен Дж.С., Сорри М., Хасинен И.Е., Маджамаа К. (апрель 2001 г.). «Нарушение слуха у пациентов с мутацией мтДНК 3243A -> G: фенотип и скорость прогрессирования». Генетика человека . 108 (4): 284–289 . doi : 10.1007/s004390100475. PMID 11379873. S2CID 20513165.
- ^ ab Wittenhagen LM, Kelley SO (август 2002). «Димеризация патогенной человеческой митохондриальной тРНК». Nature Structural Biology . 9 (8): 586–590 . PMID 12101407.
- ^ Suzuki T, Suzuki T, Wada T, Saigo K, Watanabe K (декабрь 2002 г.). «Таурин как составная часть митохондриальных тРНК: новое понимание функций таурина и митохондриальных заболеваний человека». The EMBO Journal . 21 (23): 6581– 6589. doi :10.1093/emboj/cdf656. PMC 136959. PMID 12456664 .
- ^ Flierl A, Reichmann H, Seibel P (октябрь 1997 г.). «Патофизиология мутации перехода MELAS 3243». Журнал биологической химии . 272 (43): 27189– 27196. doi : 10.1074/jbc.272.43.27189 . PMID 9341162.
- ^ abc Janssen GM, Maassen JA, van Den Ouweland JM (октябрь 1999 г.). «Связанная с диабетом мутация 3243 в гене митохондриальной тРНК (Leu(UUR)) вызывает тяжелую митохондриальную дисфункцию без сильного снижения скорости синтеза белка». Журнал биологической химии . 274 (42): 29744– 29748. doi : 10.1074/jbc.274.42.29744 . PMID 10514449.
- ^ ab Yamasoba T, Oka Y, Tsukuda K, Nakamura M, Kaga K (январь 1996 г.). «Слуховые данные у пациентов с наследственным по материнской линии диабетом и глухотой, имеющих точечную мутацию в гене митохондриальной транспортной РНК (Leu) (UUR)». The Laryngoscope . 106 (1 Pt 1): 49– 53. doi : 10.1097/00005537-199601000-00010. PMID 8544627. S2CID 44601058.
- ^ "Митохондриальный диабет - Другие типы сахарного диабета". Diapedia, Живой учебник диабета . Получено 2018-02-06 .