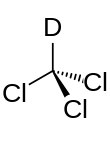
Дейтерированный хлороформ
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК трихлор(дейтерио)метан [1] | |||
| Другие имена Хлороформ- d Дейтерохлороформ | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 1697633 | |||
| ЧЭБИ | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.011.585 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| УНИИ | |||
| Номер ООН | 1888 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| CDCl3 | |||
| Молярная масса | 120,384 г/моль | ||
| Появление | Бесцветная жидкость. | ||
| Запах | хлороформоподобный | ||
| Плотность | 1.500 г/см 3 | ||
| Температура плавления | −64 °C (−83 °F; 209 K) | ||
| Точка кипения | 61 °C (142 °F; 334 К) | ||
| Опасности | |||
| Маркировка СГС : | |||
   | |||
| Опасность | |||
| Х302 , Х315 , Х319 , Х331 , Х336 , Х351 , Х361 , Х372 , Х373 | |||
| Р201 , Р202 , Р260 , Р261 , Р264 , Р270 , Р271 , Р280 , Р281 , Р301+Р312 , Р302+Р352 , Р304+Р340 , Р305+Р351+Р338 , Р308+Р313 , Р311 , Р312 , Р314 , Р321 , Р330 , Р332+Р313 , Р337+Р313 , Р362 , Р403+Р233 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Родственные соединения | Хлороформ | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Дейтерированный хлороформ , также известный как хлороформ -d , является органическим соединением с формулой CDCl 3 . Дейтерированный хлороформ является распространенным растворителем, используемым в ЯМР-спектроскопии . [2] Свойства CDCl 3 и обычного CHCl 3 ( хлороформа ) практически идентичны.
Дейтерохлороформ был впервые получен в 1935 году в годы исследований дейтерия . [3]
Подготовка
Дейтерированный хлороформ коммерчески доступен. Его легче производить и он менее дорогой, чем дейтерированный дихлорметан . [4] Дейтерохлороформ получают реакцией гексахлорацетона с оксидом дейтерия , используя пиридин в качестве катализатора. Большая разница в температурах кипения между исходным материалом и продуктом облегчает очистку путем перегонки. [5] [6]
- O=C(CCl 3 ) 2 + D 2 O → 2 CDCl 3 + CO 2
Обработка хлораля дейтерооксидом натрия (NaOD) дает дейтерированный хлороформ. [7] [8]
ЯМР растворитель
В протонной ЯМР- спектроскопии дейтерированный растворитель (обогащенный до >99% дейтерия) обычно используется, чтобы избежать регистрации большого мешающего сигнала или сигналов от протона(ов) (т. е. водорода-1), присутствующего в самом растворителе. Если бы в качестве растворителя использовался недейтерированный хлороформ (содержащий полный эквивалент протия), сигнал растворителя почти наверняка подавил бы и скрыл бы любые близлежащие сигналы аналита. Кроме того, современные приборы обычно требуют присутствия дейтерированного растворителя, поскольку частота поля блокируется с использованием сигнала дейтерия растворителя для предотвращения дрейфа частоты. Коммерческий хлороформ- d , однако, все еще содержит небольшое количество (0,2% или менее) недейтерированного хлороформа; это приводит к небольшому синглету при 7,26 ppm, известному как остаточный пик растворителя, который часто используется в качестве внутреннего эталона химического сдвига.
В спектроскопии ЯМР углерода-13 единственный углерод в дейтерированном хлороформе показывает триплет при химическом сдвиге 77,16 ppm, причем три пика имеют примерно одинаковый размер, что является результатом расщепления спиновой связью с присоединенным атомом дейтерия со спином 1 ( CHCl 3 имеет химический сдвиг 77,36 ppm). [4]
Дейтерированный хлороформ является универсальным растворителем ЯМР, поскольку он не очень химически активен и вряд ли обменяет свой дейтерий на растворенное вещество, [9] а его низкая температура кипения позволяет легко извлекать образец. Однако он несовместим с сильно основными, нуклеофильными или восстанавливающими аналитами, включая многие металлоорганические соединения.
Опасности
Хлороформ фотохимически реагирует с кислородом, образуя хлор , фосген и хлористый водород . Чтобы замедлить этот процесс и снизить кислотность растворителя, хлороформ- d хранят в коричневых тонированных бутылках, часто над медной стружкой или серебряной фольгой в качестве стабилизатора. Вместо металлов можно добавить небольшое количество нейтрализующего основания, такого как карбонат калия . [10] Он менее токсичен для печени и почек, чем CHCl3 , из-за более сильной связи C−D по сравнению со связью C−H , что делает его несколько менее склонным к образованию деструктивного трихлорметильного радикала ( •CCl3 ) . [11] [12]
Ссылки
- ^ «Хлороформ-d».
- ^ Фулмер, Грегори Р.; Миллер, Александр Дж. М.; Шерден, Натаниэль Х.; Готтлиб, Хьюго Э.; Нудельман, Абрахам; Штольц, Брайан М.; Берко, Джон Э.; Голдберг, Карен И. (2010). «ЯМР-химические сдвиги следовых примесей: обычные лабораторные растворители, органика и газы в дейтерированных растворителях, имеющие отношение к металлоорганической химии» (PDF) . Металлоорганические соединения . 29 (9): 2176– 2179. doi :10.1021/om100106e.
- ^ Хлороформ-d (дейтерохлороформ), FW Breuer, J. Am. Chem. Soc. 1935, 57, 11, 2236–2237 (1 ноября 1935 г.) [1]
- ^ ab "Теория ЯМР – Растворители для спектроскопии ЯМР". Архивировано из оригинала 2016-03-03 . Получено 2014-01-23 .
- ^ Paulsen, PJ; Cooke, WD (1 сентября 1963 г.). «Подготовка дейтерированных растворителей для спектрометрии ядерного магнитного резонанса». Аналитическая химия . 35 (10): 1560. doi :10.1021/ac60203a072.
- ^ Захарани, Лия; Йохан, Мохд Рафи Бин; Хали, Надер Гаффари (2022). «Процесс экономии затрат и энергии для лабораторного производства хлороформа-d». Organic Process Research & Development . 26 (11): 3126– 3129. doi :10.1021/acs.oprd.2c00260. S2CID 253071632.
- ^ Клугер, Рональд (1964). «Удобное приготовление хлороформа-d1». Журнал органической химии. 29 (7): 2045-2046. doi:10.1021/jo01030a526.
- ^ Брейер, Ф. В. (1935). "Хлороформ-d (Дейтериохлороформ)1". Журнал Американского химического общества. 57 (11): 2236-2237. doi:10.1021/ja01314a058.
- ^ Sabot, Cyrille; Kumar, Kanduluru Ananda; Antheaume, Cyril; Mioskowski, Charles (2007-06-01). "Triazabicyclodecene: An Effective Isotope Exchange Catalyst in CDCl3". Журнал органической химии . 72 (13): 5001– 5004. doi :10.1021/jo070307h. ISSN 0022-3263. PMID 17530896.
- ^ Тейпель, Ян; Готтштейн, Вера; Хёльцле, Ева; Кальтенбах, Катя; Лахенмайер, Дирк В.; Кубалла, Томас (2022). «Простой и надежный метод смягчения разложения дейтерированного хлороформа для стабилизации восприимчивых образцов ЯМР». Химия . 4 (3): 776–785 . doi : 10.3390/chemistry4030055 . ISSN 2624-8549.
- ^ Голдштейн, Робин С. (2013). Токсичные взаимодействия. Хьюитт, Уильям Р., Хук, Джерри Б. Берлингтон: Elsevier Science. ISBN 978-1-4832-6970-2. OCLC 896796140.
- ^ Ахмадизаде, М.; Куо, Ч.-Х.; Хук, Дж. Б. (1981-07-01). «Нефротоксичность и гепатотоксичность хлороформа у мышей: Эффект замещения дейтерия». Журнал токсикологии и охраны окружающей среды . 8 ( 1– 2): 105– 111. Bibcode : 1981JTEH....8..105A. doi : 10.1080/15287398109530054. ISSN 0098-4108. PMID 7328696.