Устранение β-углерода
β-Углеродное отщепление ( бета -углеродное отщепление) — это тип реакции в металлоорганической химии , в которой аллильный лиганд, связанный с металлическим центром, распадается на соответствующий металл-связанный алкильный (арильный) лиганд и алкен . [1] Это подгруппа реакций отщепления. Хотя она менее распространена и менее понятна, чем β-гидридное отщепление , она является важным этапом в некоторых процессах полимеризации олефинов и органических реакциях, катализируемых переходными металлами. [2]
Обзор
Подобно β-гидридному элиминированию, β-углеродное элиминирование требует, чтобы металл имел открытое координационное место цис по отношению к алкильной группе для осуществления этой реакции. β-углеродное элиминирование обычно менее предпочтительно, чем гидридное элиминирование, поскольку связь металл-гидрид сильнее, чем связь металл-углерод для большинства металлов в каталитических реакциях . Принципы, управляющие β-алкильным элиминированием, не установлены экспериментально. Одной из причин этого является то, что разрыв связей C−C в присутствии других реакционноспособных связей C−H является редким событием, и системы, предназначенные для исследования реакции, сложнее разработать. [2]
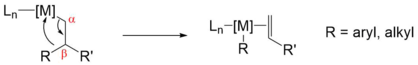
β-алкилирование элиминирование
Элиминирование β-алкила является наиболее распространенным и полезным типом среди всех реакций элиминирования β-углерода.
Классификация/Движущая сила
Элиминирование β-алкила с комплексами ранних переходных металлов
С точки зрения термодинамики , большее количество электронодефицитных металлических центров увеличивает вероятность элиминирования β-алкила. Например, элиминирование β-алкила более благоприятно, чем элиминирование β-гидрида, когда оно связано с электронодефицитными ранними переходными металлами (Hf, Ti, Zr, Nb и т. д.) с конфигурацией d 0. Вычислительные исследования показывают термодинамическое предпочтение элиминирования β-Me по сравнению с элиминированием β-H в этих комплексах из-за дополнительной стабильности для видов металл-алкил. [3] Происхождение дополнительного связывающего взаимодействия происходит из орбитали, центрированной на CH 3 , слабо π-донорной НСМО d 0 металлического центра, что аналогично эффекту гиперконъюгации (см. рисунок справа), тем самым увеличивая стабильность видов M−CH 3 по сравнению с видами M−H. Их расчеты предсказывают, что более электрофильный ион металла усиливает −CH 3 π-донорство, что, следовательно, увеличивает стабильность M−CH 3 по сравнению с видами M−H. Наоборот, более богатый электронами ион металла будет способствовать образованию M−H (например, используя более электронодонорный лиганд Cp* в Cp* 2 MX 2 ).
С точки зрения кинетики , стерические эффекты лигандов могут играть роль в увеличении энергетического барьера элиминирования β-H относительно элиминирования β-алкила, особенно когда лигандом является Cp*. Была предложена модель для иллюстрации этого эффекта: [4] Как при элиминировании β-метила (A), так и при элиминировании β-гидрида (B) переносящая группа выравнивается перпендикулярно Cp*(центроид)−Zr−Cp*(центроид), позволяя связи σ C−C или σ C−H перекрываться с d-орбиталью металла. Однако для достижения необходимой геометрии для элиминирования β-H (B) соседняя метильная группа испытывает значительное стерическое отталкивание от лиганда Cp*, тем самым повышая барьер для переноса гидрида. Напротив, переходное состояние A для элиминирования β-Me испытывает меньшее стерическое взаимодействие с лигандом Cp*.
Элиминирование β-алкила с комплексами металлов средней и поздней стадии перехода
В комплексах металлов средней и поздней стадии перехода наблюдается большее термодинамическое предпочтение элиминации β-H по сравнению с элиминацией β-алкила, где разница обычно составляет >15 ккал/моль. [2] Примеры, в которых участвуют комплексы металлов средней и поздней стадии перехода, либо не содержат β-водородов, либо используют снятие напряжения кольца и ароматичность в качестве движущих сил для предпочтения элиминации β-алкила по сравнению с элиминацией β-гидрида. [5]
Приложения
Полимеризация с раскрытием кольца (ROP)
Полимеризация с раскрытием кольца , включающая элиминирование β-алкила, может катализироваться катализатором на основе Ti, [6] Zr, [7] [8] Pd [9] и некоторыми металлоценовыми катализаторами на основе лантаноидов [10] [11], где различные модели полимеризации различаются, когда катализаторы различны. Также сообщалось о примерах сополимеризации с алкеном [10] или оксидом углерода [12] [13] . Ключевым этапом этого типа ROP является элиминирование β-алкила, управляемое струной, что обеспечивает линейный полимер с ненасыщенностью в полимерной цепи.
Органический синтез
Существует огромное количество каталитических процессов, включающих элиминирование β-алкила, которые полезны в синтетическом плане. Однако в этом случае элиминирование β-алкила часто рассматривается как альтернативный способ разрыва связи C–C, в то время как окислительное присоединение является прямым способом. [14] Одним из примеров является элиминирование β-алкила трет -алкоголятов, которое может образовываться либо при добавлении металлоорганического реагента, либо при обмене лигандами. [15] [16] [17] Получающиеся металлоорганические соединения могут подвергаться различным последующим реакциям (восстановительное элиминирование, вставка карбонила и т. д.) для получения полезных строительных блоков.
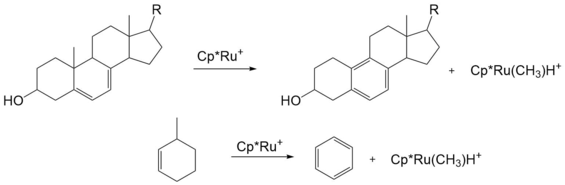
В дополнение к кольцевому напряжению, ароматичность-индуцированного устранения β-Ме может быть эффективно использована для деалкилирования производных стероидов и некоторых других циклогексильных соединений. [18] [19]
β-арильная элиминация
Элиминация β-арила встречается гораздо реже и менее понятна, чем элиминация β-алкила. Сообщается, что примеры происходят из алкоксидов металлов и амидных комплексов. [20] [21] [22] Теоретическое исследование показало, что эти реакции обусловлены последовательной обширной системой сопряжения. [23] Совсем недавний пример каталитической элиминации β-арила, которая приводит к энантиоселективному синтезу биарильных атропоизомеров , обусловлен высвобождением искаженной кольцевой цепочки. [24]
Ссылки
- ^ Смитс, Г.; Одик, Б.; Водрич, М.Д.; Корминбёф, К .; Крамер, Н. (24 августа 2017 г.). «Стратегия устранения β-углерода для удобного доступа in situ к циклопентадиенильным металлическим комплексам». Chemical Science . 8 (10): 7174– 7179. doi :10.1039/C7SC02986A. ISSN 2041-6520. PMC 5635420 . PMID 29081949. Wikidata Q42705934.
- ^ abc O'Reilly, Matthew E.; Dutta, Saikat; Veige, Adam S. (2016-07-27). "Устранение β-алкила: основные принципы и некоторые приложения". Chemical Reviews . 116 (14): 8105– 8145. doi :10.1021/acs.chemrev.6b00054. ISSN 0009-2665. PMID 27366938.
- ^ Sini, Gjergji; Macgregor, Stuart A.; Eisenstein, Odile; Teuben, Jan H. (апрель 1994 г.). «Почему элиминирование .beta.-Me наблюдается только в комплексах ранних переходных металлов d0? Эффект металлоорганического гиперконъюгирования с последствиями для стадии терминации в катализе Циглера-Натта». Organometallics . 13 (4): 1049– 1051. doi :10.1021/om00016a001. ISSN 0276-7333.
- ^ Eshuis, Johan JW; Tan, Yong Y.; Meetsma, Auke; Teuben, Jan H.; Renkema, Jaap; Evens, George G. (январь 1992 г.). «Кинетические и механистические аспекты олигомеризации пропена с ионными органоциркониевыми и -гафниевыми соединениями: кристаллические структуры [Cp*2MMe(THT)]+[BPh4]- (M = цирконий, гафний)» (PDF) . Organometallics . 11 (1): 362– 369. doi :10.1021/om00037a061. ISSN 0276-7333.
- ^ Миура, Масахиро; Сато, Тетсуя (2005-06-20), Цудзи, Дзиро (ред.), «Каталитические процессы, включающие устранение β-углерода», Палладий в органическом синтезе , т. 14, Springer Berlin Heidelberg, стр. 1–20 , doi :10.1007/b104133, ISBN 9783540239826
- ^ Росси, Р.; Диверси, П.; Порри, Л. (май 1972 г.). «О полимеризации метиленциклобутана с раскрытием кольца». Macromolecules . 5 (3): 247– 249. Bibcode :1972MaMol...5..247R. doi :10.1021/ma60027a004. ISSN 0024-9297.
- ^ Бесвик, Колин Л.; Маркс, Тобин Дж. (октябрь 2000 г.). «Влияние металл-алкильной группы на термодинамическую стабильность и стереохимическую подвижность пар ионов металлоцения Zr и Hf, полученных из B(C 6 F 5 ) 3 ». Журнал Американского химического общества . 122 (42): 10358– 10370. doi :10.1021/ja000810a. ISSN 0002-7863.
- ^ Jia, Li; Yang, Xinmin; Seyam, Affif M.; Albert, Israel DL; Fu, Peng-Fei; Yang, Shengtian; Marks, Tobin J. (январь 1996 г.). "Циглеровская полимеризация метиленциклоалканов с раскрытием кольца, катализируемая высокоэлектрофильными d 0 /fn металлоценами. Реакционная способность, область применения, механизм реакции и пути к функционализированным полиолефинам". Журнал Американского химического общества . 118 (34): 7900– 7913. doi :10.1021/ja960811w. ISSN 0002-7863.
- ^ Takeuchi, Daisuke; Kim, Sunwook; Osakada, Kohtaro (2001-07-16). "Ring-Opening Polymerization of 1-Methylene-2-phenylcyclopropane Catalyzed by a Pd Complex To Afford Regioregulated Polymers". Angewandte Chemie International Edition . 40 (14): 2685– 2688. doi :10.1002/1521-3773(20010716)40:14<2685::AID-ANIE2685>3.0.CO;2-9. ISSN 1433-7851.
- ^ ab Jensen, Tryg R.; O'Donnel, James J.; Marks, Tobin J. (февраль 2004 г.). "d 0 /fn -опосредованная полимеризация Циглера с раскрытием кольца (ROZP) и сополимеризация с моно- и дизамещенными метиленциклопропанами. Различные механизмы и новый процесс завершения цепи с укупориванием". Organometallics . 23 (4): 740– 754. doi :10.1021/om030407n. ISSN 0276-7333.
- ^ Yang, Xinmin; Seyam, AM; Fu, Peng-Fei; Mark, Tobin J. (август 1994). "экзо-метилен-функционализированные полиэтилены посредством полимеризации Циглера с раскрытием кольца. Управление продуктом в полимеризации/сополимеризации метиленциклопропана, катализируемой органолантаноидами". Macromolecules . 27 (16): 4625– 4626. Bibcode :1994MaMol..27.4625Y. doi :10.1021/ma00094a030. ISSN 0024-9297.
- ^ Кеттунен, Мика; Абу-Суррах, Аднан С; Репо, Тимо; Лескеля, Маркку (ноябрь 2001 г.). «Сополимеризация оксида углерода с экзо-метиленциклоалканом и диенами: синтез функционализированных алифатических поликетонов: синтез функционализированных алифатических поликетонов». Polymer International . 50 (11): 1223– 1227. doi :10.1002/pi.769.
- ^ Ким, Санвук; Такеучи, Дайсуке; Осакада, Котаро (февраль 2002 г.). «Pd-катализируемая сополимеризация с раскрытием кольца 2-арил-1-метиленциклопропанов с CO для получения поликетонов посредством чередующейся вставки двух мономеров и активации связи C−C трехчленного кольца». Журнал Американского химического общества . 124 (5): 762– 763. doi :10.1021/ja017460s. ISSN 0002-7863. PMID 11817946.
- ^ Dong, Guangbin, ред. (2014). Активация связи C–C . Темы в Current Chemistry. Том 346. Берлин, Гейдельберг: Springer Berlin Heidelberg. doi :10.1007/978-3-642-55055-3. ISBN 9783642550546. S2CID 60212270.
- ^ Мураками, Масахиро; Макино, Масаоми; Ашида, Синдзи; Мацуда, Таканори (сентябрь 2006 г.). «Построение углеродных каркасов посредством устранения β-углерода при посредничестве переходных металлов». Бюллетень химического общества Японии . 79 (9): 1315– 1321. doi : 10.1246/bcsj.79.1315 . ISSN 0009-2673.
- ^ Seiser, Tobias; Cramer, Nicolai (2009). «Энантиоселективная металл-катализируемая активация напряженных колец». Organic & Biomolecular Chemistry . 7 (14): 2835– 40. doi :10.1039/b904405a. ISSN 1477-0520. PMID 19582290.
- ^ Хаффман, Марк А.; Либескинд, Лэнни С. (ноябрь 1990 г.). «Внедрение (.eta.5-indeny)cobalt(I) в циклобутеноны: первый синтез фенолов из изолированных винилкетеновых комплексов». Журнал Американского химического общества . 112 (23): 8617– 8618. doi :10.1021/ja00179a075. ISSN 0002-7863.
- ^ Halcrow, Malcolm A.; Urbanos, Francisco; Chaudret, Bruno (март 1993). "Ароматизация B-кольца 5,7-диенилстероидов электрофильным рутениевым фрагментом "[Cp*Ru]+"". Металлоорганические соединения . 12 (3): 955– 957. doi :10.1021/om00027a054. ISSN 0276-7333.
- ^ Older, Christina M.; Stryker, Jeffrey M. (март 2000 г.). «Механизм активации связи углерод-углерод в катионных комплексах гидрида 6-алкилциклогексадиенила рутения». Журнал Американского химического общества . 122 (12): 2784– 2797. doi :10.1021/ja992987e. ISSN 0002-7863.
- ^ Чжао, Пинцзин; Инкарвито, Кристофер Д.; Хартвиг, Джон Ф. (март 2006 г.). «Прямое наблюдение β-арильных элиминаций из алкоксидов Rh(I)». Журнал Американского химического общества . 128 (10): 3124– 3125. doi :10.1021/ja058550q. ISSN 0002-7863. PMID 16522075.
- ^ Чжао, Пинцзин; Хартвиг, Джон Ф. (2005-08-24). «β-Арильные элиминации из Rh(I) иминильных комплексов». Журнал Американского химического общества . 127 (33): 11618– 11619. doi :10.1021/ja054132+. ISSN 0002-7863. PMID 16104735.
- ^ Терао, Ёсито; Вакуи, Хироюки; Сато, Тецуя; Миура, Масахиро; Номура, Масакацу (октябрь 2001 г.). «Катализируемое палладием арилативное расщепление связи углерод-углерод α,α-дизамещенных арилметанолов». Журнал Американского химического общества . 123 (42): 10407–10408 . doi :10.1021/ja016914i. ISSN 0002-7863. ПМИД 11604000.
- ^ Xue, Liqin; Ng, Ka Chun; Lin, Zhenyang (2009). «Теоретические исследования по удалению β-арилов из комплексов Rh(i)». Dalton Transactions (30): 5841– 5850. doi :10.1039/b902539a. ISSN 1477-9226. PMID 19623383.
- ^ Дэн, Жуйсянь; Си, Цзюньвэй; Ли, Циган; Гу, Чжэньхуа (май 2019 г.). «Энантиоселективное расщепление углерод-углеродной связи для синтеза биарильных атропоизомеров». Химия . 5 (7): 1834– 1846. doi : 10.1016/j.chempr.2019.04.008 .