КБД-ДМГ
 | |
| Идентификаторы | |
|---|---|
| |
| Номер CAS | |
| CID PubChem |
|
| ChemSpider |
|
| УНИИ |
|
| Панель инструментов CompTox ( EPA ) |
|
| Химические и физические данные | |
| Формула | С25Н38О2 |
| Молярная масса | 370,577 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
| |
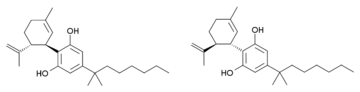
Каннабидиол-диметилгептил ( CBD-DMH или DMH-CBD ) — синтетический гомолог каннабидиола , в котором пентильная цепь заменена диметилгептильной цепью. Известно несколько изомеров этого соединения. Наиболее часто используемый в исследованиях изомер — (−)-CBD-DMH, имеющий ту же стереохимию , что и природный каннабидиол, и боковую цепь 1,1-диметилгептила. Это соединение не является психоактивным и действует в основном как ингибитор обратного захвата анандамида , но более мощное, чем каннабидиол, противосудорожное средство и имеет примерно такую же эффективность, как противовоспалительное средство . [1] [2] [3] [4] Неожиданно было обнаружено, что «неестественный» энантиомер (+)-CBD-DMH, имеющий обратную стереохимию по сравнению с каннабидиолом, является агонистом каннабиноидных рецепторов прямого действия с Ki 17,4 нМ при CB 1 и 211 нМ при CB 2 и вызывает типичные каннабиноидные эффекты в исследованиях на животных, [5] как и его производное 7-OH. [6]

Также было описано другое близкое аналогичное соединение, в котором двойная связь в циклогексеновом кольце смещена между 1,6-положениями, а не между 2,3-положениями (т. е. аналогично синтетическим аналогам ТГК, таким как парагексил ), изопропенильная группа насыщена до изопропила, а боковая цепь 1,2-диметилгептила. Он синтезируется восстановлением Берча из 1,2-диметилгептильного аналога каннабидиола . Это соединение также вызывает сильные каннабиноидоподобные эффекты у животных, но имеет три хиральных центра и состоит из смеси восьми стереоизомеров , которые не были изучены по отдельности, поэтому неизвестно, какие стереоизомеры активны. [7] [8]

Смотрите также
- 7-ОН-КБД
- Аномальный каннабидиол
- Каннабиноидные рецепторы
- Каннабидифорол
- Цис-ТГК
- ХУ-211
- HUF-101
- КЛС-13019
- О-1656
- О-1871
- О-1918
- Набилон
- Тетрагидроканнабифорол
- НЕСС-040C5
Ссылки
- ^ Leite JR, Carlini EA, Lander N, Mechoulam R (1982). «Противосудорожные эффекты (-) и (+)изомеров каннабидиола и их диметилгептильных гомологов». Фармакология . 24 (3): 141– 6. doi :10.1159/000137588. PMID 7071126.
- ^ Bisogno T, Hanus L, De Petrocellis L, Tchilibon S, Ponde DE, Brandi I, et al. (Октябрь 2001 г.). «Молекулярные мишени для каннабидиола и его синтетических аналогов: влияние на ваниллоидные рецепторы VR1 и на клеточное поглощение и ферментативный гидролиз анандамида». British Journal of Pharmacology . 134 (4): 845–52 . doi :10.1038/sj.bjp.0704327. PMC 1573017 . PMID 11606325.
- ^ Ben-Shabat S, Hanus LO, Katzavian G, Gallily R (февраль 2006 г.). «Новые производные каннабидиола: синтез, связывание с каннабиноидными рецепторами и оценка их противовоспалительной активности». Journal of Medicinal Chemistry . 49 (3): 1113– 7. doi :10.1021/jm050709m. PMID 16451075.
- ^ Juknat A, Kozela E, Kaushansky N, Mechoulam R, Vogel Z (май 2016 г.). «Противовоспалительные эффекты производного каннабидиола диметилгептил-каннабидиола — исследования на микроглии BV-2 и энцефалитогенных Т-клетках». Журнал базовой и клинической физиологии и фармакологии . 27 (3): 289–96 . doi : 10.1515/jbcpp-2015-0071 . PMID 26540221.
- ^ Hanus LO, Tchilibon S, Ponde DE, Breuer A, Fride E, Mechoulam R (март 2005 г.). «Энантиомерные производные каннабидиола: синтез и связывание с каннабиноидными рецепторами». Органическая и биомолекулярная химия . 3 (6): 1116– 23. doi :10.1039/B416943C. PMID 15750656.
- ^ Fride E, Ponde D, Breuer A, Hanus L (июнь 2005 г.). «Периферические, но не центральные эффекты производных каннабидиола: посредничество CB(1) и неопознанных рецепторов». Neuropharmacology . 48 (8): 1117– 29. doi :10.1016/j.neuropharm.2005.01.023. PMID 15910887. S2CID 16531395.
- ^ Раздан РК, Парс ХГ, Томпсон ВР, Гранчелли ФЭ (1974). «Литий-аммиачное восстановление тетрагидроканнабинолов». Tetrahedron Letters . 15 ( 49–50 ): 4315–4318 . doi :10.1016/S0040-4039(01)92152-5.
- ^ Раздан РК (1981). "Полный синтез каннабиноидов". В Apsimon J (ред.). Полный синтез натуральных продуктов . Wiley Interscience. стр. 245. ISBN 978-0-471-05460-3. OCLC 19487018.
