Соединения бора

Соединения бора — это соединения, содержащие элемент бор . В наиболее известных соединениях бор имеет формальную степень окисления +3. К ним относятся оксиды, сульфиды, нитриды и галогениды. [1]
Галогениды
Тригалогениды принимают плоскую тригональную структуру. Эти соединения являются кислотами Льюиса , поскольку они легко образуют аддукты с донорами электронных пар, которые называются основаниями Льюиса . Например, фторид (F− ) и трифторид бора (BF3 ) объединяются, чтобы дать анион тетрафторбората , BF4− . Трифторид бора используется в нефтехимической промышленности в качестве катализатора. Галогениды реагируют с водой, образуя борную кислоту . [1]
Кислородные соединения
Бор встречается в природе на Земле почти исключительно в виде различных оксидов B(III), часто связанных с другими элементами. Более ста минералов бората содержат бор в степени окисления +3. Эти минералы в некотором отношении напоминают силикаты , хотя бор часто встречается не только в тетраэдрической координации с кислородом, но и в тригональной плоской конфигурации. В отличие от силикатов, минералы бора никогда не содержат бор с координационным числом больше четырех. Типичный мотив представлен тетраборатными анионами обычного минерала буры , показанными слева. Формальный отрицательный заряд тетраэдрического центра бората уравновешивается катионами металлов в минералах, такими как натрий (Na + ) в буре . [1] Группа турмалина борат-силикатов также является очень важной группой минералов, содержащих бор, и известно, что в природе существует ряд боросиликатов . [2]
Бораны
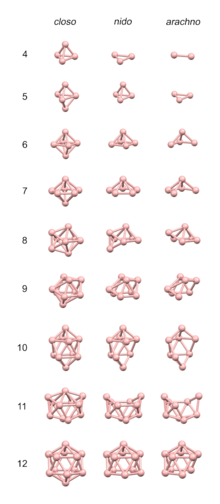
Бораны — это химические соединения бора и водорода с общей формулой B x H y . Эти соединения не встречаются в природе. Многие бораны легко окисляются при контакте с воздухом, некоторые бурно. Родительский элемент BH 3 называется бораном , но он известен только в газообразном состоянии и димеризуется с образованием диборана , B 2 H 6 . Все более крупные бораны состоят из кластеров бора, которые являются полиэдрическими, некоторые из которых существуют в виде изомеров. Например, изомеры B 20 H 26 основаны на слиянии двух 10-атомных кластеров.
Наиболее важными боранами являются диборан B2H6 и два продукта его пиролиза , пентаборан B5H9 и декаборан B10H14 . Известно большое количество анионных гидридов бора , например [ B12H12 ] 2− .
Формальная степень окисления в боранах положительна и основана на предположении, что водород считается как −1, как в активных гидридах металлов. Тогда средняя степень окисления для атомов бора — это просто отношение водорода к бору в молекуле. Например, в диборане B2H6 степень окисления бора равна +3, но в декаборане B10H14 она равна 7/5 или +1,4 . В этих соединениях степень окисления бора часто не является целым числом.
Нитриды
Нитриды бора примечательны разнообразием структур, которые они принимают. Они демонстрируют структуры, аналогичные различным аллотропам углерода , включая графит, алмаз и нанотрубки. В алмазоподобной структуре, называемой кубическим нитридом бора (торговое название Borazon ), атомы бора существуют в тетраэдрической структуре атомов углерода в алмазе, но одну из каждых четырех связей BN можно рассматривать как координатную ковалентную связь , в которой два электрона отдаются атомом азота, который действует как основание Льюиса , для связи с кислотным центром бора (III) Льюиса. Кубический нитрид бора, среди прочего, используется в качестве абразива, поскольку он имеет твердость, сравнимую с алмазом (два вещества способны царапать друг друга). В соединении BN, аналоге графита, гексагональном нитриде бора (h-BN), положительно заряженные атомы бора и отрицательно заряженные атомы азота в каждой плоскости лежат рядом с противоположно заряженным атомом в следующей плоскости. Следовательно, графит и h-BN имеют очень разные свойства, хотя оба являются смазками, поскольку эти плоскости легко скользят мимо друг друга. Однако h-BN является относительно плохим электрическим и тепловым проводником в плоскостных направлениях. [4] [5]
Борорганическая химия
Известно большое количество борорганических соединений, и многие из них полезны в органическом синтезе . Многие из них производятся путем гидроборирования , в котором используется диборан, B2H6, простое борановое химическое вещество. Борорганические соединения (III) обычно являются тетраэдрическими или тригональными плоскими, например, тетрафенилборат, [B(C6H5 ) 4 ] − против трифенилборана , B ( C6H5 ) 3 . Однако несколько атомов бора , реагирующих друг с другом , имеют тенденцию образовывать новые додекаэдрические (12-гранные) и икосаэдрические ( 20 -гранные) структуры, состоящие полностью из атомов бора или с различным числом гетероатомов углерода.
Борорганические химикаты использовались в самых разных областях, от карбида бора (см. ниже), сложной очень твердой керамики, состоящей из анионов и катионов кластера бор-углерод, до карборанов , соединений кластерной химии углерода-бора , которые могут быть галогенированы с образованием реакционноспособных структур, включая карборановую кислоту , суперкислоту . В качестве одного из примеров, карбораны образуют полезные молекулярные фрагменты, которые добавляют значительные количества бора к другим биохимическим веществам с целью синтеза борсодержащих соединений для нейтронной захватной терапии бора при лечении рака.
Соединения B(I) и B(II)
Как и предполагалось по его гидридным кластерам , бор образует множество стабильных соединений с формальной степенью окисления менее трех. B 2 F 4 и B 4 Cl 4 хорошо охарактеризованы. [6]

Бинарные соединения металла и бора, бориды металлов, содержат бор в отрицательных степенях окисления. Иллюстрацией является диборид магния (MgB2 ) . Каждый атом бора имеет формальный заряд −1, а магнию присвоен формальный заряд +2. В этом материале центры бора являются тригональными плоскими с дополнительной двойной связью для каждого бора, образуя листы, похожие на углерод в графите . Однако, в отличие от гексагонального нитрида бора, в котором отсутствуют электроны в плоскости ковалентных атомов, делокализованные электроны в дибориде магния позволяют ему проводить электричество подобно изоэлектронному графиту. В 2001 году было обнаружено, что этот материал является высокотемпературным сверхпроводником . [7] [8] Это сверхпроводник, находящийся в активной разработке. Проект ЦЕРНа по производству кабелей MgB 2 привел к созданию сверхпроводящих тестовых кабелей, способных выдерживать ток силой 20 000 ампер для приложений распределения чрезвычайно высокого тока, таких как предполагаемая версия большого адронного коллайдера с высокой светимостью . [9]
Некоторые другие бориды металлов находят специализированное применение в качестве твердых материалов для режущих инструментов. [10] Часто бор в боридах имеет дробные степени окисления, например, −1/3 в гексабориде кальция (CaB 6 ).
С точки зрения структуры наиболее характерными химическими соединениями бора являются гидриды. В эту серию входят кластерные соединения додекаборат ( B
12ЧАС2−
12), декаборан (B 10 H 14 ) и карбораны, такие как C 2 B 10 H 12 . Характерно, что такие соединения содержат бор с координационными числами больше четырех. [1]
Смотрите также
Ссылки
- ^ abcd Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Бор». Lehrbuch der Anorganischen Chemie (на немецком языке) (изд. 91–100). Вальтер де Грюйтер. стр. 814–864 . ISBN. 978-3-11-007511-3.
- ^ "Mindat.org - Mines, Minerals and More". mindat.org . Архивировано из оригинала 22 апреля 2011 г. Получено 4 августа 2019 г.
- ^ Уэлч, Алан Дж. (2013). «Значение и влияние правил Уэйда». Chem. Commun . 49 (35): 3615– 3616. doi :10.1039/C3CC00069A. PMID 23535980.
- ^ Engler, M. (2007). "Гексагональный нитрид бора (hBN) – применение от металлургии до косметики" (PDF) . Cfi/Ber. DKG . 84 : D25. ISSN 0173-9913. Архивировано (PDF) из оригинала 13 июня 2013 г. . Получено 8 января 2012 г. .
- ^ Грейм, Йохен и Шветц, Карл А. (2005). "Карбид бора, нитрид бора и бориды металлов". Карбид бора, нитрид бора и бориды металлов, в Энциклопедии промышленной химии Ульмана . Wiley-VCH: Weinheim. doi :10.1002/14356007.a04_295.pub2. ISBN 978-3527306732.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Джонс, Мортон Э. и Марш, Ричард Э. (1954). «Получение и структура борида магния, MgB2 » . Журнал Американского химического общества . 76 (5): 1434– 1436. doi :10.1021/ja01634a089.
- ^ Canfield, Paul C.; Crabtree, George W. (2003). «Диборид магния: лучше поздно, чем никогда» (PDF) . Physics Today . 56 (3): 34– 40. Bibcode :2003PhT....56c..34C. doi :10.1063/1.1570770. Архивировано (PDF) из оригинала 26 февраля 2012 г. . Получено 8 января 2012 г. .
- ^ "Категория "Новости+Статьи" не найдена - Сервер документов ЦЕРН". cds.cern.ch . Архивировано из оригинала 20 февраля 2022 г. . Получено 9 октября 2020 г. .
- ^ Кардарелли, Франсуа (2008). «Диборид титана». Справочник по материалам: краткий настольный справочник . стр. 638–639 . ISBN 978-1-84628-668-1. Архивировано из оригинала 8 января 2017 . Получено 5 января 2016 .