Ионы боранилия

В химии ион боранилия — это неорганический катион с химической формулой BR.+
2, где R представляет собой неспецифический заместитель. Будучи электронодефицитными, ионы боранилия образуют аддукты с основаниями Льюиса . Ионы боранилия имеют исторические названия, которые зависят от числа координированных лигандов: [1]
- [БР
2]+
: бориний - [БР
2Л]+
: борений - [БР
2Л
2]+
: борониум
Ионы борения
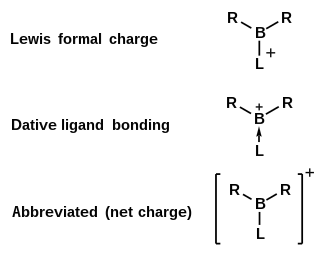
Ион борения — это неорганический катион с химической формулой [BR
2Л]+
. В этом классе молекул электронно-дефицитный борный центр имеет два валентных электрона, участвующих в сигма-связи с двумя лигандами, в то время как третий лиганд является донором двух электронов, так что общий заряд комплекса равен +1. [1] В зависимости от природы лигандов вокруг центрального бора этот положительный заряд может быть локализован на борном центре или делокализован по всей молекуле. [3] Ионы борения могут быть получены различными способами и представляют интерес для применения в органическом синтезе и катализе . [2]
Синтез
Синтетические методы получения ионов борения включают абстрагирование галогенидов, нуклеофильную диссоциацию и протонное присоединение к аминоборанам.
Галогенидная или гидридная абстракция

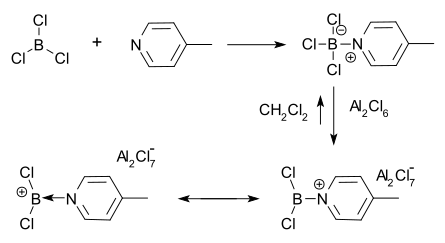
Ионы борения могут быть получены из тетракоординированных аддуктов кислоты Льюиса-основания галогенидов бора. В этом методе отщепление галогенида кислотой Льюиса, такой как AlCl 3, приводит к образованию катиона борения и аниона AlCl 4 − . [1] [5] Первый ион борения, который был выделен и охарактеризован, был получен Рышкевичем и Виггинсом в 1970 году с использованием этого метода. [4] Они обнаружили, что хлорид алюминия растворяется в дихлорметане в присутствии аддукта 4-метилпиридина и BCl 3 . Положительный заряд бора был затем выведен из протонной ЯМР- спектроскопии.
Подобно методу абстрагирования галогенида, ионы борения могут быть получены путем абстрагирования гидрида из тетракоординированного комплекса бора. [6]
Нуклеофильная диссоциация

Вытеснение лиганда из нейтрального трехкоординированного галогенида бора нейтральным донором, таким как пиридин, приводит к образованию катиона борения. [1] Для того чтобы эта реакция дала желаемый катион борения, лиганд должен быть хорошей уходящей группой, а нейтральный донор должен иметь достаточный стерический объем, чтобы нуклеофильная диссоциация была предпочтительнее образования аддукта кислоты и основания Льюиса с нейтральным исходным материалом BR 3 , как показали эксперименты по конкуренции. [7]
Протонное присоединение к аминоборанам
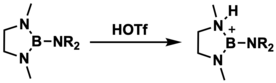
Аминобораны могут быть протонированы различными кислотами для получения ионов борения. Этот синтетический метод был разработан в 1983 году Нарулой и Нотом, которые использовали трифторметансульфоновую кислоту для протонирования 1,3-диметил-2-(диметиламино)-1,3,2-диазаборолидина; однако им не удалось кристаллизовать и структурно охарактеризовать этот конкретный катион. [7]
Протонирование не-Льюисовских кислотных оксазаборолидинов приводит к образованию ионов борения, которые могут быть использованы в качестве энантиоселективных катализаторов Дильса-Альдера . Эти N-протонированные виды борения были охарактеризованы с помощью ЯМР . [8]
Другие методы
Ионы борения также могут быть получены другими методами, такими как добавление основания к дикоординированному иону борения или путем метатезиса с солями со слабо координирующими анионами, такими как Ag[Al[OC(CF 3 ) 3 ] 4 ] или Li[Al[OC(CF 3 ) 3 ] 4 ]. [1] [9]
Структура и электроника
Ряд ионов борения были структурно охарактеризованы с помощью рентгеновской кристаллографии . Структуры ионов борения обычно имеют две короткие связи и одну более длинную связь, что характерно для дативной связи . Электронно-дефицитная природа борного центра многих ионов борения была подтверждена вычислительными и экспериментальными исследованиями. Обработка многих ионов борения методом анализа естественной популяции показывает, что борный центр действительно несет значительный положительный заряд. Например, катион BH 2 NH 3 + имеет естественный заряд +0,687 на боре. [10]
| Ион Борения | Естественный заряд на B | Занятость орбитали B 2p |
|---|---|---|
| BH2NH3 + | +0,687 | 0,023 |
| BCl2NH3 + | +0,566 | 0,460 |
| B ( CH3 ) 2NH3 + | +1.087 | 0,167 |
| BF2NH3 + | +1.412 | 0,289 |
В зависимости от природы лигандов вокруг центрального бора этот положительный заряд может быть локализован в центре бора или делокализован по всей молекуле. В некоторых случаях пи-донорные лиганды, расположенные в плоскости пустой p-орбитали бора, могут действовать, стабилизируя электронный дефицит бора. Расчеты теории функционала плотности (DFT) изолируемых ионов борения показывают, что сильнокислотный бор Льюиса может быть стабилизирован пи-донорством от ароматических заместителей, таких как пиридин. [6]
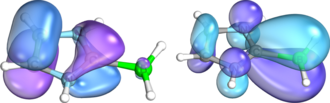
N-гетероциклические карбены (NHC) также могут быть использованы для стабилизации ионов борения посредством пи-сопряжения, хотя и действуют как более слабые пи-доноры, чем нейтральные N-доноры. [12] Энергия взаимодействия между фрагментом BH 2 + и различными NHC была рассчитана с использованием метода расширенного переходного состояния для анализа разложения энергии в сочетании с теорией естественных орбиталей для химической валентности (NOCV). Этот анализ показал чистый пи-донорный эффект лиганда NHC – в этом случае положительный заряд делокализован по всей пи-системе, а не локализован на боре. [11]
В других случаях наблюдалось, что дативный лиганд выкручивается из плоскости BR 3 из-за стерической тесноты. Эта неплоская геометрия приводит к уменьшению пи-донорства в борном центре, делая его еще более электронодефицитным. [1] Было обнаружено, что повышенная локализация заряда на боре увеличивает кислотность Льюиса борокатиона. Метод Гутмана-Беккета использовался многими исследователями в этой области для сравнения кислотности Льюиса этих катионов. [12]
Ранние кристаллические структуры катионов борения указывают на то, что соответствующий анион является некоординирующим. [7] Дальнейшие исследования показали, что реакционная способность борокатионов тесно связана с идентичностью его противоиона. В каталитических приложениях слабо координирующие анионы позволили получить наиболее активные катализаторы борения. Обычно используемым противоионом для катионов борения является тетракис(пентафторфенил)борат, B(C 6 F 5 ) 4 − ; однако возможны и другие противоионы, такие как AlCl 4 − , галогениды и трифлат. [1] [12] Синтетическая жизнеспособность иона борения часто определяется его реакционной способностью относительно его противоиона. Галогениды часто неспособны стабилизировать ионы борения, предпочитая вместо этого координироваться с центром бора, чтобы создать тетракоординированную разновидность. Систематическая оценка влияния противоионов на синтетическую жизнеспособность ионов NHC-дихлорборения была проведена Мутайей и его коллегами в 2013 году. [13]
Реакционная способность и применение
Ионы борения являются высококислотными по Льюису . Их кислотность по Льюису атома бора определяется электронными и стерическими эффектами его лигандов.
Активация водорода и химия FLP
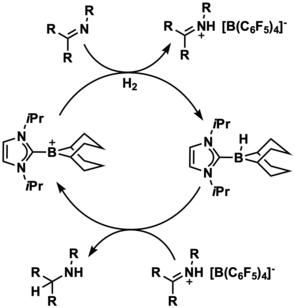
Было показано, что ионы борения, стабилизированные N-гетероциклическим карбеном (NHC), являются мощными катализаторами активации и гидрирования H 2 без металлов . В отличие от нейтральных боранов, обычно используемых в химии фрустрированных пар Льюиса (FLP) этого типа, ионы борения по своей природе являются электрофильными и не требуют лигандов, оттягивающих электроны, для выполнения этих активаций малых молекул. Поскольку заместители, оттягивающие электроны, могут препятствовать доставке гидрида во время катализа гидрирования, ионы борения могут быть более мощными катализаторами, чем нейтральные виды бора, поскольку они являются эффективными донорами гидрида. Действительно, в 2012 году Стефан и его коллеги смогли разработать систему FLP на основе борения, способную активировать H 2 стехиометрически в присутствии фосфина . [14]
В 2015 году Девиллард и др. синтезировали нафтил-мостиковый внутримолекулярный боренийсодержащий FLP, способный активировать H 2 с сопутствующим гидрогенолизом мезитильного лиганда. Анализ теории возмущений второго порядка естественных орбиталей связи (NBO) промежуточного продукта в этой реакции, связанной с активацией H 2 , показал взаимодействие 281,8 ккал/моль между сигма-связью H 2 и 2p-орбиталью катионного бора. [15]
Ионы борения также использовались каталитически для различных гидрирований. Стефан и его коллеги смогли использовать катализатор на основе иона борения для каталитической активации H 2 для использования в гидрировании иминов . [14] Похожий ион борения, стабилизированный NHC, использовался для катализа энантиоселективного восстановления кетиминов. В этом примере энантиоселективность была достигнута за счет использования хирального лиганда NHC. [16]
Было показано, что стерические и электронные свойства лиганда NHC, используемого в этих борениевых катализаторах, имеют большое значение для каталитической активности: слишком объемные NHC препятствовали межмолекулярной доставке гидрида, а лиганды, которые были высокоэлектронодонорными, ослабляли способность катиона борения действовать как кислота Льюиса. [12]
Энантиоселективный катализ
Ионы борения использовались в качестве безметалловых энантиоселективных катализаторов для ряда органических превращений. Ранним примером такого восстановления является восстановление Кори-Ицуно . Один из предложенных механизмов этого энантиоселективного восстановления включает in situ генерацию борениеподобных видов с использованием BH 3 в качестве кислоты Льюиса. [17]
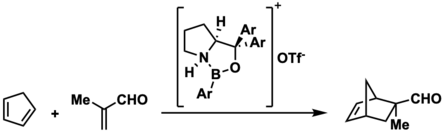
Дальнейшая работа над ионами борения, полученными из нейтральных оксазаборолидинов, расширила сферу их применения. В 2002 году Э. Дж. Кори и его коллеги сообщили , что N-протонирование некислотных оксазаборолидинов Льюиса приводит к образованию ионов борения, которые могут катализировать энантиоселективную реакцию Дильса-Альдера 1,3-диенов с 2-метакролеином или 2-бромакролеином. Этот конкретный ион борения может быть получен in situ путем протонирования нейтрального оксазаборолидина трифторметансульфоновой кислотой. Кори и его коллеги предполагают, что стереоселективность этой реакции является результатом ассоциации альдегида с катализатором в предпереходном состоянии, которое управляет стереоселективностью. [8] Использование ионов борения в качестве катализаторов Дильса-Альдера было далее расширено до использования ионных жидкостей борения в качестве катализаторов для реакции Дильса-Альдера Матушеком и др. в 2017 году. [18]
Электрофильное ароматическое борирование
Ионы борения также были вовлечены в качестве промежуточных продуктов в реакциях электрофильного ароматического борирования . [2] Во многих примерах этой реакции катализатор используется для активации борана, производя высокореакционный ион борения. Образование этого высокоэлектрофильного вида приводит к образованию промежуточного продукта Уиланда , ключевого шага в механизме электрофильного ароматического присоединения. wВ 2013 году Шталь и др. использовали катализатор тиолята рутения (II) для получения ионов борения, способных осуществлять прямое борирование азотсодержащих гетероциклов. [19]
В 2017 году Острейх и его коллеги разработали метод без использования металлов для осуществления этого преобразования. В их работе B(C 6 H 5 ) 3 использовался для активации катехолборана, генерируя ион борения, способный борировать различные богатые электронами гетероциклы . [20]
Гидроборирование
Электрофильность ионов борения может управлять трансгидроборированием алкинов . В 2016 году Макгоу и др. удалось успешно осуществить безметалловое трансгидроборирование с различными арилацетиленовыми субстратами, используя электрофил иона борения и B(C6F5 ) 3 в качестве катализатора . [ 21 ]

Полимеризационный катализ
Было показано, что ионы борения образуют ионные жидкости , способные катализировать полимеризацию полиальфаолефинов (ПАО). Хотя эта технология еще не получила широкого распространения в промышленности, она может стать альтернативой использованию BF 3 , токсичного и едкого газа, в промышленном синтезе ПАО. [22]
Катионы бора
Ионы бориния имеют формулу [BX 2 ] + , [23] где X − обычно представляет собой объемный амид (R 2 N − ). Они имеют линейную геометрию по бору и являются координационно ненасыщенными.
Катионы бора
Ионы бора имеют формулу [L 2 BR 2 ] + (L = основание Льюиса ). Ионы бора являются тетраэдрическими и координационно насыщенными.
Известный пример — [(H 3 N) 2 BH 2 ] + . Реакция диборана с аммиаком в основном дает [H 2 B(NH 3 ) 2 ] + [BH 4 ] − (тетрагидроборат диаммонийдигидроборония). [24] [25]
Родственные катионы бора
Другие неклассические катионы бора представляют собой моноядерные ди- и трикатионы бора с формулой [L 3 BX] 2+ и [L 4 B] 3+ , соответственно. [26]
Другие известные катионы бора – это дибора-катионы (бис(борений)дикатионы), некоторые примеры приведены ниже. [27] [28]
Ссылки
- ^ abcdefgh Koelle, P.; Noeth, H. (1985-10-01). «Химия бориния и ионов борения». Chemical Reviews . 85 (5): 399– 418. doi :10.1021/cr00069a004. ISSN 0009-2665.
- ^ abc De Vries, Timothy S.; Prokofjevs, Aleksandrs; Vedejs, Edwin (2012-07-11). "Cationic Tricoordinate Boron Intermediates: Borenium Chemistry from the Organic Perspective". Chemical Reviews . 112 (7): 4246– 4282. doi :10.1021/cr200133c. ISSN 0009-2665. PMC 3394883 . PMID 22519545.
- ^ Ли, Кёнхун; Киркволд, Клара; Влайсавлевич, Бесс; Дейли, Скотт Р. (2018-11-05). «Реакционная способность борения, центрированного на лиганде, в комплексах дифосфина с мостиковой связью через триаминоборан». Неорганическая химия . 57 (21): 13188– 13200. doi :10.1021/acs.inorgchem.8b01601. ISSN 0020-1669. PMID 30351072. S2CID 53036749.
- ^ abc Рышкевич, Джордж Э.; Виггинс, Дж. В. (1970-03-01). «Тригональный катион бора». Журнал Американского химического общества . 92 (6): 1790– 1791. doi :10.1021/ja00709a079. ISSN 0002-7863.
- ^ Кларк, Эван Р.; Инглесон, Майкл Дж. (2013-11-25). "[(акридин)BCl2]+: катион борения, являющийся сильной кислотой Льюиса на основе бора и углерода". Металлоорганические соединения . 32 (22): 6712– 6717. doi :10.1021/om400463r. ISSN 0276-7333.
- ^ ab Bentivegna, BriAnne; Mariani, Christine I.; Smith, Jason R.; Ma, Shuhua; Rheingold, Arnold L.; Brunker, Tim J. (2014-06-09). «Формирование, стабильность и структуры катионов борения и борониевых соединений, полученных из пентаметилазаферроцена–боранов с помощью реакций абстрагирования гидрида или хлорида». Organometallics . 33 (11): 2820– 2830. doi :10.1021/om500348u. ISSN 0276-7333.
- ^ abc Narula, Chaitanya (1984). «Получение и характеристика солей, содержащих катионы трехкоординированного бора». Неорганическая химия . 23 (25): 4147– 4152. doi :10.1021/ic00193a009.
- ^ abc Corey, EJ; Shibata, Takanori; Lee, Thomas W. (2002-04-01). "Асимметричные реакции Дильса-Альдера, катализируемые хиральным оксазаборолидином, активированным трифторметансульфоновой кислотой". Журнал Американского химического общества . 124 (15): 3808– 3809. doi :10.1021/ja025848x. ISSN 0002-7863. PMID 11942799.
- ^ Чен, Цзявей; Лалансетт, Роджер А.; Якле, Фридер (2013-05-02). «Синтез и свойства кислоты Льюиса планарно-хирального катиона борения на основе ферроцена». Chemical Communications . 49 (43): 4893– 4895. doi :10.1039/C3CC41556B. ISSN 1364-548X. PMID 23571677.
- ^ ab Стоянович, Милован; Баранац-Стоянович, Мария (2015-09-08). «Теоретическое исследование сродства ионов борения к аммиаку, формальдегиду и хлорид-анионам» (PDF) . RSC Advances . 5 (93): 75895– 75910. Bibcode :2015RSCAd...575895S. doi : 10.1039/C5RA13825F . ISSN 2046-2069.
- ^ ab Резабаль, Эликсабете; Фрисон, Жиль (2015). "Оценка энергии связи π N-гетероциклических карбенов: роль поляризации" (PDF) . Журнал вычислительной химии . 36 (8): 564– 572. doi :10.1002/jcc.23852. ISSN 1096-987X. PMID 25708019. S2CID 22398660.
- ^ abcd Eisenberger, P.; Crudden, CM (2017-04-10). "Борокатионный катализ". Dalton Transactions . 46 (15): 4874– 4887. doi :10.1039/C6DT04232E. ISSN 1477-9234. PMID 28294211.
- ^ Muthaiah, Senthilkumar; Do, Dinh Cao Huan; Ganguly, Rakesh; Vidović, Dragoslav (2013-11-25). «Зависимость противоионов от синтетической жизнеспособности катионов дихлорборения, стабилизированных NHC». Organometallics . 32 (22): 6718– 6724. doi :10.1021/om400541q. hdl : 10356/98250 . ISSN 0276-7333.
- ^ abc Farrell, Jeffrey M.; Hatnean, Jillian A.; Stephan, Douglas W. (2012-09-13). «Активация водорода и катализ гидрирования катионом борения». Журнал Американского химического общества . 134 (38): 15728– 15731. doi :10.1021/ja307995f. ISSN 0002-7863. PMID 22931196.
- ^ Devillard, Marc; Brousses, Rémy; Miqueu, Karinne; Bouhadir, Ghenwa; Bourissou, Didier (2015-05-04). "Стабильный, но высокореакционноспособный фосфин-координированный борений: активация дигидрогена без металла и 1,2-карбоборирование алкинов". Angewandte Chemie International Edition . 54 (19): 5722– 5726. doi :10.1002/anie.201500959. ISSN 1521-3773. PMID 25800957.
- ^ Mercea, Dan M.; Howlett, Michael G.; Piascik, Adam D.; Scott, Daniel J.; Steven, Alan; Ashley, Andrew E.; Fuchter, Matthew J. (2019-06-13). «Энантиоселективное восстановление N-алкилкетиминов с помощью фрустрированного парного катализа Льюиса с использованием хиральных ионов борения». Chemical Communications . 55 (49): 7077– 7080. doi : 10.1039/C9CC02900A. hdl : 10044/1/70396 . ISSN 1364-548X. PMID 31149679. S2CID 206141629.
- ^ Corey, EJ; Bakshi, Raman K.; Shibata, Saizo (1987-09-01). "Высокоэнантиоселективное восстановление борана кетонов, катализируемое хиральными оксазаборолидинами. Механизм и синтетические последствия". Журнал Американского химического общества . 109 (18): 5551– 5553. doi :10.1021/ja00252a056. ISSN 0002-7863.
- ^ Matuszek, K.; Coffie, S.; Chrobok, A.; Swadźba-Kwaśny, M. (2017-03-06). "Борениевые ионные жидкости как катализаторы реакции Дильса-Альдера: настраиваемые суперкислоты Льюиса для каталитических применений" (PDF) . Catalysis Science & Technology . 7 (5): 1045– 1049. doi :10.1039/C7CY00106A. ISSN 2044-4761.
- ^ Шталь, Тимо; Мютер, Кристина; Оки, Ясухиро; Тацуми, Казуюки; Острейх, Мартин (2013-07-31). «Каталитическое образование ионов борения путем кооперативной активации связи B–H: неуловимое прямое электрофильное борилирование гетероциклов азота пинаколбораном». Журнал Американского химического общества . 135 (30): 10978– 10981. doi :10.1021/ja405925w. ISSN 0002-7863. PMID 23855894.
- ^ Yin, Qin; Klare, Hendrik FT; Oestreich, Martin (2017). «Каталитическое борирование по Фриделю–Крафтсу C−H аренов, богатых электронами: резкое ускорение скорости за счет добавления алкенов». Angewandte Chemie International Edition . 56 (13): 3712– 3717. doi :10.1002/anie.201611536. ISSN 1521-3773. PMID 28244623.
- ^ ab McGough, John S.; Butler, Samuel M.; Cade, Ian A.; Ingleson, Michael J. (2016-04-26). "Высокоселективное каталитическое трансгидроборирование алкинов, опосредованное катионами борения и B(C6F5)3". Chemical Science . 7 (5): 3384– 3389. doi : 10.1039/C5SC04798F . ISSN 2041-6539. PMC 6006955 . PMID 29997833.
- ^ Хогг, Джеймс М.; Феррер-Угальде, Альберт; Коулман, Фергал; Свадзьба-Квасьны, Малгожата (2019-08-08). «Борениевые ионные жидкости как альтернатива BF3 в синтезе полиальфаолефинов (PAO)» (PDF) . ACS Sustainable Chemistry & Engineering . 7 (17): 15044– 15052. doi :10.1021/acssuschemeng.9b03621. ISSN 2168-0485. S2CID 202069606.
- ^ Сёдзи, Ёсиаки; Танака, Наоки; Миками, Коитиро; Утияма, Масанобу; Фукусима, Таканори (11 мая 2014 г.). «Двухкоординационный катион бора со связью C – B + – C». Природная химия . 6 (6): 498–503 . Бибкод : 2014НатЧ...6..498С. дои : 10.1038/nchem.1948. ISSN 1755-4330. ПМИД 24848235.
- ^ De Vries, Timothy S.; Prokofjevs, Aleksandrs; Vedejs, Edwin (2012-04-20). "Cationic Tricoordinate Boron Intermediates: Borenium Chemistry from the Organic Perspective". Chemical Reviews . 112 (7): 4246– 4282. doi :10.1021/cr200133c. ISSN 0009-2665. PMC 3394883 . PMID 22519545.
- ^ Пирс, Уоррен Э.; Бурк, Сара К.; Конрой, Кори Д. (2005). «Ионы бориния, борения и борониума: синтез, реакционная способность и применение». Angewandte Chemie International Edition . 44 (32): 5016– 5036. doi :10.1002/anie.200500402. PMID 16086441.
- ^ Варгас-Бака, Игнасио; Финдлейтер, Майкл; Пауэлл, Адам; Васудеван, Кальян В.; Коули, Алан Х. (2008). «Борные ди- и три-катионы». Dalton Transactions (45): 6421– 6. doi :10.1039/b810575h. ISSN 1477-9226. PMID 19002329.
- ^ Прокофьев, Александрс; Кампф, Джефф В.; Соловьев, Андрей; Карран, Деннис П.; Ведейс, Эдвин (10.10.2013). «Слабо стабилизированные первичные катионы борения и их дикатионные димеры». Журнал Американского химического общества . 135 (42): 15686– 15689. doi :10.1021/ja407458k. ISSN 0002-7863. PMC 3857331. PMID 24087933 .
- ^ Арнольд, Николь; Брауншвейг, Хольгер; Дьюхерст, Райан Д.; Хапп, Флориан; Радацкий, Кшиштоф; Трампп, Александра (2016-08-12). «Десимметризация электронодефицитных диборанов(4): разнообразные продукты и их реакционная способность». Химия — европейский журнал . 22 (39): 13927– 13934. doi :10.1002/chem.201602805. ISSN 0947-6539. PMID 27514500.
