Гидрид бериллия
 | |
| Имена | |
|---|---|
| Другие имена Дигидрид бериллия Гидрид бериллия Бериллан | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChemSpider | |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| БеХ 2 | |
| Молярная масса | 11,03 г моль −1 |
| Появление | белое твердое вещество [1] |
| Плотность | 0,65 г/см 3 |
| Температура плавления | 250 °C (482 °F; 523 K) разлагается |
| разлагается | |
| Растворимость | нерастворим в диэтиловом эфире , толуоле |
| Термохимия | |
Теплоемкость ( С ) | 30,124 Дж/моль К |
| Опасности | |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (допустимый) | TWA 0,002 мг/м 3 C 0,005 мг/м 3 (30 минут), с максимальным пиком 0,025 мг/м 3 (как Be) [2] |
РЕЛ (рекомендуется) | Ca C 0,0005 мг/м 3 (как Be) [2] |
IDLH (Непосредственная опасность) | Ca [4 мг/м 3 (как Be)] [2] |
| Родственные соединения | |
Другие катионы | гидрид лития , гидрид натрия , гидрид магния , гидрид кальция , гидриды бора , гидрид алюминия |
Родственные соединения | фторид бериллия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гидрид бериллия (систематическое название поли[бериллан(2)] и дигидрид бериллия ) — неорганическое соединение с химической формулой ( BeH
2) н (также пишется ( [BeH
2] ) n или BeH
2). Этот гидрид щелочноземельного металла представляет собой бесцветное твердое вещество, нерастворимое в растворителях, которые его не разлагают. В отличие от ионно-связанных гидридов более тяжелых элементов группы 2 , гидрид бериллия связан ковалентно [1] ( трехцентровая двухэлектронная связь ).
Синтез
В отличие от других металлов группы 2 , бериллий не реагирует с водородом. [3] Вместо этого BeH 2 получают из предварительно сформированных соединений бериллия(II). Он был впервые синтезирован в 1951 году путем обработки диметилбериллия , Be(CH 3 ) 2 , алюмогидридом лития , LiAlH 4 . [4]
Более чистый BeH 2 образуется при пиролизе ди-трет-бутилбериллия, Be(C[CH 3 ] 3 ) 2 при 210°C. [5]
Путь к получению образцов высокой чистоты включает реакцию трифенилфосфина , PPh 3 , с борогидридом бериллия , Be(BH 4 ) 2 : [1]
- Be ( BH4 ) 2 + 2PPh3 → BeH2 + 2Ph3PBH3
Структура
Газообразная форма

Изолированные молекулы BeH
2(иногда его называют дигидридобериллием и пишут [BeH
2] чтобы подчеркнуть различия с твердым состоянием) стабильны только как разбавленный газ. При конденсации несольватированный BeH
2будет спонтанно автополимеризоваться.
Подтверждено, что свободный молекулярный BeH 2, полученный при высокотемпературном электрическом разряде, имеет линейную геометрию с длиной связи Be-H 133,376 пм. Его гибридизация sp . [6]
Конденсированный гидрид бериллия
BeH 2 обычно образуется в виде аморфного белого твердого вещества, но сообщалось о гексагональной кристаллической форме с более высокой плотностью (~0,78 г/см 3 ) [7] , полученной путем нагревания аморфного BeH 2 под давлением с 0,5-2,5% LiH в качестве катализатора.
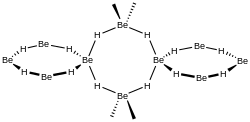
Более позднее исследование показало, что кристаллический гидрид бериллия имеет объемно-центрированную орторомбическую элементарную ячейку , содержащую сеть тетраэдров BeH4, имеющих общие вершины , в отличие от плоских, соединенных водородными мостиками, бесконечных цепей, которые ранее считались существующими в кристаллическом BeH2 . [ 8]
Исследования аморфной формы также показывают, что она состоит из сети тетраэдров с общими углами. [9]
Химические свойства
Реакция с водой и кислотами
Гидрид бериллия медленно реагирует с водой, но быстро гидролизуется кислотой, такой как хлористый водород, с образованием хлорида бериллия . [3]
- BeH2 + 2H2O → Be (OH) 2 + 2H2
- BeH2 + 2HCl → BeCl2 + 2H2
Реакция с основаниями Льюиса
Двухкоординированная гидридобериллиевая группа может принимать лиганд (L), отдающий электронную пару, в молекулу путем присоединения: [10]
- [БеХ
2] + L → [BeH
2Л]
Поскольку эти реакции энергетически выгодны, гидрид бериллия имеет характер кислоты Льюиса .
Реакция с гидридом лития (в которой основанием Льюиса является ион гидрида) последовательно образует LiBeH 3 и Li2BeH4. [3] Последний содержит тетрагидридобериллят(2-) анион BeH2−
4.
Гидрид бериллия реагирует с триметиламином , N(CH 3 ) 3 , образуя димерный аддукт с мостиковыми гидридами. [11] Однако с диметиламином , HN(CH 3 ) 2 он образует тримерный диамид бериллия, [Be(N(CH 3 ) 2 ) 2 ] 3 , и водород. [3]
Ссылки
- ^ abc Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 115. ISBN 978-0-08-037941-8.
- ^ abc NIOSH Карманный справочник по химическим опасностям. "#0054". Национальный институт охраны труда и здоровья (NIOSH).
- ^ abcd Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5 , стр. 1048
- ^ Гленн Д. Барбарас; Клайд Диллард; AE Финхольт; Томас Вартик; KE Вильцбах и HI Шлезингер (1951). «Получение гидридов цинка, кадмия, бериллия, магния и лития с использованием алюмогидрида лития». Журнал Американского химического общества . 73 (10): 4585–4590. doi :10.1021/ja01154a025.
- ^ GE Coates & F. Glockling (1954). «Ди-трет.-бутилбериллий и гидрид бериллия». Журнал химического общества : 2526–2529. doi :10.1039/JR9540002526.
- ^ Питер Ф. Бернат; Алиреза Шайесте; Кит Терещук; Реджинальд Колин (2002). "Спектр вибрационного излучения свободного BeH 2 ". Science . 297 (5585): 1323–1324. Bibcode :2002Sci...297.1323B. doi :10.1126/science.1074580. PMID 12193780. S2CID 40961746.
- ^ GJ Brendel; EM Marlett & LM Niebylski (1978). «Кристаллический гидрид бериллия». Неорганическая химия . 17 (12): 3589–3592. doi :10.1021/ic50190a051.
- ^ ab Гордон С. Смит; Квинтин С. Джонсон; Дин К. Смит; Д. Э. Кокс; Роберт Л. Снайдер; Ронг-Шэн Чжоу и Аллан Залкин (1988). «Кристаллическая и молекулярная структура гидрида бериллия». Solid State Communications . 67 (5): 491–494. Bibcode : 1988SSCom..67..491S. doi : 10.1016/0038-1098(84)90168-6.
- ^ Суджата Сампат; Кристина М. Ланцки; Крис Дж. Бенмор; Йорг Нойфайнд и Джоан Э. Сивени (2003). «Структурные квантовые изотопные эффекты в аморфном гидриде бериллия». Дж. Хим. Физ . 119 (23): 12499. Бибкод : 2003JChPh.11912499S. дои : 10.1063/1.1626638.
- ^ Шарп, Стефани Б.; Геллен, Грегори И. (23 ноября 2000 г.). «Активация σ-связи путем кооперативного взаимодействия с атомами n s 2 : Be + n H
2, n = 1−3". Журнал физической химии A . 104 (46): 10951–10957. doi :10.1021/jp002313m. - ^ Шеперд-младший, Лоуренс Х.; Тер Хаар, ГЛ; Марлетт, Эверетт М. (апрель 1969 г.). «Аминовые комплексы гидрида бериллия». Неорганическая химия . 8 (4): 976–979. doi :10.1021/ic50074a051.


