Феррат бария
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Феррат бария(VI) | |||
| Другие имена Феррат бария(2-) | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider |
| ||
| |||
| Характеристики | |||
| BaFeO4 | |||
| Молярная масса | 257,1646 г/моль | ||
| Появление | Темно-красные, непрозрачные кристаллы | ||
| нерастворимый | |||
| Структура | |||
| орторомбический | |||
| ПНМА, № 62 [1] | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Феррат бария — это химическое соединение формулы BaFeO 4 . Это редкое соединение, содержащее железо в степени окисления +6 . [2] Ион феррата (VI) имеет два неспаренных электрона, что делает его парамагнитным . [3] Он изоструктурен с BaSO 4 и содержит тетраэдрический анион [FeO 4 ] 2− . [4]
Структура
Анион феррата(VI) является парамагнитным из-за двух неспаренных электронов и имеет тетраэдрическую молекулярную геометрию . [3]
Рентгеновская дифракция была использована для определения структуры орторомбической элементарной ячейки [1] (векторы решетки a ≠ b ≠ c, межосевые углы α=β=γ=90°) [5] нанокристаллического BaFeO 4 . Он кристаллизовался в пространственной группе Pnma (точечная группа: D 2h ) с параметрами решетки a = 0,8880 нм, b = 0,5512 нм и c = 0,7214 нм. [1] Точность данных рентгеновской дифракции была проверена интервалами решеточных полос из просвечивающей электронной микроскопии высокого разрешения (HRTEM) и параметрами ячейки, рассчитанными с помощью дифракции выбранной области (SAED). [1]
Характеристика
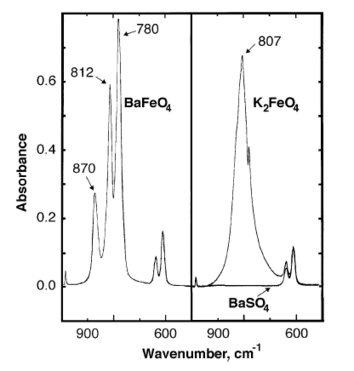
Инфракрасные пики поглощения феррата бария наблюдаются при 870, 812, 780 см −1 . [6]
BaFeO 4 подчиняется закону Кюри-Вейсса и имеет магнитный момент (2,92 ± 0,03) × 10 −23 А м 2 (3,45 ± 0,1 БМ ) с константой Вейсса −89 К. [8]
Подготовка и химия
Феррат бария(VI) может быть получен как мокрым, так и сухим синтетическим методом. Сухой синтез обычно выполняется с использованием термической техники, [6] например, путем нагревания гидроксида бария и гидроксида железа(II) в присутствии кислорода до температуры около 800-900 °C. [9]
- Ба(ОН)
2+ Fe(ОН)
2+ О
2→ BaFeO
4+ 2 ч.
2О
Влажные методы используют как химические, так и электрохимические методы. Например, феррат-анион образуется, когда подходящая соль железа помещается в щелочные условия и добавляется сильный окислитель , такой как гипохлорит натрия . [10]
- 2 Fe(ОН)
3+ 3 ОCl−
+ 4 ОН−
→ 2 Fe2O32−
4+ 5 ч.
2О + 3 Cl−
Затем феррат бария осаждают из раствора добавлением раствора соли бария (II) . [10] Добавление растворимой соли бария к раствору феррата щелочного металла приводит к образованию темно-бордового осадка феррата бария, кристалла, имеющего ту же структуру, что и хромат бария , и имеющего примерно такую же растворимость. [11] Феррат бария также получают добавлением оксида бария к смеси гипохлорита натрия и нитрата железа при комнатной температуре (или 0 °C). [12] Чистоту продукта можно повысить, проводя реакцию при низкой температуре в отсутствие диоксида углерода и быстро фильтруя и высушивая осадок, что снижает соосаждение гидроксида бария и карбоната бария в качестве примесей. [11]
Использует
Феррат бария является окислителем и используется в качестве окисляющего реагента в органических синтезах. Другие его применения включают удаление цвета, удаление цианида, уничтожение бактерий и очистку загрязненных и сточных вод. [6]
Соли феррата(VI) являются энергетическими катодными материалами в батареях «супер-железо». Катоды, содержащие соединения феррата(VI), называются катодами «супер-железо» из-за их высокоокисленной железной основы, множественного переноса электронов и высокой внутренней энергии. Среди всех солей феррата(VI) феррат бария поддерживает необычайно легкую передачу заряда, что важно для области высокой мощности щелочных батарей . [7]
Реакции
Феррат бария является наиболее стабильным из соединений феррата(VI). Он может быть получен в чистом виде и имеет наиболее определенный состав. Феррат бария может быть легко разложен всеми растворимыми кислотами, включая угольную кислоту. Если диоксид углерода пропустить через воду, в которой суспендирован гидратированный феррат бария, феррат бария полностью разложится с образованием карбоната бария , гидроксида железа и газообразного кислорода. Щелочные сульфаты разлагают феррат бария, который не был высушен, образуя сульфат бария, гидроксид железа и газообразный кислород.
Смотрите также
Ссылки
- ^ abcd Ni, Xiao-Min; Ji, Ming-Rong; Yang, Zhi-Ping; Zheng, Hua-Gui (2004). "Подготовка и структурная характеристика нанокристаллического BaFeO 4 ". Журнал по росту кристаллов . 261 (1): 82– 86. Bibcode :2004JCrGr.261...82N. doi :10.1016/j.jcrysgro.2003.09.024.
- ^ Бриггс, Дж. Дж. Р. Г. (2005). Курс Longman A-level по химии (4-е изд.). Pearson Education South Asia. стр. 536. ISBN 978-981-4105-08-8.
- ^ ab Wiberg, Egon ; Wiberg, Nils ; Holleman, Arnold (2001). Неорганическая химия . Academic Press . стр. 1457– 1458. ISBN 978-0-12-352651-9.
- ^ Уэллс, А. Ф. (1986). Структурная неорганическая химия (5-е изд.). Оксфорд [Оксфордшир]: Clarendon Press . ISBN 978-0-19-855370-0.
- ^ "IUCr". www.iucr.org . Получено 29.04.2016 .
- ^ abc Henry-Chase, Adonica; Bhushan Tewari, Brij (2013). «Использование феррата (VI) — зеленого химиката для восстановления окружающей среды» (PDF) . Revista Boliviana de Química . 30 (1): 13– 23. ISSN 0250-5460.
- ^ ab Licht, Stuart; Naschitz, Vera; Wang, Baohui (2002). "Быстрый химический синтез соединения супержелеза Fe (VI) феррата бария, BaFeO 4 ". Journal of Power Sources . 109 (1): 67– 70. Bibcode :2002JPS...109...67L. doi :10.1016/s0378-7753(02)00041-1.
- ^ Одетт, Р. Дж.; Куэйл, Дж. В. (1972). «Ферраты калия, рубидия, цезия и бария (VI). Препараты, инфракрасные спектры и магнитная восприимчивость». Неорганическая химия . 11 (8): 1904–1908 . doi :10.1021/ic50114a034.
- ^ Шарма, РК (2007). "Стабилизация Fe (VI)". Учебник координационной химии . Нью-Дели: Discovery Publishing House. стр. 124. ISBN 9788183562232.
- ^ ab Wulfsberg, Gary (1991). "pH и стабильность высоких степеней окисления; Синтез оксоанионов и их использование в качестве окислителей". Принципы описательной неорганической химии . Sausalito, CA: University Science Books. стр. 142– 143. ISBN 9780935702668.
- ^ ab Gump, JR; Wagner, WF; Schreyer, JM (1954). "Подготовка и анализ феррата бария (VI)". Аналитическая химия . 26 (12): 1957. doi :10.1021/ac60096a027. ISSN 0003-2700.
- ^ Herber, Rolfe H.; Johnson, David (1979). «Динамика решетки и сверхтонкие взаимодействия в M2FeO4 ( M = K + , Rb + , Cs + ) и M'FeO4 (M' = Sr2 + , Ba2 + ) ». Неорганическая химия . 18 (10): 2786–2790 . doi :10.1021/ic50200a030.




