Мупироцин
 | |
 Псевдомоновая кислота А (ПА-А), основной компонент мупироцина | |
| Клинические данные | |
|---|---|
| Торговые наименования | Бактробан, другие |
| Другие имена | муципроцин [1] |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а688004 |
| Данные лицензии |
|
Категория беременности |
|
| Пути введения | Актуальный |
| код АТС | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные | |
| Связывание с белками | 97% |
| Период полувыведения | 20–40 минут |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ЧЭБИ | |
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.106.215 |
| Химические и физические данные | |
| Формула | С26Н44О9 |
| Молярная масса | 500,629 г·моль −1 |
| 3D модель ( JSmol ) |
|
| Температура плавления | 77–78 °C (171–172 °F) |
| |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Мупироцин , продаваемый под торговой маркой Bactroban , среди прочего, является местным антибиотиком, полезным при поверхностных инфекциях кожи, таких как импетиго или фолликулит . [5] [6] [7] Его также можно использовать для избавления от метициллин-резистентного золотистого стафилококка (MRSA), если он присутствует в носу без симптомов. [6] Из-за опасений развития резистентности не рекомендуется использовать его более десяти дней. [7] Его используют в виде крема или мази, наносимой на кожу. [6]
Распространенные побочные эффекты включают зуд и сыпь в месте нанесения, головную боль и тошноту. [6] Длительное использование может привести к усилению роста грибков . [6] Использование во время беременности и кормления грудью , по-видимому, безопасно. [6] Мупироцин химически является карбоновой кислотой . [8] Он работает, блокируя способность бактерий вырабатывать белок, что обычно приводит к гибели бактерий . [6]
Мупироцин был первоначально выделен в 1971 году из Pseudomonas fluorescens . [9] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [10] В 2021 году он был 203-м наиболее часто назначаемым лекарством в Соединенных Штатах, с более чем 2 миллионами рецептов. [11] [12] Он доступен в качестве дженерика . [13]
Медицинское применение

Мупироцин используется в качестве местного лечения бактериальных инфекций кожи (например, фурункулов , импетиго или открытых ран), которые обычно вызваны инфекцией Staphylococcus aureus или Streptococcus pyogenes . Он также полезен при лечении поверхностных инфекций, вызванных метициллин-резистентным золотистым стафилококком (MRSA). [14] Мупироцин неактивен в отношении большинства анаэробных бактерий, микобактерий, микоплазмы, хламидий, дрожжей и грибков. [15]
Интраназальное введение мупироцина перед операцией эффективно для профилактики послеоперационной раневой инфекции, вызванной Staphylococcus aureus , а профилактическое интраназальное или катетерное лечение эффективно для снижения риска катетерной инфекции у лиц, проходящих хронический перитонеальный диализ. [16]
Сопротивление
Вскоре после начала клинического использования мупироцина появились штаммы Staphylococcus aureus , которые были устойчивы к мупироцину, с показателями успешности очистки ноздрей менее 30%. [17] [18] Были выделены две отдельные популяции мупироцин-резистентного S. aureus . Один штамм обладал низким уровнем резистентности (MuL: МИК = 8–256 мг/л), а другой обладал высоким уровнем резистентности (MuH: МИК > 256 мг/л). [17] Устойчивость штаммов MuL, вероятно, обусловлена мутациями в диком типе изолейцил-тРНК-синтетазы организма ( IleS ). Было показано, что в E. coli IleS мутация одной аминокислоты изменяет устойчивость к мупироцину. [19] MuH связан с приобретением отдельного гена Ile-синтетазы, MupA . [20] Мупироцин не является жизнеспособным антибиотиком против штаммов MuH. Было показано, что другие антибиотики, такие как азелаиновая кислота , нитрофуразон , сульфадиазин серебра и рамопланин, эффективны против штаммов MuH. [17]
Большинство штаммов Cutibacterium acnes , возбудителя кожного заболевания acne vulgaris , обладают естественной устойчивостью к мупироцину. [21]
Большинство штаммов Pseudomonas fluorescens также устойчивы к мупироцину, поскольку они вырабатывают этот антибиотик, и вполне возможно, что другие виды Pseudomonas также могут быть устойчивы. [ необходима цитата ]
Механизм действия мупироцина отличается от других клинических антибиотиков, что делает перекрестную резистентность к другим антибиотикам маловероятной. [17] Однако ген MupA может ко-переноситься с другими генами резистентности к антибактериальным препаратам. Это уже наблюдалось с генами резистентности к триклозану , тетрациклину и триметоприму . [17] Это также может привести к чрезмерному росту невосприимчивых организмов. [ необходима цитата ]
Второй тип высокоустойчивой синтетазы был обнаружен в 2012 году и назван MupB . Он был обнаружен в канадском изоляте MRSA «MUP87» и, вероятно, расположен на неконъюгативной плазмиде. [22]
Механизм действия
Псевдомоновая кислота (мупироцин) ингибирует изолейцин-тРНК-лигазу в бактериях, [14] что приводит к истощению изолейцил-тРНК и накоплению соответствующей незаряженной тРНК . Истощение изолейцил-тРНК приводит к ингибированию синтеза белка . Незаряженная форма тРНК связывается с сайтом связывания аминоацил-тРНК рибосом, вызывая образование (p)ppGpp , который, в свою очередь, ингибирует синтез РНК. [23] Совместное ингибирование синтеза белка и синтеза РНК приводит к бактериостазу. Этот механизм действия общий с фураномицином , аналогом изолейцина. [24]
Ингибирование тРНК-лигазы/синтазы обусловлено структурным сходством между «головной» частью молекулы мониевой кислоты и изолейциладенилатом ( Ile-AMS). Уникальный «хвост» 9-гидроксинонановой кислоты обволакивает фермент и дополнительно стабилизирует комплекс, удерживая каталитическую часть прикрепленной. [25] Мупироцин способен связываться с бактериальными и архейными версиями фермента, но не с эукариотическими версиями. [26]
Биосинтез



Мупироцин представляет собой смесь нескольких псевдомоновых кислот, причем псевдомоновая кислота A (PA-A) составляет более 90% смеси. В мупироцине также присутствуют псевдомоновая кислота B с дополнительной гидроксильной группой в C8, [29] псевдомоновая кислота C с двойной связью между C10 и C11 вместо эпоксида PA-A, [30] и псевдомоновая кислота D с двойной связью в C4` и C5` в части 9-гидроксинонановой кислоты мупироцина. [31]
Биосинтез псевдомоновой кислоты А
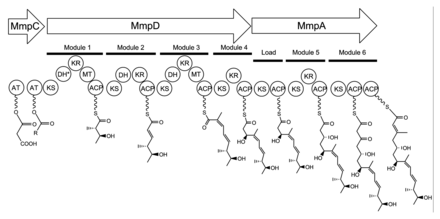
Генный кластер мупироцина размером 74 кб содержит шесть многодоменных ферментов и двадцать шесть других пептидов (таблица 1). [27] Кодируются четыре больших многодоменных белка поликетидсинтазы (PKS) типа I, а также несколько однофункциональных ферментов с последовательностью, схожей с последовательностями PKS типа II. [27] Поэтому считается, что мупироцин сконструирован смешанной системой PKS типа I и типа II. Кластер мупироцина демонстрирует атипичную организацию ацилтрансферазы (AT), в которой есть только два домена AT, и оба находятся на одном и том же белке, MmpC. Эти домены AT являются единственными доменами, присутствующими на MmpC, в то время как другие три белка PKS типа I не содержат доменов AT. [27] Путь мупироцина также содержит несколько тандемных дублетов или триплетов белков-переносчиков ацила . Это может быть адаптацией для увеличения пропускной способности или для одновременного связывания нескольких субстратов. [27]
Псевдомоновая кислота A является продуктом этерификации между 17C поликетидной моной кислотой и 9C жирной кислотой 9-гидроксинонановой кислотой. Возможность того, что вся молекула собирается как один поликетид с окислением Байера-Виллигера, вставляющим кислород в углеродный остов, была исключена, поскольку C1 моной кислоты и C9' 9-гидроксинонановой кислоты оба получены из C1 ацетата. [32]
| Ген | Функция |
|---|---|
| мюпА | FMN H 2 зависимая оксигеназа |
| ммпА | КС АКП КС КР АКП КС АКП АКП |
| mupB | 3-оксоацил-АПБ-синтаза |
| ммпБ | КС ДХ КР АКП АКП АКП ТЕ |
| ммпС | В В |
| ммпД | KS DH KR MeT ACP KS DH KR ACP KS DH KR MeT ACP KS KR ACP |
| mupC | НАДН / НАДФН оксидоредуктаза |
| macpA | АКП |
| mupD | 3-оксоацил-АПБ-редуктаза |
| mupE | еноилредуктаза |
| macpB | АКП |
| mupF | КР |
| macpC | АКП |
| mupG | 3-оксоацил-АПБ-синтаза I |
| mupH | Синтаза HMG-CoA |
| mupJ | еноил-КоА-гидратаза |
| mupK | еноил-КоА-гидратаза |
| ммпЭ | КС- гидролаза |
| мупЛ | предполагаемая гидролаза |
| mupM | изолейцил-тРНК-синтаза |
| mupN | фосфопантетеинилтрансфераза |
| mupO | цитохром P450 |
| mupP | неизвестный |
| mupQ | ацил-КоА-синтаза |
| mupS | 3-оксоацил-АПБ-редуктаза |
| macpD | АКП |
| ммпФ | КС |
| macpE | АКП |
| мупТ | ферредоксин диоксигеназа |
| mupU | ацил-КоА-синтаза |
| mupV | оксидоредуктаза |
| mupW | диоксигеназа |
| мупР | N-AHL -чувствительный транскрипционный активатор |
| mupX | амидаза /гидролаза |
| мупи | N-AHL-синтаза |
Биосинтез мониевой кислоты
Биосинтез единицы мониевой кислоты 17C начинается на MmpD (рисунок 1). [27] Один из доменов AT из MmpC может переносить активированную ацетильную группу из ацетил-Коэнзима А (КоА) в первый домен ACP. Цепь удлиняется малонил-КоА, за которым следует SAM-зависимое метилирование в C12 (см. рисунок 2 для нумерации PA-A) и восстановление B-кетогруппы до спирта. Домен дегидратации (DH) в модуле 1, как предполагается, нефункционален из-за мутации в консервативной области активного сайта . Модуль 2 добавляет еще два углерода с помощью удлинительной единицы малонил-КоА, за которой следует кеторедукция (KR) и дегидратация. Модуль три добавляет удлинительную единицу малонил-КоА, за которой следует SAM-зависимое метилирование в C8, кеторедукция и дегидратация. Модуль 4 расширяет молекулу с помощью малонил-КоА-единицы с последующей кето-редукцией. [ необходима цитата ]
Сборка мониевой кислоты продолжается путем переноса продукта 12C MmpD в MmpA. [27]
Пост-ПКС-пошив
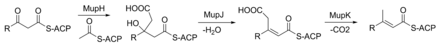
Кетогруппа в положении C3 заменяется метильной группой в ходе многоступенчатой реакции (рисунок 3). MupG начинается с декарбоксилирования малонил-АПБ. Альфа-углерод полученного ацетил-АПБ связан с C3 поликетидной цепи с помощью MupH. Этот промежуточный продукт дегидратируется и декарбоксилируется с помощью MupJ и MupK соответственно. [27]
Образование пиранового кольца требует множества ферментативно-опосредованных этапов (рисунок 4). Двойная связь между C8 и C9, как предполагается, перемещается между C8 и C16. [28] Эксперименты по нокауту генов mupO, mupU, mupV и macpE устранили образование PA-A. [28] Образование PA-B не устраняется этими нокаутами, что демонстрирует, что PA-B не создается путем гидроксилирования PA-A. Нокаут mupW устранил пирановое кольцо, идентифицируя MupW как участвующий в образовании кольца. [28]
Эпоксид PA-A в положении C10-11, как полагают, вставляется после образования пирана цитохромом P450, таким как MupO. [27] Выключение гена mupO отменяет выработку PA-A, но PA-B, который также содержит эпоксид C10-C11, остается. [ 28]
Биосинтез 9-гидроксинонановой кислоты
Жирная кислота из девяти атомов углерода 9-гидроксинонановая кислота (9-HN) выводится как отдельное соединение и позже этерифицируется до мониевой кислоты с образованием псевдомониевой кислоты . Подача ацетата, меченого 13 C, показала, что C1-C6 построены с ацетатом в каноническом режиме синтеза жирных кислот . C7' показывает только маркировку C1 ацетата, в то время как C8' и C9' показывают обратную картину ацетата, меченого 13 C. [32] Предполагается, что C7-C9 возникает из стартовой единицы 3-гидроксипропионата, которая удлиняется три раза с помощью малонил-КоА и полностью восстанавливается с получением 9-HN. Также было высказано предположение, что 9-HN инициируется 3-гидрокси-3-метилглутаровой кислотой (HMG). Эта последняя теория не была подтверждена подачей [3- 14 C] или [3,6- 13 C 2 ]-HMG. [33]
Предполагается, что MmpB катализирует синтез 9-HN (рисунок 5). MmpB содержит домены KS, KR, DH, 3 ACP и тиоэстеразы (TE). [27] Он не содержит домена еноилредуктазы (ER), который необходим для полного восстановления до девятиуглеродной жирной кислоты. MupE — это однодоменный белок, который показывает сходство последовательностей с известными доменами ER и может завершить реакцию. [27]
Ссылки
- ^ Fleischer AB (2002). Неотложная дерматология: руководство по быстрому лечению. McGraw Hill Professional. стр. 173. ISBN 9780071379953. Архивировано из оригинала 10 сентября 2017 года.
- ^ "Рецептурные лекарства: регистрация новых дженериков и биоаналогичных лекарств, 2017". Therapeutic Goods Administration (TGA) . 21 июня 2022 г. Получено 30 марта 2024 г.
- ^ "Информация о продукте Bactroban". Health Canada . 22 октября 2009 г. Архивировано из оригинала 26 февраля 2023 г. Получено 26 февраля 2023 г.
- ^ "Bactroban (mupirocin) cream, for topical use Initial US Approval: 1997". DailyMed . Архивировано из оригинала 26 февраля 2023 . Получено 26 февраля 2023 .
- ^ AlHoufie ST, Foster HA (август 2016). «Влияние сублетальных концентраций мупироцина на глобальную транскрипцию у Staphylococcus aureus 8325-4 и модель выхода из-под ингибирования». Журнал медицинской микробиологии . 65 (8): 858–866. doi : 10.1099/jmm.0.000270 . PMID 27184545.
- ^ abcdefg "Mupirocin". Американское общество фармацевтов системы здравоохранения. Архивировано из оригинала 21 декабря 2016 года . Получено 8 декабря 2016 года .
- ^ ab Всемирная организация здравоохранения (2009). Stuart MC, Kouimtzi M, Hill SR (ред.). WHO Model Formulary 2008. Всемирная организация здравоохранения. стр. 298. hdl :10665/44053. ISBN 9789241547659.
- ^ Ханна Р., Кредит РТ (2009). Учебник перитонеального диализа Нольфа и Гокала (3-е изд.). Springer Science & Business Media. стр. 421. ISBN 9780387789408. Архивировано из оригинала 10 сентября 2017 года.
- ^ Хеггерс Дж. П., Робсон М. К., Филлипс Л. Г. (1990). Количественная бактериология: ее роль в арсенале хирурга. CRC Press. стр. 118. ISBN 9780849351297. Архивировано из оригинала 10 сентября 2017 года.
- ^ Всемирная организация здравоохранения (2019). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г. Женева: Всемирная организация здравоохранения. hdl : 10665/325771 . WHO/MVP/EMP/IAU/2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ "Топ-300 2021 года". ClinCalc . Архивировано из оригинала 15 января 2024 года . Получено 14 января 2024 года .
- ^ "Mupirocin - Drug Usage Statistics". ClinCalc . Получено 14 января 2024 г. .
- ^ "Competitive Generic Theraprovals". Управление по контролю за продуктами и лекарствами США (FDA) . 29 июня 2023 г. Архивировано из оригинала 29 июня 2023 г. Получено 29 июня 2023 г.
- ^ ab Hughes J, Mellows G (октябрь 1978 г.). «Ингибирование синтетазы изолейцил-переносящей рибонуклеиновой кислоты в Escherichia coli псевдомоновой кислотой». The Biochemical Journal . 176 (1): 305–318. doi :10.1042/bj1760305. PMC 1186229 . PMID 365175.
- ^ "Product Monograph Bactroban" (PDF) . Архивировано (PDF) из оригинала 24 сентября 2015 г. . Получено 8 сентября 2014 г. .
- ^ Troeman DP, Van Hout D, Kluytmans JA (февраль 2019 г.). «Антимикробные подходы к профилактике инфекций Staphylococcus aureus: обзор». Журнал антимикробной химиотерапии . 74 (2): 281–294. doi :10.1093/jac/dky421. PMC 6337897. PMID 30376041 .
- ^ abcde Cookson BD (январь 1998). «Возникновение устойчивости к мупироцину: вызов практике контроля инфекций и назначения антибиотиков». Журнал антимикробной химиотерапии . 41 (1): 11–18. doi :10.1093/jac/41.1.11. PMID 9511032.
- ^ Worcester S (март 2008 г.). «Местная деколонизация MRSA оправдана во время вспышек». Американский колледж врачей неотложной помощи . Elsevier Global Medical News. Архивировано из оригинала 18 мая 2014 г. Получено 18 ноября 2013 г.
- ^ Yanagisawa T, Lee JT, Wu HC, Kawakami M (сентябрь 1994 г.). «Связь структуры белка изолейцил-тРНК-синтетазы с устойчивостью Escherichia coli к псевдомоновой кислоте. Предложенный способ действия псевдомоновой кислоты как ингибитора изолейцил-тРНК-синтетазы». Журнал биологической химии . 269 (39): 24304–24309. doi : 10.1016/S0021-9258(19)51082-1 . PMID 7929087.
- ^ Gilbart J, Perry CR, Slocombe B (январь 1993 г.). «Высокий уровень устойчивости к мупироцину у Staphylococcus aureus: доказательства двух различных изолейцил-тРНК-синтетаз». Antimicrobial Agents and Chemotherapy . 37 (1): 32–38. doi :10.1128/aac.37.1.32. PMC 187600. PMID 8431015 .
- ^ "Antibiotic Susceptibility of Propionibacterium acnes". ScienceOfAcne.com. 11 июня 2011 г. Архивировано из оригинала 29 июля 2012 г. Получено 27 августа 2012 г.
- ^ Seah C, Alexander DC, Louie L, Simor A, Low DE, Longtin J, Melano RG (апрель 2012 г.). «MupB, новый механизм резистентности к мупироцину высокого уровня у Staphylococcus aureus». Antimicrobial Agents and Chemotherapy . 56 (4): 1916–1920. doi :10.1128/AAC.05325-11. PMC 3318397. PMID 22252810. S2CID 21526116 .
- ^ Haseltine WA, Block R (май 1973). «Синтез тетра- и пентафосфата гуанозина требует присутствия кодон-специфической, незаряженной транспортной рибонуклеиновой кислоты в акцепторном участке рибосом». Труды Национальной академии наук Соединенных Штатов Америки . 70 (5): 1564–1568. Bibcode : 1973PNAS...70.1564H. doi : 10.1073/pnas.70.5.1564 . PMC 433543. PMID 4576025 .
- ^ Танака К., Тамаки М., Ватанабэ С. (ноябрь 1969 г.). «Влияние фураномицина на синтез изолейцил-тРНК». Biochimica et Biophysical Acta (BBA) - Нуклеиновые кислоты и синтез белка . 195 (1): 244–245. дои : 10.1016/0005-2787(69)90621-2. ПМИД 4982424.
- ^ Nakama T, Nureki O, Yokoyama S (декабрь 2001 г.). «Структурная основа распознавания изолейциладенилата и антибиотика мупироцина изолейцил-тРНК-синтетазой». Журнал биологической химии . 276 (50): 47387–47393. doi : 10.1074/jbc.M109089200 . PMID 11584022.
- ^ Chung S, Kim S, Ryu SH, Hwang KY, Cho Y (апрель 2020 г.). «Структурная основа устойчивости эукариотической изолейцил-тРНК-синтетазы к антибиотикам». Molecules and Cells . 43 (4): 350–359. doi :10.14348/molcells.2020.2287. PMC 7191050. PMID 32088946. S2CID 211263261 .
- ^ abcdefghijk El-Sayed AK, Hothersall J, Cooper SM, Stephens E, Simpson TJ, Thomas CM (май 2003 г.). "Характеристика кластера генов биосинтеза мупироцина из Pseudomonas fluorescens NCIMB 10586". Химия и биология . 10 (5): 419–430. doi : 10.1016/S1074-5521(03)00091-7 . PMID 12770824.
- ^ abcde Cooper SM, Laosripaiboon W, Rahman AS, Hothersall J, El-Sayed AK, Winfield C и др. (июль 2005 г.). «Переход к производству псевдомоновой кислоты B в P. fluorescens NCIMB10586 путем мутации генов mupO, mupU, mupV и macpE, регулирующих мупироцин». Химия и биология . 12 (7): 825–833. doi : 10.1016/j.chembiol.2005.05.015 . PMID 16039529.
- ^ Chain EB, Mellows G (1977). «Псевдомоновая кислота. Часть 3. Структура псевдомоновой кислоты B». Журнал химического общества, Perkin Transactions 1 (3): 318–324. doi :10.1039/p19770000318. PMID 402373.
- ^ Clayton JP, O'Hanlon PJ, Rogers NH (1980). «Структура и конфигурация псевдомоновой кислоты C». Tetrahedron Letters . 21 (9): 881–884. doi :10.1016/S0040-4039(00)71533-4.
- ^ O'Hanlon PJ, Rogers NH, Tyler JW (1983). «Химия псевдомоновой кислоты. Часть 6. Структура и получение псевдомоновой кислоты D». Журнал химического общества, Perkin Transactions 1 : 2655–2657. doi :10.1039/P19830002655.
- ^ ab Feline TC, Jones RB, Mellows G, Phillips L (1977). «Псевдомоновая кислота. Часть 2. Биосинтез псевдомоновой кислоты A». Журнал химического общества, Perkin Transactions 1 (3): 309–318. doi :10.1039/p19770000309. PMID 402372.
- ^ Мартин FM, Симпсон TJ (1989). «Биосинтетические исследования псевдомоновой кислоты (мупироцина), нового антибиотика-метаболита Pseudomonas fluorescens». Журнал химического общества, Perkin Transactions 1 (1): 207–209. doi :10.1039/P19890000207.
