Терифлуномид
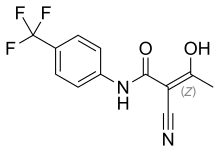 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Аубаджио |
| Другие имена | А77 1726 |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а613010 |
| Данные лицензии |
|
Категория беременности |
|
| Пути введения | Через рот |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Связывание с белками | >99,3% |
| Период полувыведения | 2 недели |
| Выделение | Желчные протоки / фекалии , почки |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| ИУФАР/БПС |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ЧЭБИ | |
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.170.077 |
| Химические и физические данные | |
| Формула | С12Н9Ф3Н2О2 |
| Молярная масса | 270,211 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Терифлуномид , продаваемый под торговой маркой Aubagio , является активным метаболитом лефлуномида . [6] Терифлуномид был исследован в клиническом исследовании фазы III TEMSO как лекарство от рассеянного склероза ( РС). Исследование было завершено в июле 2010 года. [7] Двухлетние результаты были положительными. [8] Однако последующее сравнительное исследование TENERE сообщило, что «хотя постоянные прекращения [терапии] были существенно менее распространены среди пациентов с РС, получавших терифлуномид, по сравнению с интерфероном бета-1a , рецидивы были более распространены при приеме терифлуномида». [9] Препарат был одобрен для использования в Соединенных Штатах в сентябре 2012 года [10] [11] и для использования в Европейском Союзе в августе 2013 года. [5]
Побочные эффекты
Информация о назначении препарата Управлением по контролю за продуктами и лекарствами США предупреждает о потенциальной гепатотоксичности (повреждение печени, включая печеночную недостаточность) и тератогенности (врожденные дефекты). [4] Повышенный уровень фермента АЛТ является наиболее распространенным побочным эффектом (≥10% и ≥2% по сравнению с плацебо). [4]
Механизмы действия
Терифлуномид — иммуномодулирующий препарат, ингибирующий синтез пиримидина de novo путем блокирования фермента дигидрооротатдегидрогеназы . Неясно, объясняет ли это его влияние на поражения при рассеянном склерозе. [12]
Терифлуномид подавляет быстро делящиеся клетки, включая активированные Т-клетки, которые, как полагают, управляют процессом заболевания при рассеянном склерозе. Терифлуномид может снижать риск инфекций по сравнению с химиотерапевтическими препаратами из-за его более ограниченного воздействия на иммунную систему. [13]
Было обнаружено, что терифлуномид блокирует фактор транскрипции NF-κB . Он также ингибирует ферменты тирозинкиназы , но только в высоких дозах, не используемых в клинической практике. [14]
Активация лефлуномида в терифлуномид
Брендовый препарат терифлуномид является основным активным метаболитом in vivo дженерика лефлуномида. При введении лефлуномида 70% введенного препарата превращается в терифлуномид. Единственное различие между молекулами — это раскрытие изоксазольного кольца. Это считается простой структурной модификацией и технически простой одноэтапной синтетической трансформацией. При пероральном введении лефлуномида in vivo изоксазольное кольцо лефлуномида раскрывается и образуется терифлуномид. [15]

«Независимо от вводимого вещества (лефлуномид или терифлуномид), это одна и та же молекула (терифлуномид) — та, которая оказывает фармакологическое, иммунологическое или метаболическое действие с целью восстановления, исправления или изменения физиологических функций и не представляет собой при клиническом использовании новую химическую сущность для пациентов». [15] Из-за этого EMA изначально не считало терифлуномид новым активным веществом. [18]
Ссылки
- ^ ab "Teriflunomide (Aubagio) Use During Pregnancy" (Применение терифлуномида (аубаджио)) Drugs.com . 11 сентября 2019 г. Получено 2 марта 2020 г.
- ^ «Список всех препаратов с предупреждениями в черном ящике, составленный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»). nctr-crs.fda.gov . FDA . Получено 22 октября 2023 г. .
- ^ Анвиса (31 марта 2023 г.). «RDC № 784 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial» [Постановление Коллегиального совета № 784 - Списки наркотических, психотропных веществ, прекурсоров и других веществ, находящихся под особым контролем] (на бразильском португальском языке). Diário Oficial da União (опубликовано 4 апреля 2023 г.). Архивировано из оригинала 3 августа 2023 года . Проверено 16 августа 2023 г.
- ^ abc "Aubagio-teriflunomide tablet, film coated". DailyMed . 21 ноября 2023 г. Получено 13 июня 2024 г.
- ^ ab "Aubagio EPAR". Европейское агентство по лекарственным средствам (EMA) . 26 августа 2013 г. Получено 13 июня 2024 г.
- ^ Magne D, Mézin F, Palmer G, Guerne PA (ноябрь 2006 г.). «Активный метаболит лефлуномида, A77 1726, увеличивает пролиферацию человеческих синовиальных фибробластов в присутствии IL-1beta и TNF-alpha». Inflammation Research . 55 (11): 469–75 . doi :10.1007/s00011-006-5196-x. PMID 17122964. S2CID 47034503.
- ^ Номер клинического исследования NCT00134563 для «Исследования фазы III терифлуномида для снижения частоты рецидивов и накопления инвалидности у пациентов с рассеянным склерозом (TEMSO)» на ClinicalTrials.gov
- ^ "Терифлуномид компании Sanofi-Aventis одержал победу в двухлетнем исследовании III фазы рассеянного склероза". Новости генной инженерии и биотехнологии . 15 октября 2010 г.
- ^ Gever J (4 июня 2012 г.). «Терифлуномид — скромная помощь, но безопасен для больных рассеянным склерозом». medpage . Совместное заседание Консорциума центров рассеянного склероза и Американского комитета по лечению и исследованиям рассеянного склероза . Получено 4 июня 2012 г.
- ^ "Пакет одобрения препарата: таблетки Aubagio (терифлуномид) NDA #202992". Управление по контролю за продуктами и лекарствами США (FDA) . 5 ноября 2012 г. Получено 1 марта 2020 г.
- ^ "FDA одобряет новый препарат для лечения рассеянного склероза Aubagio" (пресс-релиз). Управление по контролю за продуктами и лекарствами США (FDA). Архивировано из оригинала 13 сентября 2012 г. Получено 14 сентября 2012 г.
- ^ Спрейцер Х (13 марта 2006 г.). «Neue Wirkstoffe - Терифлуномид». Österreichische Apothekerzeitung (на немецком языке) (6/2006).
- ^ Vollmer T (28 мая 2009 г.). «Методы лечения рассеянного склероза в разработке: терифлуномид». Новости EMS (28 мая 2009 г.).
- ^ Breedveld FC, Dayer JM (ноябрь 2000 г. ) . «Лефлуномид: способ действия при лечении ревматоидного артрита». Annals of the Rheumatic Diseases . 59 (11): 841– 9. doi :10.1136/ard.59.11.841. PMC 1753034. PMID 11053058.
- ^ ab Melchiorri D, van Zwieten-Boot B, Romaldas M, Nela V, Karsten BS, Ian H, et al. "Отчет об оценке. AUBAGIO (международное непатентованное наименование: терифлуномид). Процедура № EMEA/H/C/002514/0000" (PDF) . Европейское агентство по лекарственным средствам . стр. 119. Архивировано из оригинала (PDF) 17 июля 2015 г. . Получено 5 июня 2015 г. .
- ^ Rozman B (2002). «Клиническая фармакокинетика лефлуномида». Клиническая фармакокинетика . 41 (6): 421– 30. doi :10.2165/00003088-200241060-00003. PMID 12074690. S2CID 33745823.
- ^ "Обзор клинической фармакологии/биофармацевтики. Продукт: Арава (таблетки лефлуномида). Номер заявки: NDA 20905" (PDF) . Управление по контролю за продуктами и лекарствами США (FDA) . Получено 15 апреля 2016 г. .
- ^ "Summary of Opinion (Initial Authorisation): Aubagio (терифлуномид)" (PDF) . Европейское агентство по лекарственным средствам. Архивировано из оригинала (PDF) 13 марта 2016 г. . Получено 15 апреля 2016 г. .
