процесс Сольвея
Процесс Сольве или аммиачно-содовый процесс является основным промышленным процессом производства карбоната натрия (кальцинированной соды, Na2CO3 ) . Процесс аммиачно- содовый был разработан в его современной форме бельгийским химиком Эрнестом Сольве в 1860-х годах. [1] Ингредиенты для этого легкодоступны и недороги: соляной раствор (из внутренних источников или из моря) и известняк ( из карьеров). Мировое производство кальцинированной соды в 2005 году оценивалось в 42 миллиона тонн, [2] что составляет более шести килограммов (13 фунтов) в год на каждого человека на Земле. Химические заводы на базе Сольве в настоящее время производят примерно три четверти этого объема, а остальная часть добывается из природных месторождений. Этот метод заменил процесс Леблана .
История
Название «кальцинированная сода» основано на основном историческом методе получения щелочи, который заключался в использовании воды для извлечения ее из золы определенных растений. Дровяной огонь давал поташ и его преобладающий компонент карбонат калия (K 2 CO 3 ), тогда как зола этих особых растений давала «кальцинированную соду» и ее преобладающий компонент карбонат натрия (Na 2 CO 3 ). Слово «сода» (из среднелатинского) первоначально относилось к определенным растениям, которые растут в соляных растворах; было обнаружено, что зола этих растений давала полезную щелочь кальцинированную соду. Выращивание таких растений достигло особенно высокого уровня развития в 18 веке в Испании, где растения называются barrilla (или « barilla » на английском языке). [3] [4] [5] Зола ламинарии также дает кальцинированную соду и была основой огромной промышленности 18 века в Шотландии. [6] Щелочь также добывалась из высохших озер в Египте.
К концу 18 века этих источников было недостаточно для удовлетворения растущего спроса Европы на щелочь для мыловаренной, текстильной и стекольной промышленности. [7] В 1791 году французский врач Николя Леблан разработал метод производства кальцинированной соды с использованием соли, известняка , серной кислоты и угля . Хотя процесс Леблана стал доминировать в производстве щелочи в начале 19 века, стоимость его входов и его загрязняющие побочные продукты (включая газообразный хлористый водород ) сделали очевидным, что это было далеко не идеальное решение. [7] [8]
Сообщалось, что в 1811 году французский физик Огюстен Жан Френель обнаружил, что бикарбонат натрия выпадает в осадок, когда углекислый газ барботируется через аммиачные рассолы, что является химической реакцией, являющейся центральной в процессе Сольве. Открытие не было опубликовано. Как отметил Десмонд Рейли, «История эволюции аммиачно-содового процесса является интересным примером того, как открытие может быть сделано, а затем отложено и не применяться в течение значительного времени после этого». [9] Серьёзное рассмотрение этой реакции как основы промышленного процесса восходит к британскому патенту, выданному в 1834 году Х. Г. Даяру и Дж. Хеммингу. Было предпринято несколько попыток свести эту реакцию к промышленной практике, с разным успехом.
В 1861 году бельгийский промышленный химик Эрнест Сольве обратил свое внимание на эту проблему; он, по-видимому, в значительной степени не знал о более ранних обширных работах. [8] Его решением была 24-метровая (79 футов) газовая абсорбционная башня, в которой углекислый газ бурлил через нисходящий поток рассола. Это, вместе с эффективным восстановлением и рециркуляцией аммиака, оказалось эффективным. К 1864 году Сольве и его брат Альфред получили финансовую поддержку и построили завод в Куйе , сегодня пригороде бельгийского города Шарлеруа . Новый процесс оказался более экономичным и менее загрязняющим, чем метод Леблана, и его использование распространилось. В 1874 году Сольве расширили свои мощности, построив новый, более крупный завод в Нанси , Франция.
В том же году Людвиг Монд посетил Solvay в Бельгии и приобрел права на использование новой технологии. Он и Джон Бруннер основали фирму Brunner, Mond & Co. и построили завод Solvay в Виннингтоне , недалеко от Нортвича , Чешир , Англия. Завод начал работу в 1874 году. Монд сыграл важную роль в том, чтобы процесс Solvay стал коммерчески успешным. Он внес несколько усовершенствований между 1873 и 1880 годами, которые удалили побочные продукты, которые могли замедлить или остановить процесс.
В 1884 году братья Солвей выдали американцам Уильяму Б. Когсвеллу и Роуленду Хазарду лицензию на производство кальцинированной соды в США и создали совместное предприятие ( Solvay Process Company ) для строительства и эксплуатации завода в Солвее, штат Нью-Йорк .

К 1890-м годам заводы, работающие по методу Сольве, производили большую часть мировой кальцинированной соды.
В 1938 году недалеко от реки Грин-Ривер в Вайоминге были обнаружены крупные месторождения минерала трона, из которого карбонат натрия можно извлекать дешевле, чем производить этим способом. Первоначальный завод Solvay New York закрылся в 1986 году, его заменил в США завод в Грин-Ривер. Во всем остальном мире процесс Solvay остается основным источником кальцинированной соды.
Химия
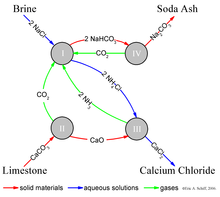

Процесс Сольве приводит к получению кальцинированной соды (преимущественно карбоната натрия ( Na2CO3 ) ) из рассола ( как источника хлорида натрия (NaCl)) и из известняка (как источника карбоната кальция (CaCO3 ) ). [8] Общий процесс выглядит следующим образом:
Фактическая реализация этой глобальной, общей реакции сложна. [10] [11] [12] Упрощенное описание можно дать с использованием четырех различных взаимодействующих химических реакций, показанных на рисунке. На первом этапе процесса диоксид углерода (CO 2 ) проходит через концентрированный водный раствор хлорида натрия (поваренная соль, NaCl) и аммиака (NH 3 ).
- ---(Я)
В промышленной практике реакция осуществляется путем пропускания концентрированного рассола (соленой воды) через две башни. В первой аммиак барботирует через рассол и поглощается им. Во второй углекислый газ барботирует через аммиачный рассол, а бикарбонат натрия (пищевая сода) выпадает в осадок из раствора. Обратите внимание, что в основном растворе NaHCO3 менее растворим в воде, чем хлорид натрия. Аммиак (NH3 ) буферизует раствор при основном (высоком) pH ; без аммиака побочный продукт соляной кислоты сделал бы раствор кислым и остановил бы осаждение. Здесь NH3 вместе с аммиачным рассолом действует как маточный раствор .
Необходимый аммиачный «катализатор» для реакции (I) восстанавливается на более позднем этапе, и аммиака потребляется относительно мало. Диоксид углерода, необходимый для реакции (I), производится путем нагревания (« кальцинации ») известняка при 950–1100 °C и путем кальцинации бикарбоната натрия (см. ниже). Карбонат кальция (CaCO 3 ) в известняке частично преобразуется в негашеную известь (оксид кальция (CaO)) и диоксид углерода:
- ---(II)
Бикарбонат натрия (NaHCO3 ) , выпадающий в осадок в ходе реакции (I), отфильтровывают из горячего раствора хлорида аммония (NH4Cl ) , а затем раствор вводят в реакцию с негашеной известью (оксидом кальция (CaO)), оставшейся после нагревания известняка на этапе (II).
- ---(III)
CaO образует сильный щелочной раствор. Аммиак из реакции (III) возвращается обратно в исходный солевой раствор реакции (I).
Осадок бикарбоната натрия (NaHCO3 ) , полученный в результате реакции (I), затем преобразуется в конечный продукт, карбонат натрия (стиральная сода: Na2CO3 ) , путем прокаливания (160–230 °C), в результате чего в качестве побочных продуктов образуются вода и диоксид углерода:
- ---(IV)
Углекислый газ с этапа (IV) восстанавливается для повторного использования на этапе (I). При правильном проектировании и эксплуатации установка Solvay может утилизировать почти весь свой аммиак и потребляет лишь небольшое количество дополнительного аммиака для компенсации потерь. Единственными основными входами в процесс Solvay являются соль, известняк и тепловая энергия , а его единственным основным побочным продуктом является хлорид кальция , который иногда продается как дорожная соль .
После изобретения Габера и других новых процессов получения аммиака в 1910-х и 1920-х годах его цена упала, и потребность в его утилизации снизилась. Поэтому в модифицированном процессе Сольве, разработанном китайским химиком Хоу Дебангом в 1930-х годах, первые несколько шагов такие же, как и в процессе Сольве, но CaCl2 заменяется хлоридом аммония (NH4Cl ) . Вместо обработки оставшегося раствора известью в раствор закачивают углекислый газ и аммиак, затем добавляют хлорид натрия до тех пор, пока раствор не насытится при 40 °C. Затем раствор охлаждают до 10 °C. Хлорид аммония осаждается и удаляется фильтрацией, а раствор перерабатывается для получения большего количества карбоната натрия. Процесс Хоу исключает производство хлорида кальция. Побочный продукт хлорид аммония может быть очищен, использован в качестве удобрения и может иметь большую коммерческую ценность, чем CaCl2 , тем самым уменьшая объем отвалов.
Дополнительные сведения о промышленной реализации этого процесса доступны в отчете, подготовленном для Европейской ассоциации производителей кальцинированной соды. [11]
Побочные продукты и отходы
Основным побочным продуктом процесса Сольве является хлорид кальция (CaCl 2 ) в водном растворе. В процессе также есть другие отходы и побочные продукты. [11] Не весь известняк, который прокаливается, преобразуется в негашеную известь и диоксид углерода (в реакции II); остаточный карбонат кальция и другие компоненты известняка становятся отходами. Кроме того, соляной раствор, используемый в процессе, обычно очищается для удаления ионов магния и кальция, как правило, для образования карбонатов ( MgCO 3 , CaCO 3 ); в противном случае эти примеси привели бы к образованию накипи в различных реакционных сосудах и башнях. Эти карбонаты являются дополнительными отходами.
На внутренних заводах, таких как в Солвее, штат Нью-Йорк , побочные продукты были отложены в «отходах»; вес материала, отложенного в этих отходах, превысил вес произведенной кальцинированной соды примерно на 50%. Эти отходные слои привели к загрязнению воды, в основном кальцием и хлоридом. Отходы в Солвее, штат Нью-Йорк, существенно увеличили соленость в близлежащем озере Онондага , которое раньше было одним из самых загрязненных озер в США [13] и является местом суперфондового загрязнения. [14] По мере того, как такие отходные слои стареют, они начинают поддерживать растительные сообщества, которые были предметом нескольких научных исследований. [15] [16]
В прибрежных местах, таких как Саураштра , Гуджарат, Индия, [17] раствор CaCl 2 может быть сброшен непосредственно в море, по-видимому, без существенного вреда для окружающей среды (хотя небольшое количество тяжелых металлов в нем может быть проблемой), основная проблема заключается в том, что место сброса попадает в Морской национальный парк залива Кач, который служит средой обитания для коралловых рифов, морской травы и сообщества морских водорослей. В Осборне, Южная Австралия , [18] отстойный пруд теперь используется для удаления 99% CaCl 2 , поскольку предыдущий сброс заилил судоходный канал. В Розиньяно-Сольвей в Тоскане, Италия, известняковые отходы, произведенные фабрикой Solvay, изменили ландшафт, создав «Spiagge Bianche» («Белые пляжи»). В отчете, опубликованном в 1999 году Программой ООН по окружающей среде (ЮНЕП), Spiagge Bianche перечислены среди приоритетных горячих точек загрязнения в прибрежных районах Средиземного моря. [19]
Секвестрация углерода и процесс Сольве
Для связывания углерода были предложены вариации процесса Сольвея . Одна из идей заключается в том, чтобы взаимодействовать с диоксидом углерода, который, возможно, образуется при сжигании угля, с образованием твердых карбонатов (таких как бикарбонат натрия), которые можно хранить постоянно, избегая таким образом выбросов диоксида углерода в атмосферу. [20] [21] Процесс Сольвея можно модифицировать, чтобы получить общую реакцию:
- 2 NaCl + CaCO3 + CO
2+ Н
2O → 2NaHCO3 + CaCl2
Были предложены вариации процесса Сольвея для преобразования выбросов углекислого газа в карбонаты натрия, но связывание углерода карбонатами кальция или магния представляется более перспективным. [ сомнительно – обсудить ] Однако количество углекислого газа, которое может быть использовано для связывания углерода кальцием или магнием (по сравнению с общим количеством углекислого газа, выбрасываемого человечеством), очень мало. Это в первую очередь связано с большой разницей в осуществимости между улавливанием углекислого газа из контролируемых и концентрированных источников выбросов, таких как угольные электростанции, по сравнению с улавливанием углерода из неконцентрированных мелкомасштабных источников углерода, таких как небольшие пожары, выхлопные газы транспортных средств, человеческое дыхание и т. д. при использовании таких методов. Более того, вариация процесса Сольвея, скорее всего, добавит дополнительный энергоемкий этап, что увеличит выбросы углекислого газа, если не будут использоваться углеродно-нейтральные источники энергии, такие как гидроэнергетика , ядерная энергия , энергия ветра или солнца .
Смотрите также
- Хлорщелочной процесс
- Процесс Хоу , метод производства, аналогичный процессу Сольвея, но аммиак не перерабатывается.
Ссылки
- ^ Ло, Джонатан ЛоДжонатан; Ренни, Ричард (2020-03-19), Ло, Джонатан; Ренни, Ричард (ред.), «Процесс Сольве», Словарь химии , Oxford University Press, doi : 10.1093/acref/9780198841227.001.0001, ISBN 978-0-19-884122-7, получено 2020-10-08
- ^ Костик, Деннис (2006). «Soda Ash», глава в 2005 Minerals Yearbook, United States Geological Survey. См. Таблицу I.
- ^ Барилла, используемая для производства кальцинированной соды, относится к любому из нескольких кустистых растений, которые хорошо приспособлены для роста в солончаках и которые распространены в Испании и Италии. Зола этих растений может содержать до 30% карбоната натрия. Основными видами для производства кальцинированной соды были « солянки » Salsola soda или Salsola kali , но также могли использоваться и несколько других видов.
- ^ Перес, Хоакин Фернандес (1998). «От баррильи до фабрики Solvay в Торрелавеге: производство солянки в Испании», Antilia: Испанский журнал истории естественных наук и технологий, том IV, статья 1. ISSN 1136-2049. Архивировано WebCite из этого исходного URL 01.03.2008.
- ^ Грив, М. (1931). A Modern Herbal, ISBN 0-486-22798-7 и 0486227995. См. раздел о солянке. Получено 21 октября 2005 г.
- ^ Хотерсолл, Сьюзен (2012). «Шотландская индустрия водорослей и ее археология» (PDF) . Исторический Аргайл : 32–36.
- ^ ab Kiefer, David M. "It was all about alkali". Today's Chemist at Work . 11 (1): 45–6. Архивировано из оригинала 7 ноября 2002 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка )Онлайн-версия заархивирована на WebCite по этому оригинальному URL-адресу 12.03.2008. - ^ abc Кифер, Дэвид М. (февраль 2002 г.). «Soda Ash, Solvay Style». Today's Chemist at Work . 11 (2): 87–88, 90. Архивировано из оригинала 20 января 2003 г.
{{cite journal}}: CS1 maint: неподходящий URL ( ссылка )Онлайн-версия заархивирована на WebCite по этому оригинальному URL-адресу 12.03.2008. - ↑ Рейли, Десмонд (декабрь 1951 г.). «Соли, кислоты и щелочи в 19 веке. Сравнение достижений Франции, Англии и Германии». Isis . 42 (4): 287–296. doi :10.1086/349348. JSTOR 226807. PMID 14888349. S2CID 8272431.
- ^ Спейт, Джеймс (2001). Справочник по химическим процессам и проектированию . McGraw Hill. ISBN 978-0-07-137433-0.
- ^ abc «Справочный документ по передовым методам производства кальцинированной соды (BREF)», отчет, подготовленный Европейской ассоциацией производителей кальцинированной соды. Архивировано 03.10.2006 на Wayback Machine , март 2004 г. Архивировано на WebCite с этого исходного URL-адреса. Архивировано 07.04.2008 на Wayback Machine 01.03.2008.
- ^ Мур, Джон Т. Эдд (2005). Химия — это просто . Broadway Books. С. 190. ISBN 978-0-7679-1702-5.
- ^ Партнерство озера Онондага. Получено 14 октября 2006 г.
- ^ Агентство по охране окружающей среды США, идентификатор суперфонда NYD986913580. Архивировано 17 мая 2011 г. на Wayback Machine . Получено 14 октября 2006 г.
- ^ Кон, EVJ; Ростанский А.; Токарска-Гузик, Б.; Труман, IC; Возняк, Г. (2001). «Флора и растительность старой вершины Сольвеевского процесса в Явожно (Верхняя Силезия, Польша)». Акта Соц. Бот. Пол . 70 (1): 47–60. дои : 10.5586/asbp.2001.008 . hdl : 20.500.12128/13191 .
- ^ Михаленко, Эдвард М. (1991). «Педогенез и сукцессия микросообщества беспозвоночных в незрелых почвах, образовавшихся из хлорщелочных отходов», докторская диссертация, Государственный университет Нью-Йорка, Колледж наук об окружающей среде и лесном хозяйстве .
- ^ "Технологии в индийской содовой промышленности", Отчет о состоянии технологий № 148 (октябрь 1995 г.), Департамент научных и промышленных исследований, Министерство науки и технологий Индии. Архивировано WebCite с этого исходного URL 01.03.2008.
- ^ Penrice Soda Holdings Limited. Получено 14 октября 2006 г.
- ^ ЮНЕП. Координационный отдел Средиземноморского плана действий, Программа мониторинга и исследований загрязнения Средиземноморья, ВОЗ (1999). «Определение приоритетных очагов загрязнения и чувствительных районов в Средиземноморье» (PDF) . Серия технических отчетов MAP (124) . Получено 11 сентября 2020 г.
- ^ Huijgen, WJJ и Comans, RNJ (февраль 2003 г.). «Секвестрация углекислого газа путем карбонизации минералов: обзор литературы», Отчет ECN C-03-016, Центр энергетических исследований Нидерландов. Получено 14 октября 2006 г.
- ^ Лакнер, Клаус С. (2002). «Карбонатная химия для секвестрации ископаемого углерода». Ежегодный обзор энергетики и окружающей среды . 27 (1): 193–232. doi :10.1146/annurev.energy.27.122001.083433.
Дальнейшее чтение
- Моффат, Вики; Уолмсли, М.Р.В. (2006). «Понимание кинетики кальцинирования извести для снижения затрат на энергию». Техническая ассоциация целлюлозно-бумажной промышленности Южной Африки.Минимальная энергия, необходимая для обжига известняка, составляет около 3,16 гигаджоулей (3,00 миллиона британских тепловых единиц) на тонну.
Внешние ссылки
- Европейская ассоциация производителей кальцинированной соды (ESAPA) Архивировано 03.10.2006 на Wayback Machine
- Хронология завода в США в Солвей, штат Нью-Йорк
- Соль и химическая революция
- Схема технологического процесса Сольве




