Общий синтез афлатоксина
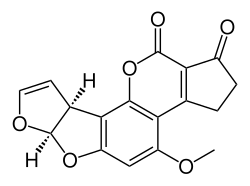
Полный синтез афлатоксина касается полного синтеза группы органических соединений , называемых афлатоксинами . Эти соединения встречаются в природе в нескольких грибах . Как и в случае с другими химическими соединениями, являющимися объектами органической химии , органический синтез афлатоксинов служит различным целям. Традиционно он служил для доказательства структуры сложного биосоединения в дополнение к доказательствам, полученным с помощью спектроскопии. Он также демонстрирует новые концепции в органической химии (реагенты, типы реакций) и открывает путь к молекулярным производным, не встречающимся в природе. И для практических целей синтетическое биосоединение является коммерческой альтернативой выделению соединения из природных ресурсов. Афлатоксины, в частности, добавляют еще одно измерение, поскольку есть подозрение, что они массово производились в прошлом из биологических источников в рамках программы по созданию биологического оружия . [1] [2]
Синтез рацемического афлатоксина B1 был описан Бьючи и др. в 1967 году [3] , а рацемического афлатоксина B2 — Робертсом и др. в 1968 году [4]. Группа Барри Троста из Стэнфордского университета осуществила энантиоселективный полный синтез (+)-афлатоксина B1 и B2a в 2003 году [5]. В 2005 году группа Э. Дж. Кори из Гарвардского университета представила энантиоселективный синтез афлатоксина B2 . [ 6]
Синтез афлатоксина В2
Полный синтез афлатоксина B2 представляет собой многоступенчатую последовательность, которая начинается с [2+3] циклоприсоединения между хиноном 1 и 2,3-дигидрофураном . Эта реакция катализируется катализатором CBS и является энантиоселективной . Следующим шагом является ортоформилирование продукта реакции 2 в реакции Даффа . Гидроксильная группа в 3 этерифицируется трифторметансульфоновым ангидридом , который добавляет защитную группу трифторметансульфоната . Этот шаг позволяет провести реакцию Гриньяра альдегидной группы в 4 с метилмагнийбромидом до спирта 5 , который затем окисляется периодинаном Десса-Мартина до кетона 6. Окисление Байера -Виллигера превращает кетон в сложный эфир ( 7 ), а восстановление никелем Ренея превращает сложный эфир в спирт и удаляет группу трифторметансульфоновой кислоты. На последнем этапе скелет кумарина добавляется к 9 путем комбинированной реакции сочетания с карбонатом цинка винилбромида в 8 и этапа переэтерификации между фенольной группой и этилэфирной группой.
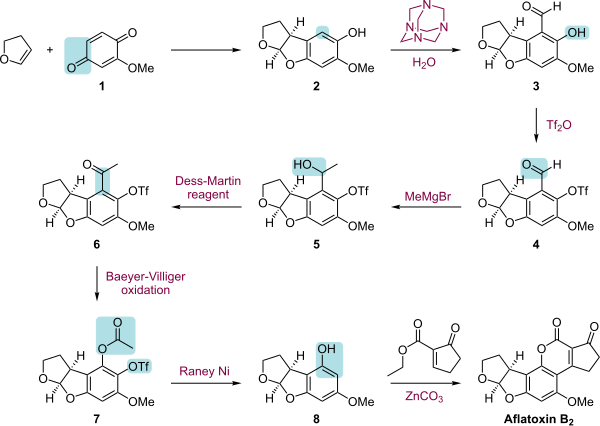 |
| Афлатоксин В2 общий синтез |
|---|
Ссылки
- ^ Зилинскас, Рэймонд А. (1997). «Биологическое оружие Ирака. Прошлое как будущее?». JAMA . 278 (5): 418–424. doi :10.1001/jama.1997.03550050080037.
- ^ Venkataramana, M.; Chandranayaka, S.; Prakash, HS; Niranjana, SR (2015). «Микотоксины, имеющие отношение к биологической войне, и их обнаружение». В Gopalakrishnakone, P.; Balali-Mood, Mahdi; Llewellyn, Lyndon; Singh, Bal Ram (ред.). Биологические токсины и биотерроризм . Springer. стр. 295–319. ISBN 978-94-007-5869-8.
- ^ Бьючи, Джордж; Фоулкс, Д.М.; Куроно, Масаясу; Митчелл, Гэри Ф.; Шнайдер, Ричард Стивен (1967). «Полный синтез рацемического афлатоксина B1». Журнал Американского химического общества . 89 (25): 6745–53. doi :10.1021/ja01001a062. PMID 6063661.
- ^ Робертс, Джон К.; Шеппард, AH; Найт, JA; Роффи, Патрик (1968). «Исследования по микологической химии. Часть XXII. Полный синтез (±)-афлатоксина-B2». Журнал химического общества C: Organic . 1 : 22–24. doi :10.1039/J39680000022. PMID 5688875.
- ^ Trost, BM; Toste, FD "Кинетические и динамические кинетические асимметричные превращения γ-ацилоксибутенолидов, катализируемые палладием. Энантиоселективный полный синтез (+)-афлатоксина B 1 и B 2a ". J. Am. Chem. Soc. 2003 , 125 , 3090–3100. doi :10.1021/ja020988s
- ^ Чжоу, Г.; Кори, Э.Дж. «Короткий энантиоселективный полный синтез афлатоксина B 2 с использованием асимметричного [3+2]-циклоприсоединения». J. Am. Chem. Soc. 2005 , 127 , 11958–11959. doi :10.1021/ja054503m