Атроп-абиссомицин С
 | |
| Имена | |
|---|---|
| Название ИЮПАК 12,14a,3-(Эпоксиметино)-2H-1-бензоксациклододецин-2,4,8(5H,10aH)-трион, 6,7,11,12,13,14-гексагидро-11-гидрокси-5,7,13-триметил-, (5R,7S,9E,10aR,11R,12R,13R,14aR) | |
| Другие имена Атроп -абиссомицин С | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ChEMBL |
|
| ChemSpider |
|
CID PubChem |
|
| |
| |
| Характеристики | |
| С19Н22О6 | |
| Молярная масса | 346,38 г/моль |
| Плотность | 1,34±0,1 г/см3 (прогноз) |
| Температура плавления | 180 °C (разложение) |
| Точка кипения | 597,5±50,0 °C (прогноз) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Атроп -абиссомицин C — это полициклический поликетидный природный продукт, являющийся атропоизомером абиссомицина C. Это спиротетронат, который относится к классу тетронатных антибиотиков , включающему такие соединения, как тетрономицин, агломерин и хлоротрицин. [1] В 2006 году группа Николау открыла атроп -абиссомицин C, работая над полным синтезом абиссомицина C. [2] Затем в 2007 году Зюссмут и его коллеги выделили атроп -абиссомицин C из Verrucosispora maris AB-18-032, морского актиномицета, обнаруженного в отложениях Японского моря. Они обнаружили, что атроп -абиссомицин C был основным метаболитом, продуцируемым этим штаммом, в то время как абиссомицин C был второстепенным продуктом. Молекула проявляет антибактериальную активность, ингибируя фермент PabB ( 4-амино-4-дезоксихоризматсинтаза ), тем самым истощая биосинтез п -аминобензоата . [3] [4]
Структура
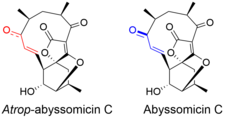
Атроп -абиссомицин C имеет сложную, но интригующую структурную топографию. Соединение содержит оксабицикло[2.2.2]октановую систему, слитую с тетронатной частью. 11-членное макроциклическое кольцо несет α,β-ненасыщенный кетон, который, как предполагается, является реактивным центром. [5] Несмотря на то, что это напряженный макроцикл, существует атропоизомер , абиссомицин C. Атропоизомерия возникает из-за структурного отклонения в области α,β-ненасыщенного кетона молекулы. Ориентация карбонила в атроп -абиссомицине C является цисоидной, тогда как конформация в абиссомицине C является трансоидной. [6] Енонная часть атроп -абиссомицина C имеет более высокую степень сопряжения, что делает его более активным акцептором Михаэля. [7]
Биосинтез
Биосинтез атроп -абиссомицина C начинается с синтеза линейной поликетидной цепи в системе PKS I, состоящей из одного загрузочного и шести удлинительных модулей. Поликетидная цепь состоит из пяти ацетатов, двух пропионатов и метаболита гликолитического пути. D-1,3-бисфосфоглицерат, гликолитический метаболит, переносится на AbyA3 (белок-переносчик ацила) с помощью AbyA2 для образования глицерил-АПБ. AbyA1 облегчает присоединение глицерил-АПБ к поликетидной цепи и отсоединение поликетида от поликетидсинтазы с образованием промежуточного продукта 2. [7] [8] [ 9]

На основании наблюдения, сделанного для биосинтеза агломерина, было высказано предположение, что AbyA4 ацетилирует промежуточное соединение 2 , а AbyA5 катализирует элиминацию уксусной кислоты с образованием экзоциклической двойной связи в промежуточном соединении 4. [ 1] Было высказано предположение, что внутримолекулярная реакция Дильса-Альдера происходит между экзоциклическим олефином и сопряженным диеном в хвостовой части поликетида с образованием макроциклического кольца. [7] Сообщалось, что ранее не идентифицированный ген Abycyc может кодировать фермент, который осуществляет циклоприсоединение Дильса-Альдера. [10] После реакции Дильса-Альдера образуется эпоксидное кольцо, которое затем раскрывается тетронатной гидроксильной группой с образованием атроп -абиссомицина С. Было высказано предположение, что монооксигеназа AbyE катализирует образование эпоксида. [8]

Ссылки
- ^ ab Канчанабанка С., Тао, В., Хонг, Х., Лю, Ю., Хань, Ф., Самборский, М., Дэн, З., Сунь, Ю., Лидли, П.Ф. (2013). «Необычное ацетилирование-элиминирование при образовании тетранатных антибиотиков». Angewandte Chemie, международное издание . 52 (22): 5785– 8. doi :10.1002/anie.201301680. ПМИД 23606658.
- ^ Николау К, Харрисон, СТ (2006). «Полный синтез абиссомицина С и атроп-абиссомицина С**». Angewandte Chemie International Edition . 45 (20): 3256– 60. doi :10.1002/anie.200601116. PMID 16634106.
- ^ Келлер С., Николсон Г., Драль К., Соренсен Э., Фидлер Х. П., Зюссмут Р. Д. (2007). «Абиссомицины G и H и атроп-абиссомицин С из морского штамма Verrucosispora AB-18-032». Журнал антибиотиков . 60 (6): 391– 4. doi : 10.1038/ja.2007.54 . PMID 17617698.
- ^ Келлер С, Шадт ХС, Ортель И, Зюссмут РД (2007). «Действие атроп-абиссомицина С как ингибитора 4-амино-4-дезоксихоризматсинтазы PabB». Angew. Chem. Int. Ed. Engl . 46 (43): 8284– 6. doi :10.1002/anie.200701836. PMID 17886307.
- ^ Николау К, Харрисон, СТ, Чен, Дж. С. (2009). «Открытия из бездны: абиссомицины и их полный синтез». Синтез . 2009 (1): 33– 42. doi :10.1055/s-0028-1083259. PMC 2677807. PMID 20047014 .
- ^ Николау К., Харрисон, ST (2007). «Полный синтез абиссомицина C, атроп-абиссомицина C и абиссомицина D: значение для естественного происхождения атроп-абиссомицина C». Журнал Американского химического общества . 129 (2): 429–40 . doi :10.1021/ja067083p. ПМИД 17212423.
- ^ abc Savic V (2013). "Глава 5 – Абиссомицины: выделение, свойства и синтез". Исследования по химии натуральных продуктов . 40 : 133– 172. doi :10.1016/B978-0-444-59603-1.00005-9.
- ^ ab Gottardi E, Krawczyk, J., von Suchodoletz, H., Schadt, S., Mühlenweg, A., Uguru, G., Süssmuth, RD (2011). «Биосинтез абиссомицина: образование необычного поликетида, исследования кормления антибиотиками и генетический анализ». ChemBioChem . 12 (9): 1401– 1410. doi :10.1002/cbic.201100172. PMC 3625739 . PMID 21656887.
- ^ Vieweg L, Reichau, S., Schobert, R, Leadlay, PF, Süssmuth, R. (2014). «Последние достижения в области биоактивных тетронатов». Natural Product Reports . 31 (11): 1554–1584 . doi : 10.1039/c4np00015c . PMID 24965099.
- ^ Хашимото Т., Хашимото, Дж., Теруя, К., Хирано, Т., Син-я, К., Икеда, Х., Лю, Х. В., Нишияма, М., Кузуяма Т. (2015). «Биосинтез версипелостатина: идентификация катализируемого ферментом [4+2]-циклоприсоединения, необходимого для макроциклизации поликетидов, содержащих спиротетронат». Журнал Американского химического общества . 137 (2): 572– 5. doi : 10.1021/ja510711x. PMC 4308742. PMID 25551461 .