Открытие и разработка ингибиторов АПФ
Открытие перорально неактивного пептида из змеиного яда установило важную роль ингибиторов ангиотензинпревращающего фермента (АПФ) в регуляции артериального давления . Это привело к разработке каптоприла , первого ингибитора АПФ . Когда побочные эффекты каптоприла стали очевидны, были разработаны новые производные. Затем, после открытия двух активных участков АПФ: N-домена и C-домена, началась разработка домен-специфических ингибиторов АПФ. [1] [2]
Разработка ингибиторов АПФ первого поколения
Разработка нонапептида тепротида ( Glu - Trp - Pro - Arg -Pro- Gln - Ile -Pro-Pro), который был первоначально выделен из яда бразильской ямкоголовой змеи Bothrops jararaca , значительно прояснила важность АПФ при гипертонии . Однако отсутствие у него пероральной активности ограничило его терапевтическую полезность. [3] [4]
L- бензилянтарная кислота (2(R)-бензил-3-карбоксипропионовая кислота) была описана как наиболее мощный ингибитор карбоксипептидазы А в начале 1980-х годов. Авторы называли ее аналогом побочного продукта , и было предложено связываться с активным сайтом карбоксипептидазы А через сукцинилкарбоксигруппу и карбонильную группу . Их выводы установили, что L-бензилянтарная кислота связана в одном локусе в активном сайте карбоксипептидазы А. Авторы обсудили, но отклонили предположение о том, что карбоксилатная функция может связываться с каталитически функциональным ионом цинка , присутствующим в активном сайте. Однако позже было обнаружено, что это так. [3] [5] [6]
Разработка препарата каптоприл (сульфгидрилы)
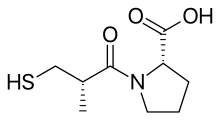
Более 2000 соединений были протестированы случайным образом в тесте подвздошной кишки морской свинки , и было обнаружено, что сукцинил-L-пролин обладает свойствами специфического ингибитора АПФ. Он показал ингибирующий эффект на ангиотензин I и брадикинин, не оказывая никакого влияния на ангиотензин II . Затем исследователи начали искать модель, которая объяснила бы ингибирование на основе специфических лекарственных взаимодействий соединений с активным центром АПФ. [5] Предыдущие исследования с субстратами и ингибиторами АПФ предполагали, что это был цинксодержащий металлопротеин и карбоксипептидаза, похожая на панкреатическую карбоксипептидазу А. Однако АПФ высвобождает дипептиды, а не отдельные аминокислоты из С-конца пептидных субстратов. И предполагалось, что как механизм их действия , так и их активный центр могут быть схожими. Считалось, что положительно заряженный Arg 145 в активном центре связывается с отрицательно заряженной С-концевой карбоксильной группой пептидного субстрата. Было также высказано предположение, что АПФ связывается посредством водородной связи с терминальной, неразрывной, пептидной связью субстрата. [3]
Но поскольку АПФ является дипептидной карбоксипептидазой, в отличие от карбоксипептидазы А, расстояние между катионным карбоксильным связывающим сайтом и атомом цинка должно быть больше, примерно на длину одного аминокислотного остатка. Пролин был выбран в качестве аминокислотного фрагмента из-за его присутствия в качестве карбоксильного концевого аминокислотного остатка в тепротиде и других ингибиторах АПФ, обнаруженных в ядах змей. Было протестировано одиннадцать других аминокислот, но ни одна из них не оказалась более ингибирующей. Поэтому было предложено, что производное аминокислоты сукцинила должно быть ингибитором АПФ, и было обнаружено, что сукцинил-L-пролин является таким ингибитором. [3] [5] [7]
Также было известно, что природа предпоследнего аминокислотного остатка пептидного субстрата для АПФ влияет на связывание с ферментом. Ацильная группа карбоксиалканоиламинокислоты связывает ион цинка фермента и занимает то же положение в активном центре АПФ, что и предпоследняя. Следовательно, заместитель ацильной группы также может влиять на связывание с ферментом. Было обнаружено, что 2- метильный заместитель с конфигурацией D усиливает ингибирующую активность примерно в 15 раз по сравнению с сукцинил-L-пролином. Затем начался поиск лучшей цинксвязывающей группы. Замена сукцинилкарбоксильной группы азотсодержащими функциональными группами ( амином , амидом или гуанидином ) не усилила ингибирующую активность. Однако прорыв в эффективности был достигнут путем замены карбоксильной группы на сульфгидрильную функцию ( SH ), группу с большим сродством к связанному с ферментом иону цинка. Это дало мощный ингибитор, который был в 1000 раз более мощным, чем сукцинил-L-пролин. [3] [7] Было обнаружено , что оптимальной длиной ацильной цепи для меркаптоалканоильных производных пролина является 3-меркаптопропаноил-L-пролин, в 5 раз больше, чем у 2-меркаптоалканоильных производных и в 50 раз больше, чем у 4-меркаптоалканоильных производных. Таким образом, D-3-меркапто-2-метилпропаноил-L-пролин или каптоприл был самым мощным ингибитором. Позже исследователи сравнили несколько ингибиторов меркаптоациламинокислот и пришли к выводу, что связывание ингибитора с ферментом включало водородную связь между донорным сайтом на ферменте и кислородом амидного карбонила, во многом как и предсказывалось для субстратов. [3] [8]
Разработка лекарственных средств других ингибиторов АПФ первого поколения


Наиболее распространенные побочные эффекты Каптоприла, кожная сыпь и потеря вкуса , такие же, как и у меркаптосодержащего пеницилламина . Поэтому группа исследователей поставила себе целью найти мощные селективные ингибиторы АПФ, которые не содержали бы меркапто (SH)-функцию и имели бы более слабую хелатирующую функцию. Они вернулись к работе с карбоксильными соединениями и начали работать с замещенными N -карбоксиметил-дипептидами в качестве общей структуры (R-CHCOOH-A 1 -A 2 ). Согласно предыдущим исследованиям, они предположили, что циклические иминокислоты приведут к хорошей эффективности, если будут замещены на карбоксильном конце дипептида. Поэтому замена A 2 на пролин дала хорошие результаты. Они также отметили, что в соответствии со специфичностью фермента иминокислоты в положении рядом с карбоксильным концом не дадут сильнодействующего соединения. Замена групп R и A 1 гидрофобными и основными остатками даст сильнодействующее соединение. Замена –NH в общей структуре привела к потере активности, что соответствует потребности фермента в –NH в соответствующем положении на субстратах. Результатом стали 2 активных ингибитора: эналаприлат и лизиноприл . Оба эти соединения имеют фенилаланин в положении R, который занимает бороздку S 1 в ферменте. Результатом стали два новых, мощных аналога трипептида с координирующей цинк карбоксильной группой: эналаприлат и лизиноприл. [1] [9]
Обнаружение 2 активных участков: C-домен и N-домен
Большинство ингибиторов АПФ на рынке сегодня неселективны по отношению к двум активным участкам АПФ, поскольку их связывание с ферментом основано в основном на сильном фундаментальном взаимодействии между атомом цинка в ферменте и сильной хелатирующей группой на ингибиторе. Разрешение трехмерной структуры зародышевого АПФ, который имеет только один активный участок, соответствующий С-домену соматического АПФ , предлагает структурную основу для структурно-ориентированного подхода к дизайну. Хотя N- и С-домены имеют сопоставимые скорости гидролиза АПФ in vitro , похоже, что in vivo С-домен в основном отвечает за регуляцию артериального давления. Это указывает на то, что селективные ингибиторы С-домена могут иметь схожий профиль с профилем современных неселективных ингибиторов. Ангиотензин I в основном гидролизуется С-доменом in vivo , но брадикинин гидролизуется обоими активными участками. Таким образом, разработка селективного ингибитора C-домена позволит некоторую деградацию брадикинина N-доменом, и эта деградация может быть достаточной для предотвращения накопления избыточного брадикинина, которое наблюдается во время приступов ангионевротического отека . Селективное ингибирование C-домена может, возможно, привести к специализированному контролю артериального давления с меньшими побочными эффектами, связанными с вазодилататорами . С другой стороны, селективные ингибиторы N-домена дают возможность открыть новые терапевтические области. По-видимому, N-домен не играет большой роли в контроле артериального давления, но, по-видимому, является основным метаболизирующим ферментом для AcSDKP, естественного геморегуляторного гормона . [1] [10] [11]
Разработка лекарственных средств Кето-АПФ и его кетометиленовых производных
Было обнаружено, что другие карбонилсодержащие группы, такие как кетоны, могут заменять амидную связь, которая связывает Phe и Gly в ингибиторах АПФ. Кето-АПФ, впервые описанный в 1980 году, стал потенциальным ведущим соединением для ингибиторов АПФ, специфичных для C-домена. Кето-АПФ, трипептидный аналог Phe-Gly-Pro, содержит объемное бензильное кольцо P 1 и P 2 и, как было показано, ингибирует гидролиз ангиотензина I и брадикинина через C-домен. Синтез аналогов кето-АПФ с Trp или Phe в положении P 2 'привел к заметному увеличению селективности C-домена , но введение алифатической группы P 2 придало селективность N-домена. Ингибирующая активность может быть дополнительно усилена за счет включения гидрофобного заместителя, такого как фенильная группа в положении P 1 '. Заместители P 1 ' с S -стереохимией также, как было показано, обладают большей ингибирующей активностью, чем их R-аналоги. [2] [8] [12] [13]
Keto-ACE был использован в качестве основы для разработки производных кетометилена. Его аналоги содержат замену изостера кетометилена в разрывной связи , которая , как полагают, имитирует переходное состояние тетраэдра протеолитической реакции в активном центре. Основное внимание уделялось простому трипептиду Phe-Ala-Pro, который в более ранних ферментных анализах показал ингибирующую активность. Замена аланина на глицин дала трипептид с 1/14 ингибирующей активности Phe-Ala-Pro. Бензоилированное производное Phe-Gly-Pro, Bz-Phe-Gly-Pro, было в два раза активнее. Для снижения пептидной природы ингибиторов кетометилена заместитель P 1 'и P 2 'может быть циклизован с образованием лактама , где существует корреляция между ингибирующей активностью и размером кольца. В 2001 году было высказано предположение, что замена α на азот и создание 3-метилзамещенного аналога A58365A, пиридоновой кислоты, выделенной из ферментационного бульона бактерии Streptomyces chromofuscus с ингибирующей АПФ активностью, может влиять на уровень биологической активности посредством стерического или гидрофобного эффекта и/или предотвращения реакций в положении C3. Во время синтетической работы над A58365A также было замечено, что потенциальные предшественники чувствительны к окислению пятичленного кольца, и поэтому 3-метиловый аналог может быть более стабильным в этом отношении. [2] [14] [15]
Разработка лекарственного средства на основе силанедиола
Тот факт, что углерод и силикон имеют схожие, но также и различные характеристики, вызвал интерес к замене углерода на силандиол в качестве центральной группы, хелатирующей цинк. Силикон образует диалкилсиландиоловое соединение, которое достаточно затруднено, поэтому образование силоксанового полимера не происходит. Силандиолы более стабильны, чем углеродные диолы , поэтому ожидается, что они будут иметь более длительный период полураспада . Силандиолы также нейтральны при физиологическом pH (не ионизируются ). Четыре стереоизомера силандиола Phe-Ala были сравнены с ингибиторами на основе кетонов, и было обнаружено, что силандиол в четыре раза менее эффективен, чем аналог кетона. Это связано с тем, что силандиолы являются более слабыми хелаторами цинка по сравнению с кетонами. Замена силандиола на метилсилановую группу дала небольшое ингибирование фермента . Это подтверждает, что силандиоловая группа взаимодействует с АПФ как аналогом переходного состояния, и взаимодействие происходит аналогично взаимодействию кетона. [16] [17] Если бензильную группу силанедиола заменить на i- бутильную группу, то получится более слабый ингибитор АПФ. Введение гидрофобного метилфенила дает немного большую эффективность, чем аналог с трет-бутильной группой в P 1 . Это говорит о том, что метилфенил дает лучшее распознавание S1, чем трет-бутильная группа. [2]
Фосфиновые пептиды
Фосфиновые пептиды являются псевдопептидами, в которых связь фосфиновой кислоты (PO2 - CH-) заменила пептидную связь в последовательности пептидного аналога. В некоторой степени химическая структура фосфиновых пептидов похожа на структуру промежуточных продуктов , которые производятся при гидролизе пептидов протеолитическими ферментами. Была выдвинута гипотеза , что эти псевдопептиды имитируют структуру субстратов ферментов в их переходном состоянии, и кристаллография цинковых протеаз в комплексе с фосфиновыми пептидами подтверждает эту гипотезу. [10]
Разработка препарата RXP 407
RXP 407 является первым селективным фосфиновым пептидом N-домена и был обнаружен путем скрининга библиотек фосфиновых пептидов. До открытия RXP 407 долгое время утверждалось, что свободная карбоксилатная группа C-конца в положении P 2 ' необходима для эффективности ингибитора АПФ, поэтому можно предположить, что это отложило открытие селективных ингибиторов АПФ N-домена. Когда был открыт RXP 407, исследователи изучали фосфиновые пептиды с 3 различными общими формулами, каждая из которых содержала 2 неидентифицированные аминокислоты, только 1 из этих общих формул показала сильное ингибирование (Ac-Yaa-Pheψ(PO 2 -CH 2 )Ala-Yaa'-NH 2 ). Были сделаны пептидные смеси, заменяющие Yaa и Yaa' различными аминокислотами, в попытке установить, будет ли сильный ингибитор, который мог бы ингибировать либо N-домен, либо C-домен фермента. Результатом стало то, что соединение Ac- Asp (L) -Pheψ(PO 2 -CH 2 ) (L) Ala-Ala-NH 2 активно ингибировало N-домен и получило название RXP 407. Соотношение структура-функция показало, что карбоксамидная группа C-конца играет решающую роль в селективности для N-домена АПФ. Кроме того, N-ацетильная группа и аспарагиновая боковая цепь в положении P 2 способствуют селективности ингибитора в отношении N-домена. Эти особенности делают ингибитор недоступным для C-домена, но обеспечивают хорошую эффективность для N-домена, что приводит к разнице в ингибирующей активности активных участков на три порядка. Эти результаты также указывают на то, что N-домен обладает более широкой селективностью, чем C-домен. Еще одним различием между старыми ингибиторами АПФ и RXP 407 является молекулярный размер соединения. Старые ингибиторы АПФ в основном взаимодействовали с подсайтами S 1 ', S 2 ' и S 1 , но RXP 407 взаимодействует также с подсайтом S 2. Это также важно для селективности ингибитора, поскольку аспарагиновая боковая цепь и N-ацетильная группа расположены в положении P 2. [18]
Разработка препарата RXPA 380
RXPA380 был первым ингибитором, который был высокоселективен в отношении C-домена АПФ, его формула Phe-Phe-Pro-Trp. [1] Разработка этого соединения была основана на исследованиях, которые показали, что некоторые пептиды, усиливающие брадикинин, проявляют селективность в отношении C-домена, и все они имели несколько пролинов в своей структуре. Эти наблюдения привели исследователей к синтезу фосфиновых пептидов, содержащих остаток пролина в положении P 1 ', и оценка этих соединений привела к открытию RXPA380. [19] Для изучения роли остатков в RXPA380 исследователи создали 7 аналогов RXPA380. Все полученные соединения были получены в виде смеси 2 или 4 диастереоизомеров , но все они были легко разделены, и только один из них был эффективным. Это согласуется с первоначальными модельными исследованиями RXPA380, которые показали, что только один диастереомер может разместиться в активном центре зародышевого АПФ. Аналоги, в которых были заменены остатки псевдопролина или триптофана, показали меньшую селективность, чем RXPA380. Вероятно, это связано с тем, что эти два аналога обладают большей эффективностью по отношению к N-домену, чем RXPA380. Замена обоих этих остатков дает большую эффективность, но не селективность. Это показывает, что остатки псевдопролина и триптофана хорошо размещаются в C-домене, но не в N-домене. Еще два аналога с псевдопролином и триптофаном, но без остатка псевдофенилаланина в положении P 1, показали низкую эффективность для N-домена, подобно RXPA380. Это подтверждает значительную роль этих двух остатков в селективности для C-домена. Эти два аналога также имеют меньшую эффективность для C-домена, что показывает, что C-домен предпочитает псевдофенилаланиновую группу в положении P 1. Моделирование комплекса RXPA380-ACE показало, что псевдопролиновый остаток ингибитора был окружен аминокислотами, аналогичными аминокислотам N-домена, таким образом, взаимодействия с S 2 'доменом могут не отвечать за селективность RXPA380. Семь из 12 аминокислот, окружающих триптофан, одинаковы в C- и N-доменах, самое большое отличие заключается в том, что 2 объемные и гидрофобные аминокислоты в C-домене были заменены 2 меньшими и полярными аминокислотами в N-домене. Это указывает на то, что низкая эффективность RXPA380 для N-домена связана не с тем, что полость S 2 ' не вмещает боковую цепь триптофана, а скорее с тем, что отсутствуют важные взаимодействия между боковой цепью триптофана и аминокислотами C-домена. Учитывая близость боковой цепи триптофана и Asp 1029 , также возможно наличие водородной связи между карбоксилатом Asp 1029 и NH- индольным кольцом в C-домене, но это взаимодействие гораздо слабее в N-домене.[1]
Ссылки
- ^ abcde Ачарья, KR; Старрок, ED; Риодан, JK; Элерс, MR (2003), «Повторный взгляд на ACE: новая цель для проектирования выемок на основе структуры», Nature Reviews Drug Discovery , 2 (11): 891–902, doi :10.1038/nrd1227, PMC 7097707 , PMID 14668810
- ^ abcd Redelinghuys, P.; Nchinda, AT; Sturrock, ED (2005), «Разработка домен-селективных ингибиторов ферментов», Annals of the New York Academy of Sciences , 1056 : 160–175, doi : 10.1196/annals.1352.035, PMID 16387685, S2CID 25407204
- ^ abcdef Cushman, DW; Cheung, HS; Sabo, EF; Ondetti, MA (1977). «Разработка мощных конкурентных ингибиторов ангиотензинпревращающего фермента. Карбоксилканоил и меркаптоалканоил аминокислоты». Биохимия . 16 (25): 5484–5491. doi :10.1021/bi00644a014. PMID 200262.
- ^ Crantz, FR; Swartz, SL; Hollenberg, NK; Moore, TJ; Dluhy, RG; Williams, GH (1980), «Различия в реакции на ингибиторы пептидилдипептидгидролазы SQ 20,881 и SQ 14,225 при нормально-рениновой эссенциальной гипертонии», Hypertension , 2 (5): 604–609, doi : 10.1161/01.hyp.2.5.604 , PMID 6158478
- ^ abc Cushman, DW; Ondetti, MA (1991), «История разработки каптоприла и родственных ингибиторов ангиотензинпревращающего фермента», Hypertension , 17 (4): 589–592, doi : 10.1161/01.hyp.17.4.589 , PMID 2013486
- ^ Байерс, Л. Д.; Вольфенден, Р. (1973), «Связывание побочного продукта аналога бензилянтарной кислоты карбоксипептидазой А», Биохимия , 12 (11): 2070–2078, doi :10.1021/bi00735a008, PMID 4735879
- ^ ab Ондетти, MA; Рубин, B.; Кушман, DW (1977), «Разработка специфических ингибиторов ангиотензинпревращающего фермента: новый класс перорально активных антигипертензивных средств», Science , 196 (4288): 441–444, Bibcode : 1977Sci...196..441O, doi : 10.1126/science.191908, PMID 191908
- ^ ab Condon, ME; et al. (1982), «Ингибиторы ангиотензинпревращающего фермента: важность амидного карбонила меркаптоацильных аминокислот для водородной связи с ферментом», Журнал медицинской химии , 25 (3): 250–258, doi : 10.1021/jm00345a011, PMID 6279843
- ^ Патчетт, А.А. и др. (1980), «Новый класс ингибиторов ангиотензинпревращающего фермента», Nature , 288 (5788): 280–283, Bibcode : 1980Natur.288..280P, doi : 10.1038/288280a0, PMID 6253826, S2CID 4246377
- ^ ab Dive, V.; et al. (2004), «Обзор: фосфиновые пептиды как ингибиторы цинковой металлопротеиназы», Cellular and Molecular Life Sciences , 61 (16): 2010–2019, doi :10.1007/s00018-004-4050-y, PMC 11138626 , PMID 15316651, S2CID 30797568
- ^ Герогиадис, Д.; Гуниассе, П.; Коттон, Дж.; Йотакис, А.; Дайв, В. (2004), «Структурные детерминанты RXPA380, мощного и высокоселективного ингибитора C-домена ангиотензинпревращающего фермента», Биохимия , 43 (25): 8048–8054, doi :10.1021/bi049504q, PMID 15209500
- ^ Nchinda, AT; Chibale, K.; Redelinghuys, P.; Stirrock, ED (2006), «Синтез новых аналогов кето-АПФ как домен-селективных ингибиторов ангиотензин I-превращающего фермента», Bioorganic & Medicinal Chemistry Letters , 16 (17): 4612–4615, doi :10.1016/j.bmcl.2006.06.003, PMID 16784850
- ^ Redelinghuys, P.; Nchinda, AT; Chibale, K.; Sturrock, ED (2006), «Новые кетометиленовые ингибиторы ангиотензин I-превращающего фермента (АПФ): ингибирование и молекулярное моделирование», Biological Chemistry , 387 (4): 461–466, doi :10.1515/BC.2006.061, PMID 16606345, S2CID 30710745
- ^ Almquist, RG; Chao, WR; Ellis, ME; Johnson, HL (1980), «Синтез и биологическая активность кетометиленового аналога трипептидного ингибитора ангиотензинпревращающего фермента», Журнал медицинской химии , 23 (12): 1392–1398, doi :10.1021/jm00186a020, PMID 6256550
- ^ Клайв, DLJ; Янг, Х.; Леванчук, Э.З. (2001), «Синтез и активность in vitro неэпимеризуемого аналога ингибитора ангиотензинпревращающего фермента A58365A», Comptes Rendus de l'Académie des Sciences - Series IIC - Chemistry , 4 (6): 505–512, doi :10.1016/s1387-1609(01)01263-4
- ^ Ким, Дж.; Сибурт, СМ (2004), «Силандиоловые пептидомиметики. Оценка четырех диастереомерных ингибиторов АПФ», Bioorganic & Medicinal Chemistry Letters , 14 (11): 2853–2856, doi : 10.1016/j.bmcl.2004.03.042, PMID 15125946
- ^ Ким, Дж.; Хьюитт, Г.; Кэрролл, П.; Сибурт, С.М. (2005), «Силандиоловые ингибиторы ангиотензинпревращающего фермента. Синтез и оценка четырех диастереомеров аналогов дипептида Phe[Si]Ala», Журнал органической химии , 70 (15): 5781–5785, doi :10.1021/jo048121v, PMID 16018669
- ^ Dive, V.; et al. (1999), «RXP 407, фосфиновый пептид, является мощным ингибитором ангиотензин I-превращающего фермента, способного различать два его активных центра», PNAS , 96 (8): 4330–4335, Bibcode : 1999PNAS...96.4330D, doi : 10.1073/pnas.96.8.4330 , PMC 16332 , PMID 10200262
- ^ Георгиадис, Д.; Бо, Ф.; Чарни, Б.; Коттин, Дж.; Йотакис, А.; Дайв, В. (2003), «Роль двух активных участков соматического ангиотензинпревращающего фермента в расщеплении ангиотензина I и брадикинина: выводы из селективных ингибиторов», Circulation Research , 93 (2): 148–154, doi : 10.1161/01.RES.0000081593.33848.FC , PMID 12805239