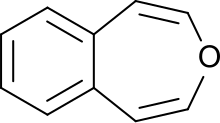
3-Бензоксепин
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 3-Беноксепин | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С10Н8О | |
| Молярная масса | 144,173 г·моль −1 |
| Появление | Желтое твердое вещество [1] |
| Температура плавления | 84 (83–84 °C; [3] 84 °C [1] ) |
| Растворимость | растворим в неполярных растворителях ( диэтиловый эфир , бензол , тетрахлорметан ) [2] и спиртах ( метанол ) [3] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
3-Бензоксепин представляет собой аннелированную кольцевую систему с ароматическим бензольным кольцом и неароматическим, ненасыщенным, кислородсодержащим семичленным гетероциклическим оксепином . Первый синтез был описан Карлом Димротом и его коллегами в 1961 году. [1] Это один из трех изомеров бензоксепинов .
Возникновение и синтез
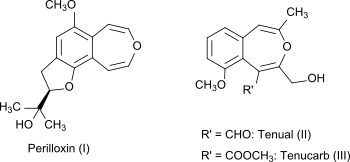
3-Бензоксепин сам по себе является неприродным соединением, но бициклическая кольцевая система является частью природных соединений периллоксина (I) из Perilla frutescens (вариант acuta ) [4] и тенуала (II) и тенукарба (III) из Asphodeline tenuior . [5] Периллоксин ингибирует фермент циклооксигеназу с IC50 23,2 мкМ. [4] Нестероидные противовоспалительные препараты, такие как аспирин и ибупрофен, также действуют путем ингибирования семейства ферментов циклооксигеназы . [6]
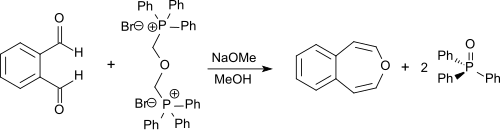
Незамещенный 3-бензоксепин может быть синтезирован посредством двойной реакции Виттига из o -фталевого альдегида с бис-(α,α′-трифенилфосфоний)-диметилэфир-дибромидом. [3] Последнее соединение может быть синтезировано из α,α′-дибромдиметилового эфира (бис(бромметил)эфира или BBME), который доступен из бромистоводородной кислоты , параформальдегида , [7] и трифенилфосфина . Реакция проводится в сухом метаноле с метилатом натрия, и продукт получается с выходом 55%. [1] [2]
Соединение также может быть получено путем УФ-облучения некоторых производных нафталина, таких как 1,4-эпокси-1,4-дигидронафталин. [8]
Его также можно получить путем фотоокисления 1,4-дигидронафталина с последующим пиролизом образовавшихся гидропероксидов . [9]
Последние синтезы дают 3-бензоксепины с низким выходом (4–6%). [8]
Характеристики
3-Бензоксепин — это ярко-желтое твердое вещество, которое кристаллизуется в пластинки, с запахом, похожим на запах нафталина . Материал растворим в неполярных органических растворителях. Как и нафталин, его можно очистить путем сублимации. Твердое вещество относительно устойчиво к кислотам, только при кипячении в концентрированных кислых спиртовых растворах образуется ненасыщенный альдегид (вероятно, инден -3-альдегид). Каталитическое гидрирование с палладиевым катализатором приводит к получению 1,2,4,5-тетрагидро-3-бензоксепина.
Ссылки
- ^ abcd Димрот, К.; Поль, Г. (1961). "3-Бензоксепин". Angew. Chem. 73 (12): 436. Bibcode :1961AngCh..73..436D. doi :10.1002/ange.19610731215.
- ^ ab Rosowsky, A., ed. (1972). "II. Oxepin Ring Systems Containing Two Rings". Семичленные гетероциклические соединения, содержащие кислород и серу . Химия гетероциклических соединений (на немецком языке). Т. 26-й. Нью-Йорк: Wiley-Interscience . стр. 96. ISBN 0-471-38210-8.
- ^ abc Димрот, К.; Пол, Г.; Фоллманн, Х. (1966). «Die Synthese von Derivaten des 3-Oxepins und des Furans durch eine zweifache Wittig-Reaktion». хим. Бер. (на немецком языке). 99 (2): 634–641 . doi : 10.1002/cber.19660990238.
- ^ ab Liu, J.-H.; Steigel, A.; Reininger, E.; Bauer, R. (2000). "Два новых пренилированных производных 3-бензоксепина как ингибиторы циклооксигеназы из Perilla frutescens var. acuta ". J. Nat. Prod. 63 (3): 403– 405. doi :10.1021/np990362o. PMID 10757731.
- ^ Ulubelen, A. ; Tuzlaci, E.; Atilan, N. (1989). «Производные оксепина и антрахиноны из Asphodeline tenuior и A. taurica ». Фитохимия . 28 (2): 649– 650. Bibcode : 1989PChem..28..649U. doi : 10.1016/0031-9422(89)80076-7.
- ^ Кестер, М.; Карпа, К.Д.; Врана, К.Е. (2011). «НПВП». Фармакология . Интегрированный обзор Elsevier. Elsevier Health Sciences . стр. 165–166 . ISBN 9780323074452.
- ↑ Патент США 20040242799, Grabarnick, M. & Sasson, Y., «Процесс бромметилирования ароматических соединений», опубликованный 2 декабря 2004 г., передан Grabarnick, M. и Sasson, Y.
- ^ ab Ziegler, GR (1969). "Механизмы фотохимических реакций в растворе. LVII. Фотоперегруппировка 1,4-эпокси-1,4-дигидронафталина в бенз[ f ]оксепин". J. Am. Chem. Soc. 91 (2): 446– 449. doi :10.1021/ja01030a040.
- ^ Джеффри, AM; Джерина, DM (1972). «Автоокисление 1,4-дигидронафталина. Образование 3-бензоксепина посредством пиролиза 2-гидроперокси-1,2-дигидронафталина». J. Am. Chem. Soc. 94 (11): 4048– 4049. doi :10.1021/ja00766a084.