Хлорид иттрия(III)
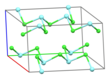
 Часть слоя в кристаллической структуре YCl 3 [1] | |||
| |||
| Имена | |||
|---|---|---|---|
| Имена ИЮПАК Хлорид иттрия (III) Трихлорид иттрия | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.030.716 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| YCl3 | |||
| Молярная масса | 195,265 г/моль [2] | ||
| Появление | белое твердое вещество | ||
| Плотность | 2,61 г/см 3 [2] | ||
| Температура плавления | 721 °C (1330 °F; 994 K) [2] | ||
| Точка кипения | 1482 °C (2700 °F; 1755 K) [2] | ||
| 751 г/л (20 °C) [2] | |||
| Растворимость | 601 г/л этанола (15 °C) 606 г/л пиридина (15 °C) [3] | ||
| Структура [4] | |||
| Моноклинный , mS16 | |||
| С2/м, № 12 | |||
а = 0,692 нм, б = 1,194 нм, с = 0,644 нм α = 90°, β = 111°, γ = 90° | |||
Формульные единицы ( Z ) | 4 | ||
| Опасности | |||
| Маркировка СГС : | |||
 | |||
| Предупреждение | |||
| Н315 , Н319 , Н335 | |||
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P332+P313 , P337+P313 , P362 | |||
| NFPA 704 (огненный алмаз) | |||
| Паспорт безопасности (SDS) | Внешний ПБС | ||
| Родственные соединения | |||
Другие анионы | Иттрия(III) фторид Иттрия(III) бромид Иттрия(III) иодид | ||
Другие катионы | Хлорид скандия(III) Хлорид лютеция(III) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Хлорид иттрия(III) — неорганическое соединение иттрия и хлорида . Существует в двух формах: гидрат (YCl 3 (H 2 O) 6 ) и безводная форма (YCl 3 ). Обе — бесцветные соли, хорошо растворимые в воде и расплывающиеся .
Структура
Твердый YCl 3 имеет кубическую [ требуется ссылка ] структуру с плотно упакованными ионами хлора и ионами иттрия, заполняющими одну треть октаэдрических пустот, и полученные октаэдры YCl 6 имеют три общих ребра с соседними октаэдрами, что придает ему слоистую структуру. [5] [1] Эта структура характерна для ряда соединений, в частности AlCl 3 .
Приготовление и реакции
YCl 3 часто получают «путем хлорида аммония », исходя либо из Y 2 O 3 , либо из гидратированного хлорида или оксихлорида. [6] [7] или YCl 3 ·6H 2 O. [8] Эти методы производят (NH 4 ) 2 [YCl 5 ]:
- 10NH4Cl + Y2O3 → 2 ( NH4 ) 2 [ YCl5 ] + 6NH3 + 3H2O
- YCl3 · 6H2O + 2NH4Cl → ( NH4 ) 2 [ YCl5 ] + 6H2O
Пентахлорид разлагается термически по следующему уравнению:
- (NH4 ) 2 [ YCl5 ] → 2NH4Cl + YCl3
Реакция термолиза протекает через посредничество (NH 4 )[Y 2 Cl 7 ].
Обработка Y 2 O 3 водным раствором HCl приводит к образованию гидратированного хлорида (YCl 3 ·6H 2 O). При нагревании эта соль дает оксихлорид иттрия , а не возвращается в безводную форму.
Ссылки
- ^ ab Templeton, DH; Carter, Giles F. (1954). «Кристаллические структуры трихлорида иттрия и подобных соединений». J. Phys. Chem. 58 (11): 940– 944. doi :10.1021/j150521a002.
- ^ abcde Haynes, William M., ред. (2011). CRC Handbook of Chemistry and Physics (92-е изд.). CRC Press . стр. 4.99. ISBN 978-1439855119.
- ^ Спенсер, Джеймс Ф. (1919), Металлы редкоземельных металлов, Нью-Йорк: Longmans, Green, and Co, стр. 135
- ^ Templeton, DH; Carter, Giles F. (1954). «Кристаллические структуры трихлорида иттрия и подобных соединений». Журнал физической химии . 58 (11): 940–944 . doi :10.1021/j150521a002.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Мейер, Г. (1989). "Путь хлорида аммония к безводным хлоридам редкоземельных элементов — пример Ycl 3 ". Путь хлорида аммония к безводным хлоридам редкоземельных элементов — пример YCl 3 . Неорганические синтезы. Т. 25. С. 146–150 . doi :10.1002/9780470132562.ch35. ISBN 978-0-470-13256-2.
- ^ Edelmann, FT; Poremba, P. (1997). Herrmann, WA (ред.). Синтетические методы металлоорганической и неорганической химии . Т. VI. Штутгарт: Georg Thieme Verlag. ISBN 978-3-13-103021-4.
- ^ Тейлор, МД; Картер, К.П. (1962). «Получение безводных галогенидов лантаноидов, особенно иодидов». Журнал неорганической и ядерной химии . 24 (4): 387– 391. doi :10.1016/0022-1902(62)80034-7.