Ремоделирование желудочков
В кардиологии ремоделирование желудочков ( или сердечное ремоделирование ) [1] относится к изменениям размера, формы, структуры и функции сердца . Это может произойти в результате физических упражнений (физиологическое ремоделирование) или после повреждения сердечной мышцы (патологическое ремоделирование). [2] Повреждение обычно происходит из-за острого инфаркта миокарда (обычно трансмурального или инфаркта с подъемом сегмента ST), но может быть вызвано рядом причин, которые приводят к повышению давления или объема , вызывая перегрузку давлением или объемом (формы деформации) на сердце. Хроническая гипертония , врожденный порок сердца с внутрисердечным шунтированием и клапанный порок сердца также могут приводить к ремоделированию. После того, как происходит инсульт , в миокарде левого желудочка происходит ряд гистопатологических и структурных изменений, которые приводят к прогрессирующему снижению производительности левого желудочка. В конечном итоге ремоделирование желудочков может привести к снижению сократительной ( систолической ) функции и уменьшению ударного объема .
Физиологическое ремоделирование обратимо, тогда как патологическое ремоделирование в основном необратимо. Ремоделирование желудочков под давлением слева/справа делает несоответствия неизбежными. Патологические несоответствия давления между легочным и системным кровообращением направляют компенсаторное ремоделирование левого и правого желудочков. Термин «обратное ремоделирование» в кардиологии подразумевает улучшение механики и функции желудочков после отдаленной травмы или патологического процесса. [3] [4] [5]
Ремоделирование желудочков может включать в себя гипертрофию желудочков , дилатацию желудочков , кардиомегалию и другие изменения. Это аспект кардиомиопатии , которая имеет много типов. Концентрическая гипертрофия возникает из-за перегрузки давлением , в то время как эксцентрическая гипертрофия возникает из-за перегрузки объемом . [6]
Патофизиология
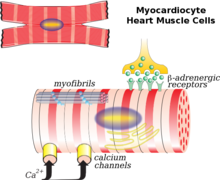
Сердечный миоцит является основной клеткой, участвующей в ремоделировании. Фибробласты , коллаген , интерстиций и коронарные сосуды в меньшей степени также играют свою роль. Обычный сценарий ремоделирования — после инфаркта миокарда. Происходит некроз миокарда (гибель клеток) и непропорциональное истончение сердца. Эта тонкая, ослабленная область неспособна выдерживать давление и объемную нагрузку на сердце так же, как и другие здоровые ткани. В результате происходит расширение камеры, возникающее из области инфаркта. Начальная фаза ремоделирования после инфаркта миокарда приводит к восстановлению некротической области и рубцеванию миокарда , что в некоторой степени можно считать полезным, поскольку происходит улучшение или поддержание функции ЛЖ и сердечного выброса . Однако со временем, по мере того как сердце подвергается постоянному ремоделированию, оно становится менее эллиптическим и более сферическим. Масса и объем желудочка увеличиваются, что в совокупности отрицательно влияет на сердечную функцию. В конце концов, диастолическая функция или способность сердца расслабляться между сокращениями может нарушиться, что приведет к дальнейшему ухудшению. [7]
После инфаркта миокарда (ИМ) смерть сердечных миоцитов может быть вызвана некрозом , апоптозом или аутофагией , что приводит к истончению стенки сердца. [8] Выжившие сердечные миоциты располагаются либо параллельно, либо последовательно друг к другу, способствуя расширению желудочков или их гипертрофии в зависимости от нагрузки на стенку желудочка. [7] Кроме того, считается , что снижение экспрессии миозина V1 и кальциевых каналов L-типа на сердечных миоцитах также вызывает ремоделирование сердца. В нормальных условиях организма жирные кислоты обеспечивают от 60 до 90% энергоснабжения сердца. После ИМ, поскольку окисление жирных кислот уменьшается, это приводит к снижению энергоснабжения сердечных миоцитов, накоплению жирных кислот до токсичных уровней и дисфункции митохондрий . Эти последствия также привели к увеличению оксидативного стресса на сердце, вызывая пролиферацию фибробластов , активацию металлопротеиназ и индукцию апоптоза, что будет объяснено ниже. Кроме того, воспалительный иммунный ответ после инфаркта миокарда также способствует вышеуказанным изменениям. [8]
Кроме того, сердечный интерстиций, который в основном состоит из коллагеновых волокон типа I и типа III, также участвует в сердечном ремоделировании. Сердечный коллаген синтезируется фибробластами и разрушается металлопротеиназами. [7] Фибробласты активируются после инфаркта миокарда, что приводит к увеличению синтеза коллагена и фиброзу сердца. [8] Увеличение экспрессии MMP1 и MMP9 приводит к деградации коллагеновых волокон и последующей дилатации сердца. [7] Известно, что несколько сигнальных путей, таких как ангиотензин II , трансформирующий фактор роста бета (TGF-бета) и эндотелин 1 , запускают синтез и деградацию коллагеновых волокон в сердце. [8]
Другие факторы, такие как высокое кровяное давление, активация симпатической системы, которая высвобождает норадреналин , активация ренин-ангиотензиновой системы , которая высвобождает ренин и антидиуретические гормоны, являются важными факторами сердечного ремоделирования. Однако предсердный натрийуретический пептид считается кардиопротекторным. [7]
Оценка
Ремоделирование сердца оценивается путем проведения эхокардиограммы . Размер и функция предсердий и желудочков могут быть охарактеризованы с помощью этого теста. [ необходима цитата ]
Уход
На время и степень ремоделирования влияют многие факторы, включая тяжесть травмы, вторичные события (рецидивирующая ишемия или инфаркт), нейрогормональную активацию, генетические факторы и экспрессию генов , а также лечение. Лекарства могут ослаблять ремоделирование. Ингибиторы ангиотензинпревращающего фермента (АПФ) последовательно демонстрируют снижение ремоделирования в моделях животных или трансмурального инфаркта и хронической перегрузки давлением. Клинические испытания показали, что терапия ингибиторами АПФ после инфаркта миокарда приводит к улучшению работы миокарда, улучшению фракции выброса и снижению смертности по сравнению с пациентами, получавшими плацебо. Аналогичным образом, ингибирование альдостерона , напрямую или косвенно, приводит к улучшению ремоделирования. [9] Карведилол , бета-блокатор 3-го поколения , может фактически обратить вспять процесс ремоделирования за счет уменьшения объемов левого желудочка и улучшения систолической функции. [10] [11] Сердечная ресинхронизирующая терапия (CRT) продемонстрировала способность обращать вспять ремоделирование левого желудочка у некоторых пациентов. [12] [13] Ранняя коррекция врожденных пороков сердца, если это уместно, может предотвратить ремоделирование, как и лечение хронической гипертонии или клапанного порока сердца . Часто также наблюдается обратное ремоделирование или улучшение функции левого желудочка. [ необходима цитата ]
Смотрите также
Ссылки
- ^ Mihl, C.; Dassen, WRM; Kuipers, H. (2008). «Ремоделирование сердца: концентрическая и эксцентрическая гипертрофия у спортсменов, занимающихся силовыми видами спорта и видами спорта на выносливость». Netherlands Heart Journal . 16 (4): 129–33 . doi :10.1007/BF03086131. PMC 2300466. PMID 18427637 .
- ^ Желудочковая ремоделирование в Национальной медицинской библиотеке США Медицинские предметные рубрики (MeSH)
- ^ Yu, Cheuk-Man; Bleeker, Gabe B.; Fung, Jeffrey Wing-Hong; Schalij, Martin J.; Zhang, Qing; Wall, Ernst E. van der; Chan, Yat-Sun; Kong, Shun-Ling; Bax, Jeroen J. (13.09.2005). «Обратное ремоделирование левого желудочка, но не клиническое улучшение, предсказывает долгосрочную выживаемость после кардиоресинхронизирующей терапии». Circulation . 112 (11): 1580– 86. doi : 10.1161/circulationaha.105.538272 . ISSN 0009-7322. PMID 16144994.
- ^ Ypenburg, Claudia; Bommel, Rutger J. van; Borleffs, C. Jan Willem; Bleeker, Gabe B.; Boersma, Eric; Schalij, Martin J.; Bax, Jeroen J. (2009). «Долгосрочный прогноз после сердечной ресинхронизирующей терапии связан со степенью обратного ремоделирования левого желудочка при среднесрочном наблюдении». Журнал Американского колледжа кардиологии . 53 (6): 483– 90. doi : 10.1016/j.jacc.2008.10.032 . PMID 19195605.
- ^ Saavedra, W.Federico; Tunin, Richard S; Paolocci, Nazareno; Mishima, Takayuki; Suzuki, George; Emala, Charles W; Chaudhry, Pervaiz A; Anagnostopoulos, Petros; Gupta, Ramesh C (2002). "Обратное ремоделирование и усиление адренергического резерва от пассивной внешней поддержки при экспериментальной дилатационной сердечной недостаточности". Журнал Американского колледжа кардиологии . 39 (12): 2069–76 . doi : 10.1016/s0735-1097(02)01890-9 . PMID 12084610.
- ^ Katz, Daniel H.; Beussink, Lauren; Sauer, Andrew J.; Freed, Benjamin H.; Burke, Michael A.; Shah, Sanjiv J. (2013). «Распространенность, клинические характеристики и исходы, связанные с эксцентрической и концентрической гипертрофией левого желудочка при сердечной недостаточности с сохраненной фракцией выброса». Американский журнал кардиологии . 112 (8): 1158– 64. doi : 10.1016/j.amjcard.2013.05.061. PMC 3788852. PMID 23810323 .
- ^ abcde Cohn, Jay N; Colucci, Wilson S; Yeon, Susan B. "Ремоделирование сердца: основные аспекты" . UpToDate.com . Получено 8 ноября 2017 г. .
- ^ abcd Азеведо, Паула С; Полегато, Берта Ф; Миникуччи, Маркос Ф. (январь 2016 г.). «Ремоделирование сердца: концепции, клиническое воздействие, патофизиологические механизмы и фармакологическое лечение». Arquivos Brasileiros de Cardiologia . 106 (1): 62–69 . doi :10.5935/abc.20160005. ПМЦ 4728597 . ПМИД 26647721.
- ^ Питт, Бертрам; Ремме, Виллем; Заннад, Файез; Нитон, Джеймс; Мартинес, Фелипе; Роникер, Барбара; Биттман, Ричард; Херли, Стив; Клейман, Джей; Гатлин, Марджори (2003). «Эплеренон, селективный блокатор альдостерона, у пациентов с дисфункцией левого желудочка после инфаркта миокарда». New England Journal of Medicine . 348 (14): 1309–21 . doi : 10.1056/NEJMoa030207 . PMID 12668699.
- ^ Khattar, RS (2003). «Влияние ингибиторов АПФ и бета-блокаторов на ремоделирование левого желудочка при хронической сердечной недостаточности». Minerva Cardioangiologica . 51 (2): 143–54 . PMID 12783070.
- ^ Рейс Фильо-младший, Кардозу-младший, Кардосо CM, Перейра-Барретто AC (2015). «Обратное ремоделирование сердца: маркер лучшего прогноза при сердечной недостаточности». Arquivos Brasileiros de Cardiologia . 104 (6): 502–06 . doi :10.5935/abc.20150025. ПМЦ 4484683 . ПМИД 26131706.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Лейва, Франциско; Нисам, Сиа; Ауриккио, Анджело (2014). «20 лет кардиоресинхронизирующей терапии». Журнал Американского колледжа кардиологии . 64 (10). Elsevier BV: 1047– 1058. doi : 10.1016/j.jacc.2014.06.1178 . ISSN 0735-1097. PMID 25190241.
- ^ St John Sutton, Martin G.; Plappert, Ted; Hilpisch, Kathryn E.; Abraham, William T.; Hayes, David L.; Chinchoy, Edward (17.01.2006). «Устойчивое обратное структурное ремоделирование левого желудочка с сердечной ресинхронизацией в течение одного года является функцией этиологии». Circulation . 113 (2). Ovid Technologies (Wolters Kluwer Health): 266– 272. doi : 10.1161/circulationaha.104.520817 . ISSN 0009-7322. PMID 16401777.
Дальнейшее чтение
- «Ремоделирование левого желудочка при сердечной недостаточности: современные концепции клинического значения и оценки». imaging.onlinejacc.org . Получено 12.02.2016 .
