Стрептокиназа
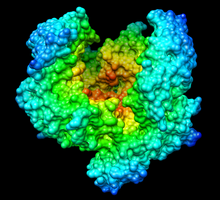 Комплекс каталитического домена человеческого плазмина и стрептокиназы | |
| Клинические данные | |
|---|---|
| Другие имена | СК |
| AHFS / Drugs.com | Подробная информация для потребителей Micromedex |
| Пути введения | Внутривенно |
| код АТС |
|
| Идентификаторы | |
| Номер CAS |
|
| DrugBank |
|
| ChemSpider |
|
| УНИИ |
|
| Информационная карта ECHA | 100.029.667 |
| Химические и физические данные | |
| Формула | С 2100 Н 3278 С 566 О 669 Ю 4 |
| Молярная масса | 47 286 .86 г·моль −1 |
Стрептокиназа — тромболитическое лекарство, активирующее плазминоген неферментативным механизмом. [1] В качестве лекарства оно используется для разрушения тромбов в некоторых случаях инфаркта миокарда (сердечного приступа), тромбоэмболии легочной артерии и артериальной тромбоэмболии . [2] Тип сердечного приступа, при котором оно используется, — инфаркт миокарда с подъемом сегмента ST (ИМСПST). [3] Оно вводится путем инъекции в вену . [2]
Побочные эффекты включают тошноту, кровотечение, низкое кровяное давление и аллергические реакции . [2] Повторное использование в течение жизни человека не рекомендуется. [2] Хотя не было обнаружено никакого вреда при использовании во время беременности , оно не было хорошо изучено в этой группе. [4] Стрептокиназа относится к антитромботическому семейству препаратов и действует путем включения фибринолитической системы . [3]
Стрептокиназа была открыта в 1933 году из бета-гемолитических стрептококков . [5] Она включена в Список основных лекарственных средств Всемирной организации здравоохранения . [6] Она больше не продается в Соединенных Штатах. [7]
Медицинское применение
Если чрескожное коронарное вмешательство (ЧКВ) недоступно в течение 90–120 минут после первого контакта, рекомендуется внутривенное введение стрептокиназы как можно скорее после начала инфаркта миокарда с подъемом сегмента ST (ИМСПST). Поскольку стрептокиназа является бактериальным продуктом, организм обладает способностью вырабатывать к ней иммунитет. Поэтому рекомендуется не использовать этот препарат повторно по истечении четырех дней с момента первого приема, так как он может оказаться не столь эффективным и также может вызвать аллергическую реакцию . По этой причине его обычно назначают только при первом сердечном приступе у человека. Дальнейшие тромботические события можно лечить с помощью тканевого активатора плазминогена (tPA) . Передозировку стрептокиназы или tPA можно лечить с помощью аминокапроновой кислоты .
Противопоказания
Абсолютный
- Любое предшествующее внутричерепное кровоизлияние
- Известное структурное поражение сосудов головного мозга (например, артериовенозная мальформация )
- Известный рак внутри черепа (первичный или метастатический)
- Ишемический инсульт более 4,5 часов и менее 3 месяцев назад
- Подозрение на расслоение аорты
- Активное кровотечение или проблемы с кровотечением, не связанные с менструацией
- Значительная закрытая травма головы или лица в течение 3 месяцев
- Внутричерепная или интраспинальная хирургия в течение 2 месяцев
- Тяжелая неконтролируемая гипертония (не поддающаяся экстренной терапии)
- Для стрептокиназы предыдущее лечение в течение предыдущих 6 месяцев
Родственник
- История хронической, тяжелой, плохо контролируемой гипертонии
- Значительная гипертензия при поступлении (САД >180 мм рт. ст. или ДАД >110 мм рт. ст.)
- История предшествующего ишемического инсульта более 3 месяцев назад
- Деменция
- Известная внутричерепная патология, не входящая в абсолютные противопоказания
- Травматическая или длительная (>10 мин) СЛР
- Крупная операция менее трех недель назад
- Недавнее (в течение 2–4 недель) внутреннее кровотечение
- Некомпрессионные сосудистые пункции
- Активная язвенная болезнь
- Пероральная антикоагулянтная терапия
[8]
Механизм действия
| Стрептокиназа С | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | скц | ||||||
| Энтрез | 8110746 | ||||||
| ПДБ | 1БМЛ | ||||||
| UniProt | P00779 | ||||||
| |||||||
| Семейство стафилокиназы/стрептокиназы | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Структура стафилокиназы, активатора плазминогена. [9] | |||||||||||
| Идентификаторы | |||||||||||
| Символ | Стафилокиназа | ||||||||||
| Пфам | ПФ02821 | ||||||||||
| ИнтерПро | IPR004093 | ||||||||||
| СКОП2 | 2sak / SCOPe / SUPFAM | ||||||||||
| |||||||||||

Стрептокиназа принадлежит к группе лекарств, известных как фибринолитики , и комплексы стрептокиназы с человеческим плазминогеном могут гидролитически активировать другой несвязанный плазминоген, активируя через расщепление связи для получения плазмина . Существует три домена стрептокиназы, обозначенные α (остатки 1–150), β (остатки 151–287) и γ (остатки 288–414). Каждый домен связывает плазминоген, хотя ни один из них не может активировать плазминоген независимо. [10]
Плазмин вырабатывается в крови для расщепления фибрина , основного компонента тромбов , тем самым растворяя сгустки после того, как они выполнили свою задачу остановки кровотечения. Дополнительное производство плазмина, вызванное стрептокиназой, разрушает нежелательные сгустки крови, например, в легких (легочная эмболия). Обычная активация плазминогена происходит путем протеолиза связи Arg561—Val562. [11] Затем аминогруппа Val562 образует солевой мостик с Asp740, что запускает конформационное изменение, производящее активную протеазу плазмин. Когда присутствует стрептокиназа, она связывается с плазминогеном, образуя комплекс (стрептокиназа·плазминоген), который преобразует субстрат плазминогена в плазмин. Остатки 1–59 стрептокиназы регулируют ее способность индуцировать активный сайт в связанном плазминогене непротеолитическим механизмом и активировать субстратный плазминоген фибрин-независимым образом. Этот комплекс впоследствии перестраивается в активный комплекс, хотя связь Arg561–Val562 остается нетронутой. Следовательно, другой остаток должен заменить свободную аминогруппу Val562 и обеспечить противоион для Asp740 в этом активном комплексе. [12] Было предложено два кандидата на этот противоион: Ile1 стрептокиназы и Lys698 плазминогена. Удаление Ile1 стрептокиназы заметно подавляет ее способность индуцировать активный сайт в плазминогене, что подтверждает гипотезу о том, что установление солевого мостика между Ile1 стрептокиназы и Asp740 плазминогена необходимо для того, чтобы стрептокиназа индуцировала активный сайт в плазминогене непротеолитическим механизмом. [13] В отличие от замен Ile1, мутации Lys698 также уменьшили константу диссоциации комплекса стрептокиназы в 15-50 раз. Эти наблюдения предполагают, что Lys698 участвует в формировании начального комплекса стрептокиназы·плазминогена. [14]
Биология
Стрептокиназа естественным образом вырабатывается бактериями Streptococci spp., которые используют этот фермент для разрушения тромбов, чтобы они могли распространяться от первоначального места инфекции. Он также может активировать фибрин . [15]
Он похож, как по функции, так и по структуре, на стафилокиназу (Sak), обнаруженную в Staphylococcus aureus . Стафилокиназа считается фактором вирулентности, [16] хотя ее присутствие после установления инфекции фактически снижает тяжесть заболевания. Оба фермента переносятся фагами. [17]
История
После многих лет работы вместе со своим учеником Солом Шерри, Уильям С. Тиллетт открыл стрептокиназу в 1933 году. Первоначально ее использовали для лечения фибринозных плевральных экссудатов, гемоторакса и туберкулезного менингита, но ее роль при остром инфаркте миокарда была счастливой случайностью. [5]
Исследовать
Стрептокиназа может найти применение в профилактике послеоперационных спаек — распространенного осложнения хирургических вмешательств, особенно абдоминальных ( аппендэктомия , желчнокаменная болезнь , гистерэктомия и т. д.). В одном исследовании с использованием животных моделей (крыс) было обнаружено, что при использовании с мембранной системой доставки лекарств PHBV она на 90 процентов эффективна в профилактике спаек. [18] Однако в ходе клинических испытаний ее эффективность на людях не была доказана.
Маркетинг
В Чили препарат продается под названием Streptase компанией Alpes Selection по лицензии CSL Behring Germany.
Доступно во Вьетнаме под названием Mutose. Доступно на Кубе, в Венесуэле, Эквадоре и других странах Латинской Америки под торговой маркой Heberkinasa, продаваемой Heber Biotech, Гавана , Куба . Доступно в Индии под названием STPase компанией Cadila Pharmaceuticals и Myokinase компанией Biocon Limited .
Ссылки
- ^ Mican J, Toul M, Bednar D, Damborsky J (2019). «Структурная биология и белковая инженерия тромболитиков». Computational and Structural Biotechnology Journal . 17 : 917–938 . doi : 10.1016/j.csbj.2019.06.023 . PMC 6637190. PMID 31360331 .
- ^ abcd Всемирная организация здравоохранения (2009). Stuart MC, Kouimtzi M, Hill SR (ред.). WHO Model Formulary 2008. Всемирная организация здравоохранения. стр. 291–2 . hdl : 10665/44053 . ISBN 9789241547659.
- ^ ab "Streptokinase 1,500,000 iu - Summary of Product Characteristics (SPC) - (eMC)". www.medicines.org.uk . 1 июля 2015 г. Архивировано из оригинала 20 декабря 2016 г. Получено 14 декабря 2016 г.
- ^ "Использование стрептокиназы во время беременности | Drugs.com". www.drugs.com . Архивировано из оригинала 21 декабря 2016 года . Получено 14 декабря 2016 года .
- ^ ab Sikri N, Bardia A (2007). «История использования стрептокиназы при остром инфаркте миокарда». Texas Heart Institute Journal . 34 (3): 318–327 . PMC 1995058. PMID 17948083 .
- ^ Всемирная организация здравоохранения (2019). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г. Женева: Всемирная организация здравоохранения. hdl : 10665/325771 . WHO/MVP/EMP/IAU/2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ "стрептокиназа (внутривенный путь, внутрикоронарный путь)". Truven Health Analytics. Архивировано из оригинала 8 декабря 2015 г. Получено 28 ноября 2015 г.
- ^ O'Gara PT, Kushner FG, Ascheim DD, Casey DE, Chung MK, de Lemos JA и др. (январь 2013 г.). "Руководство ACCF/AHA 2013 г. по лечению инфаркта миокарда с подъемом сегмента ST: отчет целевой группы Американского колледжа кардиологии/Американской кардиологической ассоциации по практическим рекомендациям". Циркуляция . 127 (4): e362 – e425 . doi : 10.1161/CIR.0b013e3182742cf6 . PMID 23247304.
- ^ Rabijns A, De Bondt HL, De Ranter C (май 1997). «Трехмерная структура стафилокиназы, активатора плазминогена с терапевтическим потенциалом». Nature Structural Biology . 4 (5): 357– 360. doi :10.1038/nsb0597-357. PMID 9145104. S2CID 32914387.
- ^ Mundada LV, Prorok M, DeFord ME, Figuera M, Castellino FJ, Fay WP (июль 2003 г.). «Структурно-функциональный анализ аминоконца стрептокиназы (остатки 1-59)». Журнал биологической химии . 278 (27): 24421– 24427. doi : 10.1074/jbc.M301825200 . PMID 12704199.
- ^ Young KC, Shi GY, Wu DH, Chang LC, Chang BI, Ou CP, Wu HL (январь 1998). «Активация плазминогена стрептокиназой через уникальный механизм». Журнал биологической химии . 273 (5): 3110– 3116. doi : 10.1074/jbc.273.5.3110 . PMID 9446629.
- ^ Loy JA, Lin X, Schenone M, Castellino FJ, Zhang XC, Tang J (декабрь 2001 г.). «Взаимодействие доменов между стрептокиназой и плазминогеном человека». Биохимия . 40 (48): 14686– 14695. doi :10.1021/bi011309d. PMID 11724583.
- ^ Wang S, Reed GL, Hedstrom L (апрель 1999). «Удаление Ile1 изменяет механизм стрептокиназы: доказательства гипотезы молекулярной сексуальности». Биохимия . 38 (16): 5232– 5240. doi :10.1021/bi981915h. PMID 10213631.
- ^ Wang X, Lin X, Loy JA, Tang J, Zhang XC (сентябрь 1998 г.). «Кристаллическая структура каталитического домена человеческого плазмина в комплексе со стрептокиназой». Science . 281 (5383): 1662– 1665. doi :10.1126/science.281.5383.1662. PMID 9733510.
- ^ Wang H, Lottenberg R, Boyle MD (март 1995). «Анализ взаимодействия стрептококков группы А с фибриногеном, стрептокиназой и плазминогеном». Microbial Pathogenesis . 18 (3): 153– 166. doi :10.1016/S0882-4010(95)90013-6. PMID 7565010.
- ^ Бокарева М.И., Джин Т., Тарковски А. (2006). «Золотой стафилококк: Стафилокиназа». Международный журнал биохимии и клеточной биологии . 38 (4): 504–509 . doi :10.1016/j.biocel.2005.07.005. ПМИД 16111912.
- ^ Квечинский Дж., Якобссон Г., Карлссон М., Чжу X, Ван В., Бремелл Т. и др. (сентябрь 2013 г.). «Стафилокиназа способствует развитию кожных инфекций Staphylococcus aureus, одновременно уменьшая тяжесть заболевания». Журнал инфекционных болезней . 208 (6): 990–999 . doi : 10.1093/infdis/jit288 . ПМИД 23801604.
- ^ Ягмурлу А., Барлас М., Гурсель И., Гоккора И. Х. (2003). «Уменьшение перитонеальных спаек, вызванных хирургическим вмешательством, путем непрерывного высвобождения стрептокиназы из системы доставки лекарств». European Surgical Research . 35 (1): 46– 49. doi :10.1159/000067035. PMID 12566787. S2CID 37453555.
Внешние ссылки
- «Стрептокиназа». Портал информации о лекарственных средствах . Национальная медицинская библиотека США.

