Пентафторид ванадия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Фторид ванадия(V) | |
| Другие имена Пентафторид ванадия | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Информационная карта ECHA | 100.029.112 |
| Номер ЕС |
|
CID PubChem |
|
| УНИИ | |
| |
| |
| Характеристики | |
| ВФ 5 | |
| Молярная масса | 145.934 |
| Появление | бесцветное твердое вещество |
| Плотность | 2,502 г/см 3 (твердый) |
| Температура плавления | 19,5 °C (67,1 °F; 292,6 К) |
| Точка кипения | 48,3 °C (118,9 °F; 321,4 К) |
| Родственные соединения | |
Другие катионы | Фторид ниобия(V) Фторид тантала(V) |
Родственные соединения ванадия | Оксид ванадия(V) Трифторид ванадия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фторид ванадия(V) — неорганическое соединение с химической формулой VF 5 . Это бесцветная летучая жидкость [1], которая замерзает при температуре, близкой к комнатной. Это высокореакционноспособное соединение, на что указывает его способность фторировать органические вещества. [2]
Свойства и структура
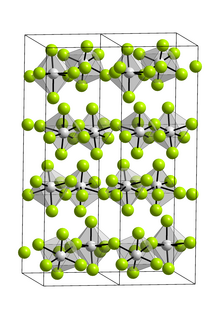
Соединение является исключительно мономером в газовой фазе. [3] В газовой фазе оно принимает симметричную тригонально-бипирамидальную геометрию D 3h , как показано с помощью электронной дифракции . [4] В твердом состоянии VF 5 образует полимерную структуру с октаэдрическими ванадиевыми центрами, связанными фторидными мостиками. [3] [5]
Энтальпия образования VF 5 составляет -1429,4 ± 0,8 кДж/моль. [6]
Это единственный известный пентагалогенид ванадия.
Синтез
Пентафторид ванадия можно получить фторированием металлического ванадия: [7] [1]
- 2 В + 5 Ф 2 → 2 ВФ 5
Альтернативно, диспропорционирование тетрафторида ванадия дает равные количества твердого трифторида и летучего пентафторида: [8] [9] [1]
- 2 ВФ 4 → ВФ 3 + ВФ 5
Это преобразование проводится при температуре 650 °C. Его также можно синтезировать, используя элементарный фтор для фторирования промышленных концентратов и сырья, чтобы производить VF 5 в промышленных масштабах. VF 5 можно синтезировать из реакции сырья, такого как металлический ванадий , феррованадий , оксид ванадия (V) и тетрафторид ванадия , с элементарным фтором . [10]
VF 5 ионизируется в жидком состоянии, что отражается в высоких значениях постоянной Траутона и электропроводности . [ 11]
Характеристики и реакционная способность
Интерес к этому высококоррозионному соединению возник в пятидесятые годы, когда проводились обширные исследования его физико-химических свойств. [10] Это мощный фторирующий и окислительный агент. Он окисляет элементарную серу до тетрафторида серы :.
- С + 4 ВФ 5 → 4 ВФ 4 + СФ 4
Как и другие электрофильные галогениды металлов, он гидролизуется сначала до оксигалогенида :
- VF5 + H2O → VOF3 + 2HF
Затем к бинарному оксиду:
- 2 ВОФ 3 + 3 Н 2 О → В 2 О 5 + 6 ВЧ
Гидролиз ускоряется в присутствии основания. Несмотря на склонность к гидролизу, растворяется в спиртах.
Это кислота Льюиса , о чем свидетельствует образование ею гексафторованадата: [12] [13] [14]
- ВФ 5 + КФ → КВФ 6
Пентафторид ванадия является более слабой кислотой и в основном подвергается окислительным и фторирующим реакциям. [15]
Соединение фторирует ненасыщенные полифторолефины в полифторалканы. [10]
Соединение растворяется без реакции в жидких Cl2 и Br2 . VF5 умеренно растворим в HF.
Ссылки
- ^ abc Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 989. ISBN 978-0-08-037941-8.
- ^ Canterford, JH; O'Donnell, Thomas A. (1967-03-01). "Реакционная способность фторидов переходных металлов. IV. Окислительно-восстановительные реакции пентафторида ванадия". Неорганическая химия . 6 (3): 541– 544. doi :10.1021/ic50049a025. ISSN 0020-1669.
- ^ ab Brownstein, S.; Latremouille, G. (1974-06-15). "Комплексные фторанионы в растворе. V. Пентафторид ванадия". Canadian Journal of Chemistry . 52 (12): 2236– 2241. doi : 10.1139/v74-323 . ISSN 0008-4042.
- ^ Хаген, Колбьёрн.; Гилберт, Майкл М.; Хедберг, Лиз.; Хедберг, Кеннет. (1982-07-01). "Молекулярная структура газообразного пентафторида ванадия, VF5". Неорганическая химия . 21 (7): 2690– 2693. doi :10.1021/ic00137a031. ISSN 0020-1669.
- ^ Браунштейн, С. (1980-06-01). «Структура VF5 в растворе». Журнал химии фтора . 15 (6): 539– 540. doi :10.1016/S0022-1139(00)85231-8.
- ^ Никитин, МИ; Збежнева, СГ (2014-12-16). "Термохимия фторидов ванадия: Энтальпии образования фторидов ванадия". High Temperature . 52 (6): 809– 813. doi :10.1134/S0018151X14060108. ISSN 0018-151X. S2CID 98343689.
- ^ Треворроу, Л. Э.; Фишер, Дж.; Стеуненберг, Р. К. (1957). «Получение и свойства пентафторида ванадия». Журнал Американского химического общества . 79 (19): 5167– 5168. doi :10.1021/ja01576a023.
- ^ Ерш, Отто ; Ликфетт, Герберт (1911). «Ванадинфторид». Berichte der Deutschen Chemischen Gesellschaft . 44 (3): 2539–2549 . doi :10.1002/cber.19110440379.
- ^ Кавелл, RG; Кларк, HC (1963). "Термохимия фторидов ванадия". Труды Фарадейского общества . 59 : 2706. doi :10.1039/TF9635902706.
- ^ abc Красильников, ВА; Андреев, ГГ; Карелин, АИ; Гузеева, ТИ; Фурин, ГГ; Бардин, ВВ; Авраменко, АА (1995-10-17). "ChemInform Abstract: Synthesis and Use of Vanadium Pentafluoride". ChemInform . 26 (42): no. doi :10.1002/chin.199542022. ISSN 1522-2667.
- ^ Кларк, HC; Эмелеус, HJ (январь 1958 г.). "40. Химические реакции с пентафторидами ванадия, ниобия и тантала". J. Chem. Soc. : 190– 195. doi :10.1039/jr9580000190.
- ^ Никольский, Б.П. [Никольский, Б.П.] и др. , ред. (1971). Справочник химика [ Справочник химика ] (на русском языке) . 3-е (исправленное) изд. Ленинград : Химия .
- ^ Кнунянц, И.Л. [Кнунянц, И.Л.] и др. , ред. (1995). Химическая энциклопедия [ Химическая энциклопедия ] (на русском языке) . Москва: Советские энциклопедии. ISBN 978-5-85270-092-6
- ^ Лидин, Р.А. [Лидин Р.А.] и др. (2000). Химические свойства неорганических веществ: Учеб. пособие для вузов [ Химические свойства неорганических веществ: Вузовский учебник ] (на русском языке) . 3-е (исправленное) изд. Москва: Химия . ISBN 978-5-7245-1163-6
- ^ Фаулер, Брайан Р.; Мосс, Кеннет К. (1979-12-01). «Исследование химии растворов пентафторида ванадия методом ЯМР». Журнал химии фтора . 14 (6): 485– 494. doi :10.1016/S0022-1139(00)82524-5.
Другое чтение
- Арнольд Ф. Холлеман, Нильс Виберг: Lehrbuch der Anorganischen Chemie , 102. Auflage, de Gruyter, Berlin 2007, S. 1545, ISBN 978-3-11-017770-1 .


