Нитрат титана(IV)
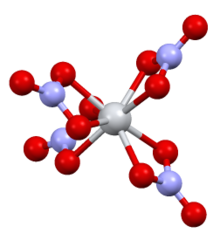 Шаростержневая модель [1] [2] | |
| Имена | |
|---|---|
| Другие имена тетранитрат титана, тетранитратотитан | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.222.601 |
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| Ti( NO3 ) 4 | |
| Молярная масса | 295,8866 г/моль |
| Появление | белое летучее твердое вещество |
| Плотность | 2.192 [3] |
| Температура плавления | 58 [4] °С (136 °F; 331 К) |
| Точка кипения | разлагаться |
| Реагирует [5] | |
| Структура [6] | |
| моноклинный | |
| П2 1 /С | |
а = 7,80, b = 13,57, c = 10,34 Å α = 90°, β = 125·0°, γ = 90° | |
Объем решетки ( V ) | 896,52 Å 3 |
Формульные единицы ( Z ) | 4 |
| 8 | |
| сплющенный тетраэдрический | |
| Родственные соединения | |
Родственные соединения | нитрат гафния , нитрат циркония , фосфат титана, перхлорат титана |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Нитрат титана — неорганическое соединение с формулой Ti(NO 3 ) 4 . Это бесцветное диамагнитное твердое вещество, которое легко сублимируется. Это необычный пример летучего бинарного нитрата переходного металла. Нечетко определенные виды, называемые нитратом титана, образуются при растворении титана или его оксидов в азотной кислоте.
Подготовка
Аналогично оригинальному методу [7] [8] Ti(NO 3 ) 4 получают путем нитрования тетрахлорида титана с использованием пентоксида азота [9] или нитрата хлора : [10]
- TiCl 4 + 4 N 2 O 5 → Ti(NO 3 ) 4 + 4 ClNO 2
Гидратированный нитрат титана, азотнокислая соль аквакомплекса [ Ti(H 2 O) 6 ] 3+ , образуется при растворении соединений титана в азотной кислоте. [11]
Структура
Комплекс имеет симметрию D 2d с четырьмя бидентатными нитратными лигандами. Расстояния NO составляют 1·29 Å и 1·185 Å (некоординированные). [6]
Физические свойства
В инфракрасном спектре он сильно поглощает при 1635 см −1 , что соответствует колебательной моде NO. [12]
Растворим в неполярных растворителях тетрахлориде кремния и тетрахлориде углерода. [13] [8]
Реакции
Нитрат титана гигроскопичен, превращается в плохо определенные гидраты. [14] Безводный материал очень реактивен, даже по отношению к углеводородам. [14] Нитрат титана также реагирует с н- додеканом , [15] п-дихлорбензолом , анизолом , бифенилом , [15] [16]
Он разлагается термически до диоксида титана. [17]
Ссылки
- ^ Гарнер, CD; Уоллворк, SC (1966). «Кристаллические структуры безводных нитратов и их комплексов. Часть III. Нитрат титана (IV)». J. Chem. Soc. A : 1496–1500. doi :10.1039/J19660001496.
- ^ "ICSD 26639: Структура ICSD: N4 O12 Ti". Кембриджская структурная база данных : Access Structures . Кембриджский центр кристаллографических данных . Получено 2021-05-08 .
- ^ "Титан(iv) нитрат (Ti(NO3)4)" . Получено 27 сентября 2014 г. .
- ^ Химия элементов (второе издание). NN Greenwood и A. Earnshaw. P 966. 21.3.4 Соединения с оксоанионами
- ^ Натаниэль Хауэлл Фурман; Р. Дж. Манди; Г. Х. Моррисон (1955). Распределение нитрата уранила из водных растворов в диэтиловый эфир . Мичиганский университет: Комиссия по атомной энергии США. Техническая информационная служба. стр. 51.
- ^ ab Garner, C. David; Ian H. Hillier; Martyn F. Guest (1975). "Ab initio self-consistent field molecular-orbitalcalculation of the primary state of tetranitratotitanium(IV); comments on the reactibility of anhydrous metal nitrates". Журнал химического общества, Dalton Transactions (19): 1934. doi :10.1039/DT9750001934. ISSN 0300-9246.
- ^ Райлен, Ганс; Андреас Хаке (1927). «Über die Konstitution des N2O4 и N2O3 und die Additionsverbindungen von Nitro- und Nitrosokörpern an Zinn- und Titantetraflorid». Annalen der Chemie Юстуса Либиха (на немецком языке). 452 (1): 47–67. дои : 10.1002/jlac.19274520104. ISSN 0075-4617.
- ^ аб Шмайссер, Мартин (1955). «Die Chemie der anorganischen Acylnitrate (ein the проблема нитрилхлоридов) и ацилперхлората (ein проблема дихлоргексоксидов)». Angewandte Chemie (на немецком языке). 67 (17–18): 493–501. Бибкод : 1955АнгЧ..67..493С. дои : 10.1002/ange.19550671708. ISSN 0044-8249.
- ^ P. Ehrlich "Titanium Tetranitrate" в Handbook of Preparative Inorganic Chemistry, 2nd Ed. Под редакцией G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1237.
- ^ Шмайссер, М.; Брандл, К. Ацилнитраты и перхлораты. IV. ClNO3 как исходный материал для ацилнитратов. Angewandte Chemie , 1957. 69: 781. ISSN: 0044-8249.
- ^ Виберг, Эгон; Виберг, Нильс (2001). Неорганическая химия. Academic Press. стр. 1331. ISBN 9780123526519. Получено 28 сентября 2014 г.
- ^ Addison, CC; Logan, N.; Wallwork, SC; Garner, CD (1971). «Структурные аспекты координированных нитратных групп». Quarterly Reviews, Chemical Society . 25 (2): 289. doi :10.1039/qr9712500289.
- ^ Амос, Д. В.; Г. В. Флеветт (1974). «Рамановские спектры нитратов титана (IV) и олова (IV)». Spectrochimica Acta Часть A: Молекулярная спектроскопия . 30 (2): 453–461. Bibcode :1974AcSpA..30..453A. doi :10.1016/0584-8539(74)80085-1. ISSN 0584-8539.
- ^ ab Amos, DW; DA Baines, GW Flewett (1973). «Нитрование нитратом титана (IV)». Tetrahedron Letters . 14 (34): 3191–3194. doi :10.1016/S0040-4039(00)79808-X. ISSN 0040-4039.
- ^ ab Coombes, Robert G.; Leslie W. Russell (1974). "Нитрование ароматических соединений тетранитратотитаном(IV) в растворе четыреххлористого углерода". Журнал химического общества, Perkin Transactions 2 (7): 830. doi :10.1039/P29740000830. ISSN 0300-9580.
- ^ Шофилд, Кеннет (1980). Ароматическое нитрование. Архив CUP. стр. 97–98. ISBN 9780521233620. Получено 27 сентября 2014 г.
- ^ Аллендорф, Марк Дональд (1999-01-01). "Оксид титана CVD из нитрата титана (IV) ...". Труды симпозиума по фундаментальной газофазной и поверхностной химии паровой фазы синтеза материалов . Электрохимическое общество. стр. 395–397. ISBN 9781566772174. Получено 27 сентября 2014 г.
Другое чтение
- Партингтон, Дж. Р.; А. Л. Уайнс (1949). "660. Реакции нитрозилхлорида. Часть II". Журнал химического общества (возобновление) : 3135. doi :10.1039/JR9490003135. ISSN 0368-1769.
- Dauerman, L.; GE Salser (1973). "Масс-спектры ковалентных неорганических нитратов: нитрат меди (II) и нитрат титана (IV)". Журнал неорганической и ядерной химии . 35 (1): 304–306. doi :10.1016/0022-1902(73)80643-8. ISSN 0022-1902.
