Тиамин
 | |
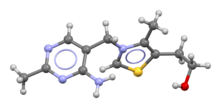 Скелетная формула и шаростержневая модель катиона тиамина | |
| Клинические данные | |
|---|---|
| Произношение | / ˈ θ aɪ . ə m ɪ n / THY -ə-мин |
| Другие имена | Витамин B1 , аневрин, тиамин |
| AHFS / Drugs.com | Монография |
| Данные лицензии |
|
| Пути введения | Внутрь , внутривенно , внутримышечно [1] |
| Класс наркотиков | Витамин |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Биодоступность | 3,7% - 5,3% (тиамина гидрохлорид) [2] |
| Период полувыведения | 1-12 ч. |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| DrugBank |
|
| ChemSpider |
|
| УНИИ | |
| КЕГГ |
|
| ЧЭБИ |
|
| ChEMBL |
|
| Панель инструментов CompTox ( EPA ) |
|
| Химические и физические данные | |
| Формула | С12Н17Н4ОS + |
| Молярная масса | 265,36 г·моль −1 |
| 3D модель ( JSmol ) |
|
| |
| |
Тиамин , также известный как тиамин и витамин B1 , является витамином – незаменимым микроэлементом для людей и животных. [1] [3] [4] Он содержится в пище и синтезируется в коммерческих целях в качестве пищевой добавки или лекарства . [1] Фосфорилированные формы тиамина необходимы для некоторых метаболических реакций , включая расщепление глюкозы и аминокислот . [1] [3] [5]
Пищевые источники тиамина включают цельное зерно , бобовые , а также некоторые виды мяса и рыбы. [1] Обработка зерна удаляет большую часть витаминного содержания, поэтому во многих странах крупы и муку обогащают тиамином . [1] [5] Существуют добавки и лекарства для лечения и профилактики дефицита тиамина и расстройств, которые являются его результатом, таких как бери-бери и энцефалопатия Вернике . [1] [3] [5] Они также используются для лечения болезни кленового сиропа мочи и синдрома Лея . [6] Добавки и лекарства обычно принимаются внутрь , но также могут вводиться внутривенно или внутримышечно . [6]
Добавки тиамина, как правило, хорошо переносятся. Аллергические реакции , включая анафилаксию , могут возникнуть при введении повторных доз путем инъекции. [4] [6] [7] Тиамин включен в Список основных лекарственных средств Всемирной организации здравоохранения . [8] Он доступен как дженерик , а в некоторых странах как безрецептурная пищевая добавка. [1] [6] В 2022 году он был 288-м наиболее часто назначаемым лекарством в Соединенных Штатах, с более чем 500 000 рецептов. [9] [10]
Определение
Тиамин является одним из витаминов группы В и также известен как витамин B1 . [ 1] [11] [12] Это катион , который обычно поставляется в виде хлоридной соли . [3] Он растворим в воде, метаноле и глицерине , но практически нерастворим в менее полярных органических растворителях . [13] [14] В организме тиамин может образовывать производные ; наиболее хорошо охарактеризованным из которых является тиаминпирофосфат (ТПФ), кофермент в катаболизме сахаров и аминокислот. [3] [11]
Химическая структура состоит из аминопиримидинового и тиазолиевого кольца, связанных метиленовым мостиком . [3] Тиазол замещен метильной и гидроксиэтильной боковыми цепями . [3] Тиамин стабилен при кислом pH , но нестабилен в щелочных растворах и при воздействии тепла . [13] [14] Он активно реагирует в реакциях типа Майяра . [13] Окисление дает флуоресцентное производное тиохром , которое можно использовать для определения количества витамина, присутствующего в биологических образцах. [15]
Дефицит
Известные расстройства, вызванные дефицитом тиамина, включают бери-бери , синдром Вернике-Корсакова , нейропатию зрительного нерва , болезнь Лея , африканскую сезонную атаксию (или нигерийскую сезонную атаксию) и центральный понтинный миелинолиз . [5] [16] Симптомы включают недомогание , потерю веса, раздражительность и спутанность сознания. [5] [13] [17] [18]
В западных странах хронический алкоголизм является фактором риска дефицита. [1] [5] Также в группе риска находятся пожилые люди, лица с ВИЧ/СПИДом или диабетом , а также те, кто перенес бариатрическую операцию . [1] [5] Различные степени недостаточности тиамина были связаны с длительным применением диуретиков . [19] [20]
Биологические функции

Известно пять природных производных фосфата тиамина: тиаминмонофосфат (ThMP), тиаминпирофосфат (TPP), тиаминтрифосфат (ThTP), аденозинтиаминдифосфат (AThDP) и аденозинтиаминтрифосфат (AThTP). [3] Они участвуют во многих клеточных процессах. [21] Наиболее охарактеризованной формой является TPP, кофермент в катаболизме сахаров и аминокислот. Хотя его роль хорошо известна, некоферментное действие тиамина и производных может быть реализовано посредством связывания с белками, которые не используют этот механизм. [22] Физиологическая роль монофосфата неизвестна, за исключением промежуточного звена в клеточном превращении тиамина в ди- и трифосфаты. [23]
Пирофосфат тиамина
Тиаминпирофосфат (ТПФ), также называемый тиаминдифосфатом (ТДФ), участвует в качестве кофермента в метаболических реакциях, включая те, в которых происходит инверсия полярности . [3] [24] Его синтез катализируется ферментом тиаминдифосфокиназой в соответствии с реакцией тиамин + АТФ → ТПФ + АМФ (EC 2.7.6.2). [3] Однако недавние открытия показывают, что уридин-5′-трифосфат (УТФ), а не АТФ, является предпочтительным субстратом для синтеза ТПФ в клетках, при этом ТПК1 демонстрирует примерно в 10 раз более высокое сродство к УТФ. [25] ТПФ является коферментом для нескольких ферментов, которые катализируют перенос двухуглеродных единиц и, в частности, дегидрирование ( декарбоксилирование и последующее сопряжение с коферментом А ) 2-оксокислот (альфа-кетокислот). [3] Механизм действия ТПФ как кофермента основан на его способности образовывать илид . [ 26] Примеры включают:
- Присутствует у большинства видов
- Присутствует у некоторых видов:
- пируватдекарбоксилаза (в дрожжах )
- несколько дополнительных бактериальных ферментов
Ферменты транскетолаза, пируватдегидрогеназа (ПДГ) и 2-оксоглутаратдегидрогеназа (ОГДГ) играют важную роль в метаболизме углеводов . [3] ПДГ связывает гликолиз с циклом лимонной кислоты . ОГДГ катализирует общее превращение 2-оксоглутарата (альфа-кетоглутарата) в сукцинил-КоА и CO2 в цикле лимонной кислоты . [3] Реакция, катализируемая ОГДГ, является этапом, ограничивающим скорость в цикле лимонной кислоты. Цитозольный фермент транскетолаза играет центральную роль в пентозофосфатном пути , основном маршруте биосинтеза пентозных сахаров дезоксирибозы и рибозы . [3] Митохондриальные ПДГ и ОГДГ являются частью биохимических путей, которые приводят к образованию аденозинтрифосфата (АТФ), который является основной молекулой переноса энергии для клетки. [3] В нервной системе ПДГ также участвует в синтезе миелина и нейромедиатора ацетилхолина . [14]
Тиаминтрифосфат
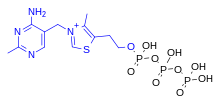
ThTP участвует в активации хлоридных каналов в нейронах млекопитающих и других животных, хотя его роль не совсем понятна. [23] ThTP был обнаружен в бактериях, грибах и растениях, что позволяет предположить, что он имеет и другие клеточные роли. [27] В Escherichia coli он участвует в реакции на голодание аминокислот. [28]
Производные аденозина
AThDP присутствует в небольших количествах в печени позвоночных, но его роль остается неизвестной. [28]
AThTP присутствует в E. coli , где он накапливается в результате углеродного голодания. В этой бактерии AThTP может составлять до 20% от общего количества тиамина. Он также присутствует в меньших количествах в дрожжах , корнях высших растений и тканях животных. [28]
Медицинское применение
Во время беременности тиамин поступает к плоду через плаценту . Беременные женщины нуждаются в этом витамине больше, чем другие взрослые, особенно в третьем триместре . [1] [3] Беременные женщины с неукротимой рвотой беременных подвержены повышенному риску дефицита тиамина из-за потерь при рвоте. [29] У кормящих женщин тиамин поступает в грудное молоко, даже если это приводит к дефициту тиамина у матери. [12] [30]
Тиамин важен не только для развития митохондриальной мембраны , но и для функционирования синаптической мембраны . [31] Также было высказано предположение, что дефицит препятствует развитию мозга у младенцев и может быть причиной синдрома внезапной детской смерти . [23]
Рекомендации по питанию
| Национальная медицинская академия США | |
| Возрастная группа | Рекомендуемая суточная норма (мг/день) |
|---|---|
| Младенцы 0–6 месяцев | 0.2* |
| Младенцы 6–12 месяцев | 0.3* |
| 1–3 года | 0,5 |
| 4–8 лет | 0,6 |
| 9–13 лет | 0.9 |
| Девушки 14–18 лет | 1.0 |
| Мужчины 14+ лет | 1.2 |
| Женщины 19+ лет | 1.1 |
| Беременные/кормящие женщины 14–50 | 1.4 |
| * Адекватное потребление для младенцев, поскольку рекомендуемая суточная норма еще не установлена [12] | |
| Европейское агентство по безопасности пищевых продуктов | |
| Возрастная группа | Адекватное потребление (мг/МДж) [32] |
| Все лица 7 месяцев+ | 0.1 |
| Ни Национальная академия медицины США, ни Европейское управление по безопасности пищевых продуктов не определили допустимый верхний уровень потребления тиамина [12] | |
Национальная академия медицины США обновила Оценочные средние потребности (EAR) и Рекомендуемые диетические нормы (RDA) для тиамина в 1998 году. EAR для тиамина для женщин и мужчин в возрасте 14 лет и старше составляют 0,9 мг/день и 1,1 мг/день соответственно; RDA составляют 1,1 и 1,2 мг/день соответственно. RDA выше, чем EAR, чтобы обеспечить адекватные уровни потребления для лиц с более высокими, чем средние, потребностями. RDA во время беременности и для кормящих женщин составляет 1,4 мг/день. Для младенцев в возрасте до 12 месяцев адекватное потребление (AI) составляет 0,2–0,3 мг/день, а для детей в возрасте 1–13 лет RDA увеличивается с возрастом от 0,5 до 0,9 мг/день. [12]
Европейское агентство по безопасности пищевых продуктов (EFSA) называет коллективный набор информации Диетическими референтными значениями , с Референтными значениями потребления для населения (PRI) вместо RDA и Средними требованиями вместо EAR. Для женщин (включая беременных или кормящих), мужчин и детей PRI составляет 0,1 мг тиамина на мегаджоуль (МДж) энергии в их рационе. Поскольку преобразование составляет 1 МДж = 239 ккал, взрослый человек, потребляющий 2390 килокалорий, должен потреблять 1,0 мг тиамина. Это немного ниже, чем RDA в США. [33]
Ни Национальная академия медицины, ни EFSA не установили верхний уровень потребления тиамина, поскольку отсутствуют данные о побочных эффектах от высоких доз у людей. [12] [32]
Безопасность
Тиамин обычно хорошо переносится и нетоксичен при пероральном приеме . [6] Имеются редкие сообщения о неблагоприятных побочных эффектах при внутривенном введении тиамина , включая аллергические реакции, тошноту , летаргию и нарушение координации . [32] [11]
Маркировка
Для маркировки пищевых продуктов и диетических добавок в США количество в порции выражается в процентах от дневной нормы. С 27 мая 2016 года дневная норма составляет 1,2 мг, в соответствии с RDA. [1] [34] [35]
Источники
Тиамин содержится в самых разных обработанных и цельных продуктах, включая чечевицу , горох , цельное зерно , свинину и орехи . [1] [36] Типичный ежедневный пренатальный витаминный продукт содержит около 1,5 мг тиамина. [37]
Обогащение продуктов питания
Некоторые страны требуют или рекомендуют обогащение зерновых продуктов, таких как пшеница , рис или кукуруза (кукуруза), поскольку обработка снижает содержание витаминов. [5] [38] По состоянию на февраль 2022 года 59 стран, в основном в Северной и южных районах Африки, требуют обогащения пищевых продуктов из пшеницы, риса или кукурузы тиамином или мононитратом тиамина. Указанные количества варьируются от 2,0 до 10,0 мг/кг. [39] Еще 18 стран имеют добровольную программу обогащения. Например, правительство Индии рекомендует 3,5 мг/кг для муки «майда» (белая) и «атта» (цельнозерновая) . [40]
Синтез
Биосинтез
Биосинтез тиамина происходит у бактерий, некоторых простейших, растений и грибов. [41] [42] Тиазольные и пиримидиновые фрагменты биосинтезируются отдельно, а затем объединяются, образуя ThMP под действием тиаминфосфатсинтазы .
Система пиримидинового кольца образуется в реакции, катализируемой фосфометилпиримидинсинтазой (ThiC), ферментом в радикальном суперсемействе SAM железо-серных белков , которые используют S-аденозилметионин в качестве кофактора . [43] [44]
Исходным материалом является 5-аминоимидазолриботид , который подвергается реакции перегруппировки через радикальные промежуточные соединения, которые включают синие, зеленые и красные фрагменты, показанные в продукте. [45] [46]
Тиазольное кольцо образуется в реакции, катализируемой тиазолсинтазой (EC 2.8.1.10). [43] Конечными предшественниками являются 1-дезокси-D-ксилулоза 5-фосфат, 2-иминоацетат и белок-переносчик серы, называемый ThiS. Дополнительный белок, ThiG, также требуется для объединения всех компонентов кольца в активном центре фермента. [47]
Последний шаг в образовании ThMP включает декарбоксилирование промежуточного тиазола, который реагирует с пирофосфатным производным фосфометилпиримидина, который сам по себе является продуктом киназы , фосфометилпиримидинкиназы . [43]
Биосинтетические пути различаются у разных организмов. В E. coli и других энтеробактериях ThMP фосфорилируется до кофактора TPP тиаминфосфаткиназой ( ThMP + АТФ → TPP + АДФ). [43] В большинстве бактерий и эукариот ThMP гидролизуется до тиамина, а затем пирофосфорилируется до TPP тиаминдифосфокиназой (тиамин + АТФ → TPP + AMP). [48]
Биосинтетические пути регулируются рибопереключателями . [11] Если в клетке присутствует достаточное количество тиамина, то тиамин связывается с мРНК для ферментов, которые требуются в пути, и предотвращает их трансляцию . Если тиамина нет, то ингибирования нет, и ферменты, необходимые для биосинтеза, производятся. Конкретный рибопереключатель, рибопереключатель TPP , является единственным известным рибопереключателем, обнаруженным как в эукариотических, так и в прокариотических организмах. [49]
Лабораторный синтез
В первом полном синтезе в 1936 году этил 3-этоксипропаноат обрабатывали этилформиатом, получая промежуточное дикарбонильное соединение, которое при реакции с ацетамидином образовывало замещенный пиримидин . Превращение его гидроксильной группы в аминогруппу осуществлялось путем нуклеофильного ароматического замещения , сначала в хлоридное производное с использованием оксихлорида фосфора , а затем обработкой аммиаком . Затем этокси- группу преобразовывали в бромное производное с использованием бромистоводородной кислоты . На заключительном этапе тиамин (в виде его дибромидной соли) образовывался в реакции алкилирования с использованием 4-метил-5-(2-гидроксиэтил)тиазола. [50] : 7 [51]
Промышленный синтез

Merck & Co. адаптировала лабораторный синтез 1936 года, что позволило им производить тиамин в Рауэе в 1937 году. [51] Однако альтернативный путь с использованием промежуточного диамина Греве (5-(аминометил)-2-метил-4-пиримидинамин), впервые опубликованного в 1937 году, [52] был исследован Хоффманом Ла Рошем , и последовали конкурентоспособные производственные процессы. Эффективные пути к диамину продолжают представлять интерес. [51] [53] В Европейской экономической зоне тиамин зарегистрирован в соответствии с регламентом REACH , и там производится или импортируется от 100 до 1000 тонн в год. [54]
Синтетические аналоги
Многие аналоги витамина B 1 , такие как бенфотиамин , фурсультиамин и сульбутиамин , являются синтетическими производными тиамина. Большинство из них были разработаны в Японии в 1950-х и 1960-х годах как формы, предназначенные для улучшения абсорбции по сравнению с тиамином. [55] Некоторые из них одобрены для использования в некоторых странах в качестве лекарственного средства или безрецептурной пищевой добавки для лечения диабетической невропатии или других заболеваний. [56] [57] [58]
Всасывание, метаболизм и выведение
В верхнем отделе тонкого кишечника тиаминфосфатные эфиры, присутствующие в пище, гидролизуются ферментами щелочной фосфатазы . [59] При низких концентрациях (<2 мкмоль л−1) процесс абсорбции опосредован переносчиками. [60] При более высоких концентрациях абсорбция также происходит посредством пассивной диффузии . [60] [11] Активный транспорт может быть подавлен употреблением алкоголя или дефицитом фолиевой кислоты . [13]
Большая часть тиамина в сыворотке циркулирует в связанном с альбумином состоянии [60] , более ( 90%) в эритроцитах (красных кровяных клетках) [60] и доставляется в клетки с высокими метаболическими потребностями, особенно в клетках мозга, печени, поджелудочной железы, сердца, скелетных и гладких мышцах, включая клетки сердечной мышцы. [5] В сыворотке крови крыс был обнаружен специфический связывающий белок, называемый тиамин-связывающим белком, который, как полагают, является гормонально-регулируемым белком-носителем, важным для распределения тиамина в тканях. [17] Поглощение тиамина клетками крови и других тканей происходит посредством активного транспорта и пассивной диффузии. [13] [60] Два члена семейства транспортных белков, кодируемых генами SLC19A2 и SLC19A3, способны транспортировать тиамин. [61] [60] [23] В некоторых тканях поглощение и секреция тиамина, по-видимому, опосредуются Na + -зависимым транспортером и трансклеточным протонным градиентом. [17]
У человека запасы тиамина составляют около 25–50 мг, [1] [62] с наибольшей концентрацией в печени, [1] [63] скелетных мышцах, сердце, мозге и почках. [62] [63] ThMP и свободный (нефосфорилированный) тиамин присутствуют в плазме, молоке, спинномозговой жидкости и, как предполагается, во всех внеклеточных жидкостях . В отличие от высокофосфорилированных форм тиамина, ThMP и свободный тиамин способны пересекать клеточные мембраны. Было показано, что кальций и магний влияют на распределение тиамина в организме, а дефицит магния , как было показано, усугубляет дефицит тиамина. [23] Содержание тиамина в тканях человека меньше, чем у других видов. [17] [64] Период полураспада тиамина, хранящегося в тканях человеческого организма, составляет около 9-18 дней, [62] тогда как после приема в высоких дозах период полураспада тиамина в циркулирующей крови составляет около одного-12 часов. [5] Кроме того, пирофосфат тиамина, полученный из пиримидинов, поддерживает синтез липидов и адипогенез, подчеркивая его роль в накоплении энергии и клеточной дифференцировке. [3] [25]
Тиамин и его метаболиты (2-метил-4-амино-5-пиримидинкарбоновая кислота, 4-метилтиазол-5-уксусная кислота и другие) выводятся в основном с мочой. [11]
Вмешательство
Биодоступность тиамина в пищевых продуктах может быть нарушена различными способами. Сульфиты , добавляемые в пищевые продукты в качестве консерванта, [65] атакуют тиамин по метиленовому мостику, расщепляя пиримидиновое кольцо от тиазольного кольца. Скорость этой реакции увеличивается в кислых условиях. [17] Тиамин расщепляется термолабильными тиаминазами, присутствующими в некоторых видах рыб, моллюсков и других продуктах. [13] Куколки африканского шелкопряда Anaphe venata являются традиционной пищей в Нигерии. Потребление приводит к дефициту тиамина. [66] В более старой литературе сообщалось, что в Таиланде потребление ферментированной, сырой рыбы вызывало дефицит тиамина, но либо воздержание от употребления рыбы в пищу, либо ее предварительное нагревание устраняли дефицит. [67] У жвачных животных кишечные бактерии синтезируют тиамин и тиаминазу. Бактериальные тиаминазы являются ферментами клеточной поверхности, которые должны диссоциировать от клеточной мембраны перед активацией; диссоциация может происходить у жвачных животных в ацидотических условиях . У молочных коров перекармливание зерном вызывает подострый ацидоз рубца и повышенное высвобождение тиаминазы бактериями рубца, что приводит к дефициту тиамина. [68]
Согласно отчетам о двух небольших исследованиях, проведенных в Таиланде, жевание ломтиков ореха ареки , завернутых в листья бетеля , и жевание листьев чая снижают биодоступность тиамина из пищи посредством механизма, который может включать танины . [67] [69]
Известно, что бариатрическая хирургия для снижения веса нарушает усвоение витаминов. [70] Метаанализ показал, что 27% людей, перенесших бариатрические операции, испытывают дефицит витамина B1 . [ 71]
История
Тиамин был первым из водорастворимых витаминов, который был выделен. [72] Самые ранние наблюдения за людьми и курами показали, что диета, состоящая в основном из шлифованного белого риса, вызывала бери-бери, но не приписывали это отсутствию ранее неизвестного необходимого питательного вещества. [73] [74]
В 1884 году Такаки Канехиро , главный хирург Императорского флота Японии , отверг предыдущую микробную теорию бери-бери и предположил, что болезнь была вызвана недостатками в рационе. [73] Меняя диету на военном корабле, он обнаружил, что замена диеты, состоящей только из белого риса, на диету, содержащую также ячмень, мясо, молоко, хлеб и овощи, почти устранила бери-бери за девятимесячное морское путешествие. Однако Такаки добавил много продуктов к успешной диете и ошибочно приписал пользу повышенному потреблению белка, поскольку витамины в то время были неизвестны. Военно-морской флот не был убежден в необходимости такой дорогостоящей программы улучшения питания, и многие люди продолжали умирать от бери-бери даже во время русско-японской войны 1904–1905 годов. Только в 1905 году, после того как был обнаружен антибери-бери фактор в рисовых отрубях (удалённых шлифовкой в белый рис ) и в ячменных отрубях, эксперимент Такаки был вознаграждён. Он был сделан бароном в японской системе пэрства, после чего его ласково называли «Ячменным бароном». [73]
Конкретная связь с зерном была установлена в 1897 году Кристианом Эйкманом , военным врачом в Голландской Ост-Индии , который обнаружил, что у домашней птицы, питающейся приготовленным шлифованным рисом, развивается паралич, который можно обратить вспять, прекратив шлифовку риса. [74] Он приписал бери-бери высокому уровню крахмала в рисе, который является токсичным. Он считал, что токсичность была нейтрализована соединением, присутствующим в шлифовке риса. [75] Его коллега Геррит Грайнс правильно интерпретировал связь между чрезмерным потреблением шлифованного риса и бери-бери в 1901 году: он пришел к выводу, что рис содержит необходимое питательное вещество во внешних слоях зерна, которое удаляется при шлифовке. [76] В конечном итоге Эйкман был удостоен Нобелевской премии по физиологии и медицине в 1929 году, потому что его наблюдения привели к открытию витаминов.
В 1910 году японский агрохимик из Токийского императорского университета Уметаро Судзуки выделил водорастворимое соединение тиамина из рисовых отрубей, которое он назвал абериновой кислотой . (Позже он переименовал его в оризанин .) Он описал это соединение не только как фактор против бери-бери, но и как вещество, необходимое для питания человека; однако это открытие не получило огласки за пределами Японии, поскольку утверждение о том, что это соединение является новым открытием, было опущено в переводе его публикации с японского на немецкий язык. [72] В 1911 году польский биохимик Казимир Функ выделил из рисовых отрубей антиневритическое вещество (современный тиамин), которое он назвал «витамином» (из-за содержания в нем аминогруппы). [77] [78] Однако Функ не полностью охарактеризовал его химическую структуру. Голландские химики Баренд Коенрад Петрус Янсен и его ближайший коллега Виллем Фредерик Донат в 1926 году выделили и кристаллизовали активный агент, [79] структура которого была определена Робертом Раннелсом Уильямсом в 1934 году. Тиамин был назван командой Уильямса как портманто «тио» (что означает серосодержащий) и «витамин». Термин «витамин» косвенно, через Функа, пришел из аминогруппы самого тиамина (хотя к этому времени было известно, что витамины не всегда являются аминами, например, витамин С ). Тиамин также был синтезирован группой Уильямса в 1936 году. [80]
Сэр Рудольф Питерс в Оксфорде использовал голубей, чтобы понять, как дефицит тиамина приводит к патологически-физиологическим симптомам бери-бери. У голубей, которых кормили исключительно шлифованным рисом, развивался опистотонус — состояние, характеризующееся втягиванием головы. Если их не лечить, животные умирали через несколько дней. Введение тиамина после того, как наблюдался опистотонус, приводило к полному излечению в течение 30 минут. Поскольку никаких морфологических изменений не наблюдалось в мозге голубей до и после лечения тиамином, Питерс ввел концепцию биохимически-индуцированного повреждения. [81] В 1937 году Ломанн и Шустер показали, что дифосфорилированное производное тиамина, ТФП, является кофактором, необходимым для окислительного декарбоксилирования пирувата. [82]
- Некоторые участники открытия тиамина
Ссылки
- ^ abcdefghijklmnop «Тиамин: информационный листок для специалистов здравоохранения». Управление пищевых добавок, Национальные институты здравоохранения США. 9 февраля 2023 г. Получено 21 января 2025 г.
- ^ Смитлайн HA, Доннино M, Гринблатт DJ (февраль 2012 г.). «Фармакокинетика высокодозного перорального гидрохлорида тиамина у здоровых субъектов». BMC Clinical Pharmacology . 12 (1): 4. doi : 10.1186/1472-6904-12-4 . PMC 3293077. PMID 22305197 .
- ^ abcdefghijklmnopq "Тиамин". Центр информации о микроэлементах, Институт Лайнуса Полинга, Университет штата Орегон. 2025. Получено 21 января 2025 г.
- ^ ab "Тиамин". MedlinePlus, Национальная медицинская библиотека США . Получено 21 января 2025 г.
- ^ abcdefghij Whitfield KC, Бурасса М.В., Адамолекун Б., Бержерон Г., Беттендорф Л., Браун К.Х. и др. (октябрь 2018 г.). «Расстройства, вызванные дефицитом тиамина: диагностика, распространенность и план действий для глобальных программ борьбы». Анналы Нью-Йоркской академии наук . 1430 (1): 3– 43. Бибкод : 2018NYASA1430....3W. дои : 10.1111/nyas.13919. ПМК 6392124 . ПМИД 30151974.
- ^ abcde Американское общество фармацевтов системы здравоохранения (12 января 2025 г.). "Тиамина гидрохлорид". Drugs.com . Получено 21 января 2025 г. .
- ^ Kliegman RM, Stanton B (2016). Учебник педиатрии Нельсона. Elsevier Health Sciences. стр. 322. ISBN 9781455775668.
Случаев неблагоприятных последствий избытка тиамина не зафиксировано... Несколько отдельных случаев пурита...
- ^ Всемирная организация здравоохранения (2019). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г. Женева: Всемирная организация здравоохранения. hdl : 10665/325771 . WHO/MVP/EMP/IAU/2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ "Топ-300 2022 года". ClinCalc . Архивировано из оригинала 30 августа 2024 года . Получено 30 августа 2024 года .
- ^ "Статистика использования тиамина, США, 2013-2022". ClinCalc . Получено 30 августа 2024 .
- ^ abcdef Bettendorff L (2020). «Тиамин». В Marriott BP, Birt DF, Stallings VA, Yates AA (ред.). Современные знания в области питания, одиннадцатое издание . Лондон, Великобритания: Academic Press (Elsevier). стр. 171–88 . ISBN 978-0-323-66162-1.
- ^ abcdef Институт медицины (1998). "Тиамин". Диетические рекомендации по потреблению тиамина, рибофлавина, ниацина, витамина B6, фолата, витамина B12, пантотеновой кислоты, биотина и холина . Вашингтон, округ Колумбия: The National Academies Press. стр. 58–86 . ISBN 978-0-309-06554-2. Архивировано из оригинала 16 июля 2015 . Получено 29 августа 2017 .
- ^ abcdefg Mahan LK, Escott-Stump S, ред. (2000). Еда, питание и диетотерапия Краузе (10-е изд.). Филадельфия: WB Saunders Company. ISBN 978-0-7216-7904-4.
- ^ abc Butterworth RF (2006). «Тиамин». В Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ (ред.). Современное питание в здоровье и болезнях (10-е изд.). Балтимор: Lippincott Williams & Wilkins.
- ^ Беттендорф Л., Винс П. (2013). «Биохимия тиамина и тиаминфосфатных соединений». Энциклопедия биологической химии . С. 202– 9. doi :10.1016/B978-0-12-378630-2.00102-X. ISBN 9780123786319.
- ^ МакКэндлесс Д. (2010). Дефицит тиамина и сопутствующие клинические расстройства . Нью-Йорк, Нью-Йорк: Humana Press. С. 157–9 . ISBN 978-1-60761-310-7.
- ^ abcde Combs Jr GF (2008). Витамины: фундаментальные аспекты питания и здоровья (3-е изд.). Итака, Нью-Йорк: Elsevier Academic Press. ISBN 978-0-12-183493-7.
- ^ Smith TJ, Johnson CR, Koshy R, Hess SY, Qureshi UA, Mynak ML и др. (август 2021 г.). «Расстройства, связанные с дефицитом тиамина: клиническая перспектива». Annals of the New York Academy of Sciences . 1498 (1): 9– 28. Bibcode : 2021NYASA1498....9S. doi : 10.1111/nyas.14536. PMC 8451766. PMID 33305487.
- ^ Katta N, Balla S, Alpert MA (июль 2016 г.). «Вызывает ли длительная терапия фуросемидом дефицит тиамина у пациентов с сердечной недостаточностью? Целенаправленный обзор». The American Journal of Medicine . 129 (7): 753.e7–753.e11. doi : 10.1016/j.amjmed.2016.01.037 . PMID 26899752.
- ^ Gomes F, Bergeron G, Bourassa MW, Fischer PR (август 2021 г.). «Дефицит тиамина, не связанный с потреблением алкоголя в странах с высоким уровнем дохода: обзор литературы». Annals of the New York Academy of Sciences . 1498 (1): 46–56 . Bibcode : 2021NYASA1498...46G. doi : 10.1111/nyas.14569. PMC 8451800. PMID 33576090 .
- ^ Фицпатрик ТБ, Чепмен ЛМ (август 2020 г.). «Значение тиамина (витамина B1) для здоровья растений: от урожайности до биоукрепления». Журнал биологической химии . 295 (34): 12002– 13. doi : 10.1074/jbc.REV120.010918 . PMC 7443482. PMID 32554808 .
- ^ Мкртчян Г, Алешин В, Пархоменко Ю, Кейн Т, Ди Сальво МЛ, Паррони А и др. (Июль 2015 г.). «Молекулярные механизмы некоферментного действия тиамина в мозге: биохимический, структурный и путевой анализ». Scientific Reports . 5 : 12583. Bibcode :2015NatSR...512583M. doi : 10.1038/srep12583 . PMC 4515825 . PMID 26212886.
- ^ abcde Lonsdale D (март 2006 г.). «Обзор биохимии, метаболизма и клинических преимуществ тиамина(е) и его производных». Evidence-Based Complementary and Alternative Medicine . 3 (1): 49– 59. doi :10.1093/ecam/nek009. PMC 1375232. PMID 16550223 .
- ↑ Болуда CJ, Хунка С, Сото Э, де ла Крус Д, Пенья А (13 декабря 2019 г.). «Умполунг в реакциях, катализируемых тиаминпирофосфатзависимыми ферментами». Ciencia, Ambiente y Clima (на испанском языке). 2 (2): 27–42 . doi : 10.22206/cac.2019.v2i2.pp27-42 . ISSN 2636-2333. S2CID 213836801. Архивировано из оригинала 1 декабря 2022 года . Проверено 1 декабря 2022 г.
- ^ ab Sahu U, Villa E, Reczek CR, Zhao Z, O'Hara BP, Torno MD и др. (март 2024 г.). «Пиримидины поддерживают окисление митохондриального пирувата для поддержки липогенеза de novo». Science . 383 (6690): 1484– 1492. doi :10.1126/science.adh2771. PMID 38547260.
- ^ Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS (июнь 2003 г.). «Структурная основа флип-флоп действия тиаминпирофосфатзависимых ферментов, выявленная человеческой пируватдегидрогеназой». Журнал биологической химии . 278 (23): 21240– 46. doi : 10.1074/jbc.M300339200 . hdl : 2060/20030106063 . PMID 12651851.
- ^ Makarchikov AF, Lakaye B, Gulyai IE, Czerniecki J, Coumans B, Wins P, et al. (Июль 2003). "Тиаминтрифосфат и тиаминтрифосфатазная активность: от бактерий до млекопитающих". Cellular and Molecular Life Sciences . 60 (7): 1477– 88. doi :10.1007/s00018-003-3098-4. PMC 11146050 . PMID 12943234. S2CID 25400487.
- ^ abc Bettendorff L (ноябрь 2021 г.). «Обновление о трифосфорилированных производных тиамина и метаболизирующих ферментативных комплексах». Биомолекулы . 11 (11): 1645. doi : 10.3390/biom11111645 . PMC 8615392. PMID 34827643 .
- ^ Oudman E, Wijnia JW, Oey M, van Dam M, Painter RC, Postma A (май 2019 г.). «Энцефалопатия Вернике при рвоте беременных: систематический обзор». European Journal of Obstetrics, Gynecology, and Reproductive Biology . 236 : 84–93 . doi : 10.1016/j.ejogrb.2019.03.006. hdl : 1874/379566 . PMID 30889425. S2CID 84184482.
- ^ Баттерворт РФ (декабрь 2001 г.). «Материнский дефицит тиамина: все еще проблема в некоторых мировых сообществах». Американский журнал клинического питания . 74 (6): 712– 3. doi : 10.1093/ajcn/74.6.712 . PMID 11722950.
- ^ Kloss O, Eskin NA, Suh M (апрель 2018 г.). «Дефицит тиамина при развитии мозга плода с пренатальным воздействием алкоголя и без него». Биохимия и клеточная биология . 96 (2): 169–77 . doi :10.1139/bcb-2017-0082. hdl : 1807/87775 . PMID 28915355.
- ^ abc Верхние допустимые уровни потребления витаминов и минералов (PDF) , Европейское агентство по безопасности пищевых продуктов, 2006, архив (PDF) из оригинала 16 марта 2016 г.
- ^ «Обзор рекомендуемых значений диетического питания для населения ЕС, разработанный Группой EFSA по диетическим продуктам, питанию и аллергиям» (PDF) . 2017. Архивировано (PDF) из оригинала 28 августа 2017 г.
- ^ "Федеральный регистр 27 мая 2016 г. Маркировка пищевых продуктов: Пересмотр этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982" (PDF) . Архивировано (PDF) из оригинала 8 августа 2016 г.
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". База данных этикеток диетических добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 г. . Получено 6 февраля 2022 г. .
- ^ "Содержание тиамина на 100 граммов; выбранный подмножество продуктов питания, сокращенный список по группам продуктов питания". Министерство сельского хозяйства США, Служба сельскохозяйственных исследований, База данных брендовых пищевых продуктов Министерства сельского хозяйства США, версия 3.6.4.1. 17 января 2017 г. Архивировано из оригинала 2 февраля 2017 г. Получено 27 января 2017 г.
- ^ Kominiarek MA, Rajan P (ноябрь 2016 г.). «Рекомендации по питанию во время беременности и лактации». The Medical Clinics of North America . 100 (6): 1199– 215. doi :10.1016/j.mcna.2016.06.004. PMC 5104202. PMID 27745590 .
- ^ «Какие питательные вещества добавляются в муку и рис при обогащении?». Инициатива по обогащению пищевых продуктов. 2021. Архивировано из оригинала 8 октября 2021 г. Получено 8 октября 2021 г.
- ^ "Карта: Количество питательных веществ в стандартах обогащения". Глобальный обмен данными по обогащению . Архивировано из оригинала 11 апреля 2019 г. Получено 11 октября 2021 г.
- ^ «Указание в соответствии с разделом 16(5) Закона о безопасности и стандартах пищевых продуктов 2006 года относительно введения в действие Положений о безопасности и стандартах пищевых продуктов (обогащение пищевых продуктов) 2017 года, касающихся стандартов обогащения пищевых продуктов» (PDF) . Управление по безопасности и стандартам пищевых продуктов Индии (FSSAI) . 19 мая 2017 г. Архивировано (PDF) из оригинала 17 декабря 2021 г. . Получено 1 февраля 2022 г. .
- ^ Webb ME, Marquet A, Mendel RR, Rébeillé F, Smith AG (октябрь 2007 г.). «Выяснение путей биосинтеза витаминов и кофакторов». Natural Product Reports . 24 (5): 988– 1008. doi :10.1039/b703105j. PMID 17898894.
- ^ Begley TP, Chatterjee A, Hanes JW, Hazra A, Ealick SE (апрель 2008 г.). «Биосинтез кофакторов — все еще дающий захватывающую новую биологическую химию». Current Opinion in Chemical Biology . 12 (2): 118– 25. doi :10.1016/j.cbpa.2008.02.006. PMC 2677635. PMID 18314013 .
- ^ abcd Caspi R (14 сентября 2011 г.). "Путь: суперпуть биосинтеза тиаминдифосфата I". База данных метаболических путей MetaCyc. Архивировано из оригинала 1 февраля 2022 г. Получено 1 февраля 2022 г.
- ^ Холлидей GL, Акива E, Менг EC, Браун SD, Калхун S, Пипер U и др. (2018). «Атлас радикального суперсемейства SAM: расходящаяся эволюция функции с использованием домена «Plug and Play»». Радикальные ферменты SAM . Методы в энзимологии. Том 606. С. 1–71 . doi :10.1016/bs.mie.2018.06.004. ISBN 9780128127940. PMC 6445391 . PMID 30097089.
- ^ Chatterjee A, Hazra AB, Abdelwahed S, Hilmey DG, Begley TP (ноябрь 2010 г.). «Радикальный танец» в биосинтезе тиамина: механистический анализ бактериальной гидроксиметилпиримидинфосфатсинтазы». Angewandte Chemie . 49 (46): 8653– 6. doi :10.1002/anie.201003419. PMC 3147014. PMID 20886485 .
- ^ Mehta AP, Abdelwahed SH, Fenwick MK, Hazra AB, Taga ME, Zhang Y и др. (август 2015 г.). «Образование анаэробного 5-гидроксибензимидазола из риботида аминоимидазола: неожиданное пересечение биосинтеза тиамина и витамина B₁₂». Журнал Американского химического общества . 137 (33): 10444– 7. doi : 10.1021/jacs.5b03576. PMC 4753784. PMID 26237670 .
- ^ Begley TP (февраль 2006 г.). «Биосинтез кофакторов: сокровищница органической химии». Natural Product Reports . 23 (1): 15– 25. doi :10.1039/b207131m. PMID 16453030.
- ^ Caspi R (23 сентября 2011 г.). "Путь: суперпуть биосинтеза тиаминдифосфата III (эукариоты)". База данных метаболических путей MetaCyc. Архивировано из оригинала 14 ноября 2022 г. Получено 14 ноября 2022 г.
- ^ Bocobza SE, Aharoni A (октябрь 2008 г.). «Включение света на рибопереключателях растений». Trends in Plant Science . 13 (10): 526–33 . Bibcode : 2008TPS....13..526B. doi : 10.1016/j.tplants.2008.07.004. PMID 18778966.
- ^ Tylicki A, Łotowski Z, Siemieniuk M, Ratkiewicz A (февраль 2018 г.). «Тиамин и отдельные антивитамины тиамина — биологическая активность и методы синтеза». Bioscience Reports . 38 (1). doi : 10.1042/BSR20171148 . PMC 6435462. PMID 29208764 .
- ^ abc Eggersdorfer M, Laudert D, Létinois U, McClymont T, Medlock J, Netscher T и др. (декабрь 2012 г.). «Сто лет витаминов — история успеха естественных наук». Angewandte Chemie . 51 (52): 12960– 90. doi :10.1002/anie.201205886. PMID 23208776.
- ^ Тодд А.Р., Бергель Ф (1937). «73. Аневрин. Часть VII. Синтез аневрина». Журнал Химического общества (обновленный) : 364. doi : 10.1039/JR9370000364.
- ^ Цзян М., Лю М., Хуан Х., Чэнь Ф. (2021). «Полностью непрерывный поточный синтез 5-(аминометил)-2-метилпиримидин-4-амина: ключевого промежуточного продукта витамина B1». Organic Process Research & Development . 25 (10): 2331– 7. doi :10.1021/acs.oprd.1c00253. S2CID 242772232.
- ^ "Substance Infocard". echa.europa.eu . Архивировано из оригинала 20 апреля 2021 г. . Получено 11 мая 2022 г. .
- ^ Беттендорф Л. (2014). «Глава 7 – Тиамин». В Земплени Дж., Сатти Дж.В., Грегори Дж.Ф., Стовер П.Дж. (ред.). Справочник витаминов (5-е изд.). Хобокен: CRC Press. стр. 267–324 . ISBN. 9781466515574.
- ^ Захир А, Захир Ф, Саид Х, Тахир З, Тахир МВ (апрель 2021 г.). «Обзор альтернативных вариантов лечения диабетической полинейропатии». Cureus . 13 (4). e14600. doi : 10.7759/cureus.14600 . PMC 8139599 . PMID 34040901.
- ^ Маккарти МФ, Иногучи Т (2008). "11. Нацеливание на оксидантный стресс как стратегия профилактики сосудистых осложнений диабета и метаболического синдрома". В Пасупулети ВК, Андерсон ДжВ (ред.). Нутрицевтики, гликемическое здоровье и диабет 2 типа (1-е изд.). Эймс, Айова: Wiley-Blackwell/IFT Press. стр. 213. ISBN 9780813804286.
- ^ Lonsdale D (сентябрь 2004 г.). «Тиамин тетрагидрофурфурилдисульфид: малоизвестный терапевтический агент». Medical Science Monitor . 10 (9): RA199–203. PMID 15328496. Архивировано из оригинала 25 сентября 2012 г. Получено 17 июля 2022 г.
- ^ Беттендорф Л. (2020). «Тиамин». Современные знания в области питания . стр. 171–188 . doi :10.1016/B978-0-323-66162-1.00010-X. ISBN 978-0-323-66162-1.
- ^ abcdef Laird E, Molloy A (2014). "Водорастворимые витамины и незаменимые питательные вещества". Справочный модуль по биомедицинским наукам . doi :10.1016/B978-0-12-801238-3.00233-6. ISBN 978-0-12-801238-3.
Тиамин всасывается через тонкую кишку (тонкий кишечник) посредством двух механизмов: активного транспорта или пассивной диффузии. При низких концентрациях (<2 мкмоль л−1) процесс представляет собой активный транспорт, опосредованный переносчиками. Два основных транспортера тиамина ThTR1 и ThTr2 необходимы для всасывания, и считается, что этот процесс регулируется внутриклеточным путем, опосредованным кальцием/кальмодулином, и фактической внеклеточной циркулирующей концентрацией самого тиамина. Большая часть тиамина в сыворотке связана с белком альбумином, причем более 90% содержится в эритроцитах. Клеточное поглощение происходит посредством активного транспорта и пассивной диффузии через транспортеры тиамина ThTr1 и ThTr2.
- ^ Лонсдейл Д., Маррс К. (2017). «Митохондрии, тиамин и вегетативная дисфункция». Тиаминдефицитная болезнь, дисавтономия и высококалорийное недоедание . С. 59–103 . doi :10.1016/B978-0-12-810387-6.00003-4. ISBN 978-0-12-810387-6.
- ^ abc Chandrakumar A, Bhardwaj A, 't Jong GW (октябрь 2018 г.). «Обзор расстройств, связанных с дефицитом тиамина: энцефалопатия Вернике и психоз Корсакова». J Basic Clin Physiol Pharmacol . 30 (2): 153– 162. doi :10.1515/jbcpp-2018-0075. PMID 30281514.
- ^ ab Combs GF (2012). "Тиамин". Витамины . стр. 261–276 . doi :10.1016/B978-0-12-381980-2.00010-4. ISBN 978-0-12-381980-2.
- ^ Беттендорф Л., Мастрогиакомо Ф., Киш С.Дж., Грисар Т. (январь 1996 г.). «Тиамин, тиаминфосфаты и их метаболизирующие ферменты в мозге человека». Журнал нейрохимии . 66 (1): 250– 8. doi :10.1046/j.1471-4159.1996.66010250.x. PMID 8522961. S2CID 7161882.
- ^ Макгуайр М., Бирман К. А. (2007). Науки о питании: от основ к продуктам питания . Калифорния: Томас Уодсворт.
- ^ Nishimune T, Watanabe Y, Okazaki H, Akai H (2000). «Тиамин разлагается из-за энтомофагии Anaphe spp. у пациентов с сезонной атаксией в Нигерии». J. Nutr . 130 (6): 1625– 8. doi : 10.1093/jn/130.6.1625 . PMID 10827220.
- ^ ab Vimokesant SL, Hilker DM, Nakornchai S, Rungruangsak K, Dhanamitta S (декабрь 1975 г.). «Влияние ореха бетеля и ферментированной рыбы на уровень тиамина у северо-восточных тайцев». Am J Clin Nutr . 28 (12): 1458– 63. doi :10.1093/ajcn/28.12.1458. PMID 803009.
- ^ Pan X, Nan X, Yang L, Jiang L, Xiong B (сентябрь 2018 г.). «Статус тиамина, метаболизм и применение у молочных коров: обзор». Br J Nutr . 120 (5): 491– 9. doi : 10.1017/S0007114518001666 . PMID 29986774. S2CID 51606809.
- ^ Вимокесант С., Кунджара С., Рунгруангсак К., Накорнчай С., Паниджпан Б. (1982). «Бери-бери, вызванная антитиаминовыми факторами в пище, и ее профилактика». Энн, Нью-Йоркская академия наук . 378 (1): 123–36 . Бибкод : 1982NYASA.378..123V. doi :10.1111/j.1749-6632.1982.tb31191.x. PMID 7044221. S2CID 40854060.
- ^ Nunes R, Santos-Sousa H, Vieira S, Nogueiro J, Bouça-Machado R, Pereira A и др. (март 2022 г.). «Дефицит витамина B-комплекса после желудочного шунтирования по Ру и рукавной гастрэктомии — систематический обзор и метаанализ». Obes Surg . 32 (3): 873– 91. doi :10.1007/s11695-021-05783-2. PMID 34982396. S2CID 245655046.
- ^ Бахардуст М., Эгбали Ф., Шахмири СС., Алиджанпур А., Яригхоли Ф., Вализаде Р. и др. (сентябрь 2022 г.). «Дефицит витамина B1 после бариатрической операции, распространенность и симптомы: систематический обзор и метаанализ». Obes Surg . 32 (9): 3104– 12. doi :10.1007/s11695-022-06178-7. PMID 35776243. S2CID 250149680.
- ^ ab Suzuki U, Shimamura T (1911). «Активный компонент рисовой крупы, предотвращающий полиневрит у птиц». Tokyo Kagaku Kaishi . 32 : 4–7 , 144–6 , 335–58 . doi : 10.1246/nikkashi1880.32.4 . Архивировано из оригинала 21 июня 2020 г. Получено 2 мая 2018 г.
- ^ abc McCollum EV (1957). История питания . Кембридж, Массачусетс: Riverside Press, Houghton Mifflin .
- ^ аб Эйкман С (1897). «Eine Beriberiähnliche Krankheit der Hühner» [Болезнь кур, похожая на бери-бери]. Архив патологической анатомии, физиологии и клинической медицины . 148 (3): 523–532 . doi : 10.1007/BF01937576. S2CID 38445999. Архивировано из оригинала 9 августа 2020 года . Проверено 4 июля 2019 г.
- ^ "Нобелевская премия и открытие витаминов". nobelprize.org . Архивировано из оригинала 16 января 2018 года . Получено 1 мая 2018 года .
- ^ Грейнс Г. (1901). «О полиневрите желчном». Geneeskundig Tijdschrift voor Nederlandsch-Indië (Медицинский журнал для Голландской Ост-Индии) . 41 (1): 3–11 . Архивировано из оригинала 29 августа 2021 года . Проверено 5 февраля 2020 г.
- ^ Funk C (декабрь 1911 г.). «О химической природе вещества, которое лечит полиневрит у птиц, вызванный диетой из шлифованного риса». Журнал физиологии . 43 (5): 395–400 . doi :10.1113/jphysiol.1911.sp001481. PMC 1512869. PMID 16993097 .
- ^ Funk C (1912). «Этиология болезней, вызванных недостатком питательных веществ. Бери-бери, полиневрит у птиц, эпидемическая водянка, цинга, экспериментальная цинга у животных, детская цинга, судовой бери-бери, пеллагра». Journal of State Medicine . 20 : 341–68 . Архивировано из оригинала 4 июля 2020 г. Получено 5 февраля 2020 г.Слово «витамин» введено на стр. 342: «В настоящее время известно, что все эти болезни, за исключением пеллагры, можно предотвратить и вылечить путем добавления определенных профилактических веществ; недостающие вещества, имеющие природу органических оснований, мы будем называть «витаминами»; и мы будем говорить о витамине бери-бери или цинги, что означает вещество, предотвращающее особую болезнь».
- ^ Jansen BC, Donath WF (1926). «О выделении витамина антибери-бери». Proc. Kon. Ned. Akad. Wet . 29 : 1390–400 .
- ^ Уильямс Р. Р., Клайн Дж. К. (1936). «Синтез витамина B 1 ». Журнал Американского химического общества . 58 (8): 1504– 5. Bibcode : 1936JAChS..58.1504W. doi : 10.1021/ja01299a505.
- ^ Peters RA (1936). «Биохимическое поражение при дефиците витамина B 1. Применение современного биохимического анализа в его диагностике». Lancet . 230 (5882): 1161– 4. doi :10.1016/S0140-6736(01)28025-8.
- ^ Ломанн К., Шустер П. (1937). «Untersuchungen über die Cocarboxylase». Биохим. З. 294 : 188–214 .










