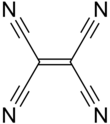
Тетрацианоэтилен
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК этилентетракарбонитрил | |||
| Другие имена TCNE | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.010.527 | ||
CID PubChem |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С 2 (CN) 4 | |||
| Молярная масса | 128,094 г·моль −1 | ||
| Плотность | 1,35 г/см 3 | ||
| Температура плавления | 199 °C (390 °F; 472 К) | ||
| Точка кипения | 130–140 °C (266–284 °F; 403–413 K) 0,1 мм рт. ст. ( возгоняется ) [1] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Тетрацианоэтилен ( TCNE ) — органическое соединение с формулой C2 (CN) 4 . Это бесцветное твердое вещество , хотя образцы часто имеют грязно-белый цвет. Это важный член цианоуглеродов .
Синтез и реакции
TCNE получают путем бромирования малононитрила в присутствии бромида калия с образованием комплекса KBr и дегалогенирования медью . [1]
Окисление TCNE перекисью водорода дает соответствующий эпоксид , обладающий необычными свойствами. [2]
В присутствии основания TCNE реагирует с малононитрилом, образуя соли пентацианопропенида: [3]
- C 2 (CN) 4 + CH 2 (CN) 2 → [(NC) 2 C=C(CN)−C(CN) 2 ] − + CN − + 2 H +
Окислительно-восстановительная химия
TCNE является акцептором электронов . Цианогруппы имеют низкоэнергетические π*-орбитали , и наличие четырех таких групп с их π-системами (сопряженными) с центральной двойной связью C=C приводит к образованию электрофильного алкена . TCNE восстанавливается при −0,27 В по сравнению с ферроценом/ ферроцением : [4]
- C 2 (CN) 4 + е - → [C 2 (CN) 4 ] -
Благодаря своей способности принимать электрон, TCNE использовался для приготовления многочисленных солей с переносом заряда [5] и магнитных молекулярных материалов.
Центральное расстояние C=C в TCNE составляет 135 пм . [6] При восстановлении эта связь удлиняется до 141–145 пм в зависимости от противоиона. [7]
Безопасность
TCNE гидролизуется во влажном воздухе с образованием цианистого водорода , и с ним следует обращаться соответствующим образом. [1]
Ссылки
- ^ abc Carboni, RA (1959). "Тетрацианоэтилен". Органические синтезы . 39 : 64. doi :10.15227/orgsyn.039.0064.
- ^ Linn, WJ (1969). "Тетрацианоэтиленоксид". Органические синтезы . 49 : 103. doi :10.15227/orgsyn.049.0103.
- ^ Middleton, WJ; Wiley, DW (1961). "Тетраметиламмоний 1,1,2,3,3-пентацианопропенид". Org. Synth . 41 : 99. doi :10.15227/orgsyn.041.0099.
- ^ Коннелли, НГ; Гейгер, У.Е. (1996). «Химические окислительно-восстановительные агенты для металлоорганической химии». Chemical Reviews . 96 (2): 877–910 . doi :10.1021/cr940053x. PMID 11848774.
- ^ Читтипедди, Сайлеш; Кромак, КР; Миллер, Джоэл С.; Эпштейн, А.Дж. (1987-06-22). "Ферромагнетизм в молекулярном декаметилферроцений тетрацианоэтениде (DMeFc TCNE)". Physical Review Letters . 58 (25): 2695– 2698. Bibcode :1987PhRvL..58.2695C. doi :10.1103/physrevlett.58.2695. ISSN 0031-9007. PMID 10034821.
- ^ Беккер, П.; Коппенс, П.; Росс, Ф.К. (1973). «Распределение валентных электронов в кубическом тетрацианоэтилене с помощью комбинированного использования рентгеновской и нейтронной дифракции». Журнал Американского химического общества . 95 (23): 7604– 7609. doi :10.1021/ja00804a010.
- ^ Бок, Х.; Рупперт, К. (1992). «Структуры молекул с возмущенным зарядом или стерически переполненных. 16. Радикальная соль тетрацианоэтиленида цезия». Неорганическая химия . 31 (24): 5094– 5099. doi :10.1021/ic00050a032.