Тараксерол
 | |
| Имена | |
|---|---|
| Название ИЮПАК 13-Метил-27-нор-13α-олеан-14-ен-3β-ол | |
| Систематическое название ИЮПАК (3 S ,4a R ,6a R ,8a R ,12a R ,12b S ,14a R ,14b R )-4,4,6a,8a,11,11,12b,14b-Октаметил-1,2,3,4,4a,5,6,6a,8,8a,9,10,11,12,12a,12b,13,14,14a,14b-икозагидропицен-3-ол | |
Другие имена
| |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С30Н50О | |
| Молярная масса | 426,729 г·моль −1 |
| Появление | Бесцветное твердое вещество |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тараксерол — это встречающийся в природе пентациклический тритерпеноид . Он содержится в различных высших растениях, включая Taraxacum officinale ( Asteraceae ), Alnus glutinosa ( Betulaceae ), Litsea dealbata ( Lauraceae ), Skimmia spp. ( Rutaceae ), Dorstenia spp. ( Moraceae ), Maytenus spp. ( Celastraceae ) и Alchornea latifolia ( Euphobiaceae ). [1] Тараксерол был назван «альнулином», когда он был впервые выделен в 1923 году из коры серой ольхи ( Alnus incana L.) Целльнером и Рёгльшпергером. Он также имел название «скиммиол», когда Такеда и Йосики выделили его из Skimmia ( Rutaceae ). [2] Известно, что большое количество лекарственных растений содержат это соединение в своих листьях, корнях или масле семян. [3]
Химия
Структура
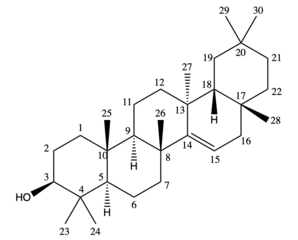
Тараксерол представляет собой олеанан-3-ол с альфа- метильным заместителем в положении 13, отсутствующей метильной группой в положении 14 и двойной связью между 14 и 15. Доминирующий биологический стереоизомер в листьях растений и в отложениях имеет конфигурацию тараксер-14-ен-3β-ол. Тараксерол представляет собой изомер с двойной связью β-амирина , другого важного природного тритерпеноида в высших растениях. Это бесцветное твердое вещество при комнатной температуре с предполагаемой температурой плавления 283,50 °C и температурой кипения 490,70 °C. Он практически нерастворим в воде и имеет растворимость 9,552 × 10−5 мг /л, оцененную по коэффициенту распределения октанол-вода . [4]
Синтез
В то время как синтез пентациклических тритерпеноидов в целом оказался сложным, частичный синтез 11,12-α-оксидотараксерола, производного эпоксида тараксерена, был описан Уршпрунгом и др. из α- и β-амирина. Экспонирование этанольного раствора α- и β-амирина под летним солнечным светом в течение 12 недель дает бесцветный осадок, а омыление осадка дает 11,12-α-оксидотараксерол. В качестве альтернативы, процесс можно ускорить, экспонируя этанольный раствор β-амирина под ультрафиолетовым светом. В этом случае осадок можно собрать менее чем за 3 недели. [5]
Трансформация в осадке
Во время раннего диагенеза тараксерол теряет свою гидроксильную группу и трансформируется в тараксер-14-ен. Тараксер-14-ен может подвергаться быстрой изомеризации с образованием 18β-олеан-12-ена, в котором двойная связь может мигрировать и образовывать смесь олеан-12-ена, олеан-13(18)-ена и олеан-18-ена. Изомеры олеанена быстро образуются из перегруппировок тараксерола во время диагенеза даже в прохладных геотермальных условиях. [6] Дальнейшее восстановление во время катагенеза трех соединений дает преимущественно 18α-олеанан и его аналог 18β-олеанан в качестве второстепенного продукта. Продукт прямого восстановления тараксерола, тараксеран, практически не присутствует в природных отложениях. Олеанан, по-видимому, является доминирующим продуктом в результате процесса трансформации. [7]

Биомаркер
Тараксерол обычно присутствует в небольших количествах в растительных экстрактах и может использоваться в качестве липидного биомаркера для наземных растений. Однако во многих видах листьев мангровых деревьев, например, Rhizophora mangle (красный мангр) и Rhizophora racemosa , тараксерол присутствует в очень высоких уровнях. Поэтому он используется в различных исследованиях в качестве прокси-фактора для мангрового входа. [1] [8] В пределах различных видов мангровых деревьев также существуют различия в составе. Например, Rhizophora mangle содержит высокие уровни тараксерола, β-амирина, германикола и лупеола , Avicennia germinans (черный мангр) состоит в основном из лупеола, бетулина и β-ситостерола , а Laguncularia racemosa (белый мангр) отмечен большими количествами лупеола и β-ситостерола. [9]

Исследование биомаркера мангровых деревьев
Rhizophora racemosa представляет собой доминирующий вид мангровых деревьев в экваториальной и субэкваториальной Западной Африке. Versteegh et al. проанализировали липиды листьев R. racemosa, а также поверхностные отложения и керны осадков из бассейна Анголы и бассейна Капской (юго-восточная Атлантика), чтобы оценить пригодность использования тараксерола в качестве прокси-индикатора для мангрового вклада в морские отложения. Гипотеза заключается в том, что должен быть «базовый уровень» для тараксерола в общих отложениях и повышенные уровни в местах, где Rhizophora вносит значительный вклад.
Анализ показывает, что тараксерол доминирует во внутренней части и общем составе листьев R. racemosa (7,7 мг/г листа). В результате увеличение уровня тараксерола относительно других биомаркеров высших растений в отложениях должно указывать, когда и где Rhizophora вносит существенный вклад. В большей части юго-восточной Атлантики соотношение тараксерола/нормальных алканов C 29 (nC 29 ) в поверхностных отложениях низкое. Высокие соотношения наблюдаются в зоне вдоль континентального склона, в которой максимумы всегда возникают вблизи современных прибрежных мангровых деревьев. Эта картина убедительно подтверждает связь между высокими уровнями тараксерола и поступлением из мангровых экосистем. Эта связь также подтверждается похожей, хотя и менее заметной, тенденцией в пыльце Rhizophora .
Изучение кернов осадка выявляет дальнейшие связи между популяцией мангровых деревьев, уровнями тараксерола и климатическими условиями. Одним из важных климатических условий является оледенение/дегляциация. Во время дегляциаций, когда скорость повышения уровня моря превышала 12 см/100 лет, популяции мангровых деревьев не могли сохраняться из-за отсутствия поставок осадка. [10] После того, как эта скорость замедлялась, популяции мангровых деревьев могли снова расширяться в недавно образовавшихся эстуариях и дельтах. [11] [12] Однако периоды развития мангровых деревьев и повышения уровня тараксерола в бассейне иногда не совпадают друг с другом. Во время быстрого повышения уровня моря прибрежные мангровые отложения могут переноситься в бассейн, что приводит к увеличению поступления тараксерола, в то время как развитие мангровых деревьев фактически происходит позже. В некоторых других случаях, когда колебания уровня тараксерола не были связаны с изменениями уровня моря, их также можно отнести к местным климатическим изменениям температуры и влажности. [1]
Методы анализа
Методы анализа для определения и количественной оценки тараксерола включают газовую хроматографию/масс-спектроскопию (ГХ/МС) и высокоэффективную тонкослойную хроматографию (ВЭТСХ). [13]
ГХ/МС
Существует несколько процедур обработки перед тем, как пробы листьев или осадков, содержащие тараксерол, подвергнуть анализу ГХ/МС. Высушенные и измельченные образцы омыляются сильным основанием (например, гидроксидом калия ), экстрагируются в полярном растворителе (например, дихлорметане ), разделяются на фракции с помощью колоночной хроматографии и, наконец, дериватизируются. Обычные варианты дериватизации включают N -метил- N- (триметилсилил)трифторацетамид (MSTFA) и смесь пиридина и бис(триметилсилил)трифторацетамида (BSTFA), оба из которых направлены на преобразование свободных гидроксильных групп в триметилсилиловые эфиры, делая молекулы более неполярными и, таким образом, более подходящими для анализа ГХ/МС. [1] [9] В ГХ/МС тараксерол имеет характерный пик с отношением массы к заряду (m/z) 204. [1]

ВЭТСХ
Альтернативно, определение и количественное определение тараксерола также могут быть достигнуты с хорошей надежностью и воспроизводимостью с помощью ВЭТСХ. В этом случае выполняется линейное восходящее развитие (например, с использованием гексана и этилацетата (8:2 об./об.) в качестве подвижной фазы) в двухкорпусной стеклянной камере на алюминиевых пластинах ТСХ. Количественное определение может быть достигнуто с помощью спектроденситометрического сканирования на длине волны 420 нм. [13]
Фармакологические исследования
Тараксерол, как и многие тритерпеноидные соединения, обладает противовоспалительным действием in vitro . Он может нарушать активацию ферментов MAP3K7 (TAK1) , протеинкиназы B (PKB или Akt) и NF-κB . Таким образом, он может подавлять экспрессию провоспалительных медиаторов в микрофагах. [14]
Тараксерол также проявляет антиканцерогенную активность. Двухэтапные испытания канцерогенеза in vivo на кожных опухолях мышей показали, что тараксерол может ингибировать индукцию раннего антигена вируса Эпштейна-Барр (EBV-EA) инициатором опухоли 7,12-диметилбенз(а)антраценом (DMBA) и промоутером опухоли 12-O-тетрадеканоилфорбол-13-ацетатом (TPA). [15]
Кроме того, тараксерол может ингибировать активность ацетилхолинэстеразы (АХЭ) в гиппокампе крыс . [16]
Смотрите также
Ссылки
- ^ abcdef Верстиг, Джерард Дж. М.; Шефус, Энно; Дюпон, Лиди; Маррет, Фабьен; Синнингхе Дамсте, Яап С; Янсен, JHFred (февраль 2004 г.). «Тараксерол и пыльца ризофоры как индикаторы для отслеживания прошлых мангровых экосистем». Geochimica et Cosmochimica Acta . 68 (3): 411–422 . Бибкод : 2004GeCoA..68..411V. дои : 10.1016/S0016-7037(03)00456-3.
- ^ Битон, Дж. М.; Спринг, Ф. С.; Стивенсон, Роберт; Стюарт, Дж. Л. (1955). «Тритерпеноиды. Часть XXXVII. Состав тараксерола». Журнал химического общества (возобновление) : 2131. doi : 10.1039/jr9550002131. ISSN 0368-1769.
- ^ Шарма, Киран; Зафар, Рашидуз (2015). «Распространение тараксерола и тараксастерола в лекарственных растениях». Pharmacognosy Reviews . 9 (17): 19– 23. doi : 10.4103/0973-7847.156317 . ISSN 0973-7847. PMC 4441157. PMID 26009688 .
- ^ "The Good Scents Company - Информация о каталоге ароматических/углеводородных/неорганических ингредиентов". www.thegoodscentscompany.com . Получено 28.05.2019 .
- ^ Агата, Исао; Кори, Э.Дж.; Хортманн, Альфред Г.; Кляйн, Джозеф; Просков, Стивен; Урспрунг, Джозеф Дж. (июнь 1965 г.). «Окислительные перегруппировки пентациклических тритерпенов. Метод синтеза некоторых встречающихся в природе тритерпенов из α- и β-амирина1». Журнал органической химии . 30 (6): 1698– 1710. doi :10.1021/jo01017a002. ISSN 0022-3263.
- ^ Rullkötter, Jürgen; Peakman, Torren M.; Lo Ten Haven, H. (март 1994). "Ранний диагенез терригенных тритерпеноидов и его значение для нефтяной геохимии". Organic Geochemistry . 21 ( 3– 4): 215– 233. Bibcode :1994OrGeo..21..215R. doi :10.1016/0146-6380(94)90186-4. ISSN 0146-6380.
- ^ ab Killops, Stephen D. (2013). Введение в органическую геохимию . Wiley. ISBN 9781118697207. OCLC 929526739.
- ^ Killops, SD; Frewin, NL (декабрь 1994 г.). «Тритерпеноидный диагенез и сохранение кутикулы». Organic Geochemistry . 21 (12): 1193– 1209. Bibcode : 1994OrGeo..21.1193K. doi : 10.1016/0146-6380(94)90163-5. ISSN 0146-6380.
- ^ ab Koch, Борис Руллкоттер, Дж. Лара, Р. (2003). Оценка тритерпенолов и стеролов как биомаркеров органического вещества в экосистеме мангровых деревьев в Северной Бразилии . OCLC 900549834.
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Эллисон, Джоанна К.; Стоддарт, Дэвид Р. (1991). «Коллапс мангровой экосистемы во время прогнозируемого повышения уровня моря: аналоги и последствия в голоцене». Журнал прибрежных исследований . 7 (1): 151– 165. ISSN 0749-0208. JSTOR 4297812.
- ^ Grindrod, John; Moss, Patrick; Kaars, Sander Van Der (август 1999). «Позднечетвертичные циклы развития и упадка мангровых зарослей на северо-австралийском континентальном шельфе». Journal of Quaternary Science . 14 (5): 465– 470. Bibcode : 1999JQS....14..465G. doi : 10.1002/(sici)1099-1417(199908)14:5<465::aid-jqs473>3.3.co;2-5. ISSN 0267-8179.
- ^ Стэнли, DJ; Уорн, AG (1994-07-08). «Всемирное возникновение голоценовых морских дельт путем замедления повышения уровня моря». Science . 265 (5169): 228– 231. Bibcode :1994Sci...265..228S. doi :10.1126/science.265.5169.228. ISSN 0036-8075. PMID 17750665. S2CID 296392.
- ^ аб Кумар, Венкатесан; Мукерджи, Какали; Кумар, Сатиш; Мал, Майнак; Мукерджи, Пулок К. (2008). «Валидация метода ВЭТСХ для анализа тараксерола в Clitoria ternatea». Фитохимический анализ . 19 (3): 244–250 . Бибкод : 2008ПЧАн..19..244К. дои : 10.1002/pca.1042. ISSN 0958-0344. ПМИД 17994532.
- ^ Яо, Сяньян; Ли, Гуйлань; Бай, Цинь; Сюй, Хуэй; Люй, Чаотянь (февраль 2013 г.). «Тараксерол ингибирует воспалительные реакции, вызванные ЛПС, посредством подавления активации TAK1 и Akt». Международная иммунофармакология . 15 (2): 316– 324. doi :10.1016/j.intimp.2012.12.032. ISSN 1567-5769. PMID 23333629.
- ^ ТАКАСАКИ, Мидори; КОНОСИМА, Такао; ТОКУДА, Карукуни; МАСУДА, Кадзуо; АРАИ, Йоко; СИДЖИМА, Кендзи; АГЕТА, Хироюки (1999). «Противоканцерогенная активность растения Taraxacum. II». Биологический и фармацевтический вестник . 22 (6): 606–610 . doi : 10.1248/bpb.22.606 . ISSN 0918-6158. ПМИД 10408235.
- ^ Берте, Талита Элиза; Далмагро, Ана Паула; Зимат, Присцила Лаиз; Гонсалвес, Ана Элиза; Мейре-Сильва, Кристиан; Бюргер, Кристиани; Вебер, Карла Дж.; дос Сантос, Диого Адольфо; Чешинель-Фильо, Валдир (апрель 2018 г.). «Тараксерол как возможное терапевтическое средство при нарушениях памяти и болезни Альцгеймера: влияние на когнитивные дисфункции, вызванные скополамином и стрептозотоцином». Стероиды . 132 : 5–11 . doi : 10.1016/j.steroids.2018.01.002. ISSN 0039-128X. PMID 29355563. S2CID 3650791.
