Перегруппировка Штиглица
| Перегруппировка Штиглица | |
|---|---|
| Назван в честь | Юлиус Штиглиц |
| Тип реакции | Реакция перегруппировки |
| Примеры и родственные реакции | |
| Похожие реакции | перегруппировка Бекмана |
Перегруппировка Штиглица — это реакция перегруппировки в органической химии , названная в честь американского химика Юлиуса Штиглица (1867–1937) и впервые исследованная им и Полом Николасом Личем в 1913 году. [1] Она описывает 1,2-перегруппировку производных тритиламина в триарилимины . [ 1] [2] Она сопоставима с перегруппировкой Бекмана , которая также включает замещение у атома азота посредством сдвига углерода на азот. [3] Например, триарилгидроксиламины могут подвергаться перегруппировке Штиглица путем дегидратации и сдвига фенильной группы после активации пентахлоридом фосфора с получением соответствующего триарилимина , основания Шиффа . [4] [5]

В целом термин «перегруппировка Штиглица» используется для описания широкого спектра реакций перегруппировки аминов в имины . [ 4] Хотя, как правило, это связано с перегруппировкой триарилгидроксиламинов , которые хорошо описаны в академической литературе, перегруппировки Штиглица могут также происходить в алкилированных производных аминов , [6] галогенаминах [7] [8] и азидах [9] [10] , а также в других активированных производных аминов . [4]
Общий механизм и связь с перегруппировкой Бекмана

Механизм реакции перегруппировки Штиглица, а также продукты и исходные материалы делают ее тесно связанной с перегруппировкой Бекмана , которая может быть использована для синтеза карбоксамидов . [11] Обе реакции перегруппировки включают сдвиг углерода к азоту, обычно после электрофильной активации уходящей группы на атоме азота. [4] [12] [13] Однако основное различие в исходных материалах заключается в их степени насыщения. В то время как перегруппировка Штиглица происходит на насыщенных производных амина с σ-одинарной связью, типичным исходным материалом для перегруппировки Бекмана является оксим ( гидроксилимин) с двойной связью C=N. [4] [14] При перегруппировке Бекмана катализируемая кислотой миграция углерода к азоту происходит на оксиме с образованием промежуточного нитрилиевого иона . [15] В принципе, первый этап перегруппировки Штиглица протекает аналогичным образом. [4] Однако после образования положительно заряженного иониевого иона посредством π-взаимодействия между неподеленной парой азота и электронодефицитным углеродом в перегруппировке Штиглица пути расходятся. В перегруппировке Штиглица нейтральное по заряду состояние молекулы может быть достигнуто путем диссоциации протона. В качестве альтернативы, если исходный материал не обладал какими-либо аминопротонами, нейтральное состояние может быть достигнуто с помощью внешнего восстановителя, такого как борогидрид натрия . Он восстанавливает промежуточный иониевый ион до соответствующего насыщенного амина . [4] [16] В перегруппировке Бекмана такой протон также отсутствует, и стабилизация промежуточного продукта происходит посредством нуклеофильного присоединения молекулы воды, диссоциации протона и таутомерии от имидной кислоты до карбоксамида . [17]

Вариации
Хотя исходная реакция Штиглица наиболее известна перегруппировкой тритилгидроксиламинов, существует несколько вариаций, которые включают хорошие уходящие группы в качестве N -заместителей (таких как галогены и сульфонаты). Обычно применяются различные реагенты в зависимости от точной природы субстрата. [4]
Перегруппировка СтиглицаН-гидроксилированные амины,Н-алкоксилированные амины иН-сульфированные амины
Перегруппировка СтиглицаН-гидроксилированные амины
Для перегруппировки тритилгидроксиламинов можно использовать кислоты Льюиса, такие как пентахлорид фосфора (PCl 5 ) , пентоксид фосфора (P 2 O 5 ) или трифторид бора (BF 3 ) . [4] Они действуют как электрофильные активаторы для гидроксильной группы , увеличивая качество уходящей группы. Например, при использовании PCl 5 в качестве реагента тритилгидроксиламин сначала трансформируется в активированный промежуточный продукт посредством нуклеофильного замещения. [18] Образованный промежуточный продукт затем может подвергаться перегруппировке путем миграции фенильной группы и диссоциации видов фосфора (V) с образованием N -фенилбензофенонимина. [18]

Перегруппировка СтиглицаН-алкоксилированные амины
В дополнение к N -гидрокситритиламинам, также возможны перегруппировки в N -алкокситритиламинах. Однако эти реакции известны своими изначально низкими выходами. [19] Например, N -бензилоксизамещенный тритиламин может подвергаться перегруппировке Штиглица в присутствии пентахлорида фосфора (160 °C, выход 40%) или с BF3 в качестве реагента (60 °C, выход 29%). [20] В последнем случае BF3 действует как кислота Льюиса в электрофильной активации бензильного кислорода, что позволяет осуществить нуклеофильную атаку на соседний атом азота. [20]

Перегруппировка СтиглицаН-сульфированные амины
Перегруппировки Штиглица также легко протекают с активными сульфонатами в качестве уходящей группы. [21] N -сульфированные амины могут быть получены из соответствующих гидроксиламинов и подходящих сульфирующих реагентов. Например, Гердерин и др. синтезировали свой вторичный гидроксиламин (исходный материал в перегруппировке, показанной ниже), подвергая соответствующий гидроксиламин воздействию тозилхлорида и гидроксида натрия в ацетонитриле . [22]
Перегруппировка Штиглица особенно реактивна в случае мостиковых бициклических N -сульфированных аминов в качестве исходных материалов, где мягкие условия достаточны для эффективного протекания реакции. [23] Например, перегруппировка бициклического N -тозилированного амина легко протекает в водном диоксане при комнатной температуре. [24] Однако соответствующий имин в этом случае не образуется, предположительно из-за напряжения, которое термодинамически неблагоприятно для такой структуры, содержащей двойную связь у атома мостика ( правило Бредта ). [25] Вместо этого тозилат нуклеофильно присоединяется в геминальное положение азота посредством атаки на ион иминия. [22]
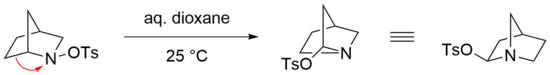
Перегруппировка азидов по Штиглицу
Перегруппировки Штиглица также могут протекать на органических азидах с молекулярным азотом в качестве хорошей уходящей группы. [4] Эти реакции протекают сопоставимо с этапами реакции Шмидта , с помощью которой карбоновые кислоты могут быть преобразованы в амины путем добавления азотистоводородной кислоты в кислых водных условиях. [26] Перегруппировка Штиглица азидов обычно выигрывает от протонной [16] или термической [4] активации, которые также могут быть объединены. [10] В обоих случаях молекулярный азот высвобождается в виде газа на необратимой стадии. Было высказано предположение, что перегруппировка после диссоциации молекулы N2 протекает через реакционноспособный промежуточный нитрен . [10] Эти промежуточные продукты были бы весьма похожи на те, которые были предложены в качестве ключевых промежуточных продуктов в реакциях перегруппировки, названных в честь Хофмана и Курциуса , [27] , но с тех пор считались маловероятными. [28] При воздействии на азид кислоты Бренстеда протонирование азида активирует базальный азот и снижает прочность связи с соседним азотом, так что диссоциация и выталкивание молекулярного азота облегчаются. [16] После перегруппировки протон может затем диссоциировать от иминиевого иона, образуя имин.
Альтернативным способом получения протонированных органических азидов является нуклеофильное присоединение азотистоводородной кислоты к карбокатионам, которые затем также могут подвергаться перегруппировкам Штиглица. [16]
Перегруппировка СтиглицаН-галогенированные амины
Перегруппировка Штиглица N -галогенированных аминов может наблюдаться для хлор- [7] и бром- [8] замещенных аминов, часто в сочетании с органическим основанием, таким как метоксид натрия . [4] Необходимость в основании обычно связана с необходимостью депротонирования амина. [4]
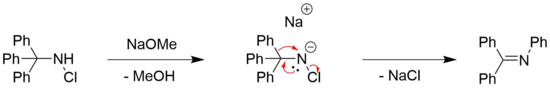
Однако также сообщалось о примерах перегруппировок Стиглица без оснований N -галогенированных аминов. Пример этого можно найти в полном синтезе (±)-ликоподина Полом Грико и др. [6] [29] Там образование кольца происходит путем перегруппировки вторичного галоамина путем воздействия на него тетрафторбората серебра. [6] Известно, что AgBF 4 действует как источник ионов Ag + , которые могут способствовать диссоциации галогенидов из органических молекул с образованием соответствующего галогенида серебра в качестве движущей силы. [30] Затем желаемый продукт получают путем восстановления с помощью цианоборогидрида натрия , мягкого восстановителя, который обычно используется при восстановлении иминов до аминов. [31]

Перегруппировка Штиглица аминов, активированных тетраацетатом свинца
Было также отмечено, что добавление тетраацетата свинца может облегчить перегруппировку Штиглица производных амина. [32] После образования активированного промежуточного производного амина путем координации с центром свинца следующая перегруппировка снова протекает через миграцию ароматической группы при образовании связи C–N, диссоциации свинца и депротонировании полученного иминиевого иона. [33]
Смотрите также
Ссылки
- ^ ab Юлиус Штиглиц , Пол Николас Лич (1914). «Молекулярная перегруппировка триарилметилгидроксиламинов и перегруппировка Бекмана кетоксимов». Журнал Американского химического общества . 36 (2): 272–301. doi :10.1021/ja02179a008.
- ^ Берт Аллен Стагнер (1914). «Молекулярная перегруппировка триарилметилгидроксиламинов». Журнал Американского химического общества . 36 (2): 2069–2081. doi :10.1021/ja02267a018.
- ^ Ван, Зеронг (2010). Комплексные органические названия реакций и реагентов . John Wiley & Sons, Inc. стр. 288–295. ISBN 9780471704508.
- ^ abcdefghijklm Wang, Zerong (сентябрь 2010 г.). Всеобъемлющие органические названия реакций и реагентов . John Wiley. стр. 2673–2676. ISBN 9780471704508.
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «Schiff base». doi :10.1351/goldbook.S05498
- ^ abc Grieco, Paul A.; Dai, Yujia (май 1998). «Построение карбоциклического кольца посредством внутримолекулярной реакции Дильса-Альдера in-situ генерируемого, гетероатомно-стабилизированного аллильного катиона: полный синтез (±)-ликоподина». Журнал Американского химического общества . 120 (20): 5128–5129. doi :10.1021/ja980117b.
- ^ ab Vosburgh, Isabella (октябрь 1916 г.). «Молекулярная перегруппировка трифенилметилгалогенаминов». Журнал Американского химического общества . 38 (10): 2081–2095. doi :10.1021/ja02267a019.
- ^ ab DeTar, DeLos F.; Broderick, Edward; Foster, George; Hilton, Benjamin D. (май 1950 г.). «Попытка перегруппировки 9-бромметиленфлуорена в 9-бромфенантрен». Журнал Американского химического общества . 72 (5): 2183–2184. doi :10.1021/ja01161a086.
- ^ Морган, Агнес Фэй (октябрь 1916 г.). «Молекулярные перегруппировки некоторых триарил-метилхлораминов». Журнал Американского химического общества . 38 (10): 2095–2101. doi :10.1021/ja02267a020.
- ^ abc Kuhn, James (декабрь 1916 г.). «Молекулярная перегруппировка триарилметилазидов». Журнал Американского химического общества . 38 (12): 2718–2726. doi :10.1021/ja02269a014.
- ^ Блатт, AH (апрель 1933 г.). «Перегруппировка Бекмана». Chemical Reviews . 12 (2): 215–260. doi :10.1021/cr60042a002.
- ^ Табер, Дуглас Ф.; Стрэйни, Патрик Дж. (декабрь 2010 г.). «Синтез лауролактама из циклододеканона с помощью перегруппировки Бекмана». Журнал химического образования . 87 (12): 1392. Bibcode : 2010JChEd..87.1392T. doi : 10.1021/ed100599q.
- ^ Фуруя, Ёсиро; Исихара, Казуаки; Ямамото, Хисаши (август 2005 г.). «Цианурхлорид как мягкий и активный катализатор перегруппировки Бекмана». Журнал Американского химического общества . 127 (32): 11240–11241. doi :10.1021/ja053441x. PMID 16089442.
- ^ Гай Донарума, Л.; Хельдт, Уолтер З. (2011). «Органические реакции: перегруппировка Бекмана»: 1–59. doi :10.1002/0471264180.or011.01.
{{cite journal}}: Цитировать журнал требует|journal=( помощь ) - ^ ван Дейк, Том; Крис Слоотвег, Дж.; Ламмертсма, Куп (2017). «Ионы нитрилия – синтез и применение». Органическая и биомолекулярная химия . 15 (48): 10134–10144. doi :10.1039/C7OB02533E. hdl : 11245.1/6b602f30-dfe7-4ef5-a945-9f6942fab8b4 . PMID 29188244.
- ^ abcd Пирсон, Уильям Х. (сентябрь 1996 г.). «Алифатические азиды как основания Льюиса. Применение к синтезу гетероциклических соединений». Журнал гетероциклической химии . 33 (5): 1489–1496. doi :10.1002/jhet.5570330506. hdl : 2027.42/96395 .
- ^ Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт (2012). Органическая химия (2-е изд.). Oxford University Press. стр. 958. ISBN 978-0-19-927029-3.
- ^ ab Li, Jie Jack (2003). Реакции имен: Сборник подробных механизмов реакций (2-е изд.). Springer. стр. 361. ISBN 978-3-662-05338-6.
- ^ Мецгер, Карл Хорст; Мюллер, Питер; Мюллер-Долезаль, Хайди; Швалль, Хорст; Зёлль, Ханна (2014). Методы органической химии Губена-Вейля Том. X / 1, 4-е издание: Нитро-, нитрозо- и гидроксиламиновые соединения (4-е изд.). Георг Тиме Верлаг. п. 1266. ИСБН 9783131805546.
- ^ ab Ayres, Erle B.; Hauser, Charles R. (январь 1948). «Перегруппировка N -трифенилметил-O-бензилгидроксиламина с помощью амида калия трифторида бора». Журнал органической химии . 13 (1): 116–119. doi :10.1021/jo01159a015. PMID 18917716.
- ^ Пирсон, Уильям Х.; Шкерианц, Джеффри М. (сентябрь 1992 г.). «Внутримолекулярная реакция Шмидта алкилазида с карбокатионом. Генерация и перегруппировка конформационно ограниченного вторичного иона аминодиазония». Tetrahedron Letters . 33 (37): 5291–5294. doi :10.1016/s0040-4039(00)79075-7. hdl : 2027.42/29850 .
- ^ аб Хисинг, А.; Гердеринг, В. (январь 1981 г.). «Зауэрстофф-вставка для удаления 2-аза-бицикло[2.2.1]гепт-2-ендериватена». Буквы тетраэдра . 22 (47): 4675–4678. дои : 10.1016/s0040-4039(01)83010-0.
- ^ Ренсло, Адам Р.; Данхайзер, Рик Л. (октябрь 1998 г.). «Синтез замещенных пиридинов с помощью региоконтролируемых [4 + 2] циклоприсоединений оксиминосульфонатов». Журнал органической химии . 63 (22): 7840–7850. doi :10.1021/jo981014e.
- ^ Гассман, Пол Г.; Хартман, Джордж Д. (январь 1973 г.). «Химия ионов нитрения. XXVII. Эффективность уходящей группы в образовании ионов нитрения из производных гидроксиламина». Журнал Американского химического общества . 95 (2): 449–454. doi :10.1021/ja00783a023.
- ^ Фосетт, Фрэнк С. (октябрь 1950 г.). «Правило Бредта о двойных связях в атомно-мостиковых кольцевых структурах». Chemical Reviews . 47 (2): 219–274. doi :10.1021/cr60147a003. PMID 24538877.
- ^ Вольф, Ганс (2011). Органические реакции . John Wiley and Sons, Inc. стр. 307–336. doi :10.1002/0471264180.or003.08.
- ^ Ghosh, Arun K.; Sarkar, Anindya; Brindisi, Margherita (2018). «Перегруппировка Курциуса: механистическое понимание и недавние применения в синтезе природных продуктов». Organic & Biomolecular Chemistry . 16 (12): 2006–2027. doi :10.1039/c8ob00138c. PMC 5864567 . PMID 29479624.
- ^ Раук, Арви; Алевуд, Пол Ф. (1 мая 1977 г.). «Теоретическое исследование перегруппировки Курциуса. Электронные структуры и взаимопревращения видов CHNO». Канадский журнал химии . 55 (9): 1498–1510. doi :10.1139/v77-209.
- ^ Хагер, Анастасия; Вриелинк, Нина; Хагер, Доминик; Лефранк, Жюльен; Траунер, Дирк (2016). «Синтетические подходы к алкалоидам, содержащим α-третичные амины». Natural Product Reports . 33 (3): 491–522. doi : 10.1039/c5np00096c . PMID 26621771.
- ^ Achilonu, Matthew Chilaka; Umesiobi, Dennis O. (ноябрь 2016 г.). «Формирование связей углерод–углерод и углерод–гетероатом с использованием тетрафторбората серебра в качестве промотора». Arabian Journal of Chemistry . 9 : 1984–2003. doi : 10.1016/j.arabjc.2015.06.038 .
- ^ Кристен, Ганс; Мейер, Герд (1997). Grundlagen der allgemeinen und anorganischen Chemie (1-е изд.). Зал + Зауэрлендер. п. 824. ИСБН 978-3-7935-5493-6.
- ^ Систи, Энтони Джозеф (1968). «Реакция тетраацетата свинца с фенилметиламинами». Chemical Communications (21): 1272. doi :10.1039/C19680001272.
- ^ Sisti, Anthony J.; Milstein, Stanley R. (декабрь 1974 г.). «Перегруппировка Штиглица с тетраацетатом свинца и триарилметиламинами». Журнал органической химии . 39 (26): 3932–3936. doi :10.1021/jo00940a030.