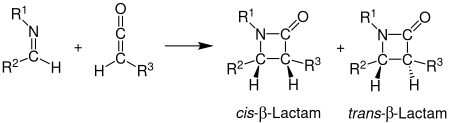
Синтез Штаудингера
Синтез Штаудингера , также называемый циклоприсоединением кетена-имина Штаудингера, представляет собой химический синтез , в котором имин 1 реагирует с кетеном 2 посредством нефотохимического циклоприсоединения 2 +2 с образованием β - лактама 3. [1] Реакция имеет особое значение в синтезе β-лактамных антибиотиков . [2] Синтез Штаудингера не следует путать с реакцией Штаудингера , фосфиновой или фосфитной реакцией , используемой для восстановления азидов до аминов.

Были опубликованы обзоры по механизму, стереохимии и применению реакции. [3] [4] [5]
История
Реакция была открыта в 1907 году немецким химиком Германом Штаудингером . [6] Реакция не привлекала интереса до 1940-х годов, когда была выяснена структура пенициллина . β -лактамный фрагмент первого синтетического пенициллина был сконструирован с использованием этого циклоприсоединения, [7] и он остается ценным инструментом в синтетической органической химии.
Механизм
Первый шаг — нуклеофильная атака иминного азота на карбонильный углерод с образованием цвиттер-ионного промежуточного соединения. Электронодонорные группы на имине облегчают этот шаг, в то время как электроноакцепторные группы препятствуют атаке. [8] Второй шаг — это либо внутримолекулярное нуклеофильное замыкание кольца, либо конротаторное электроциклическое замыкание кольца . [9] Второй шаг отличается от типичных электроциклических замыканий кольца, как предсказывают правила Вудворда-Хоффмана . В фотохимических и микроволновых условиях 4π-электронная система промежуточного соединения не может претерпеть дисротаторное замыкание кольца с образованием β-лактама, возможно, потому, что две двойные связи не являются копланарными. [10] Некоторые продукты синтеза Штаудингера отличаются от тех, которые предсказываются торквоэлектронной моделью. [11] Кроме того, электронная структура переходного состояния отличается от других конротаторных замыканий кольца. [11] Имеются данные, полученные в результате вычислительных исследований модельных систем, что в газовой фазе механизм согласован. [5]

Стереохимия
Стереохимию синтеза Штаудингера может быть трудно предсказать, поскольку любой из шагов может быть определяющим скорость . [12] Если этап замыкания кольца является определяющим скорость, стереохимические прогнозы, основанные на торквоселективности, надежны. [12] Другие факторы, которые влияют на стереохимию, включают начальную региохимию имина. Как правило, (E)-имины образуют цис-β-лактамы, тогда как (Z)-имины образуют транс-β-лактамы. [5] Другие заместители также влияют на стереохимию. Кетены с сильными электронно-донорными заместителями в основном производят цис-β-лактамы, тогда как кетены с сильными электронно-акцепторными заместителями обычно производят транс-β-лактамы. Заместитель кетена влияет на переходное состояние, либо ускоряя, либо замедляя прогресс в направлении β-лактама. Более медленная реакция допускает изомеризацию имина, что обычно приводит к транс-продукту. [11]
Вариации
Были опубликованы обзоры по асимметричной индукции синтеза Штаудингера, включая использование органических и металлоорганических катализаторов. [1] [5] [13]
Имин можно заменить добавлением олефина для получения циклобутанона , карбонила для получения β -лактона или карбодиимидов для получения 4-имино β -лактамов . [1] Синтез Штаудингера и его вариации — все это циклоприсоединения кетена .

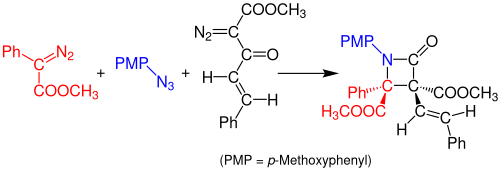
В 2014 году Дойл и его коллеги сообщили об однореакторном многокомпонентном синтезе Штаудингера β-лактамов из азидов и двух диазосоединений. Реакция происходит в результате катализируемой ацетатом родия реакции между арилдиазоацетатом (красный) и органическим азидом (синий) с образованием имина. Перегруппировка Вольфа енона диазоацетоацетата (черный) образует стабильный кетен, который реагирует с имином с образованием стабильного соединения β-лактама. Растворителем, используемым для этой реакции, является дихлорметан (ДХМ), и раствор должен отстояться в течение 3 часов при комнатной температуре. Выход реакции составляет около 99%. [14]
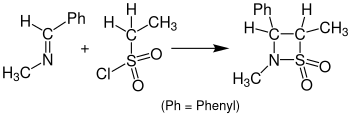
Реакция с сульфенами вместо кетенов, приводящая к β - сультамам, называется циклоприсоединением Сульфа-Штаудингера . На следующем рисунке показан пример циклоприсоединения Сульфа-Штаудингера. Бензилиденметиламин реагирует с этансульфонилхлоридом с образованием β-сультама. Для этой реакции в качестве растворителя использовался тетрагидрофуран (ТГФ), а раствору требовалось отстояться в течение 24 часов. [15]
Ссылки
- ^ abc Li, Jie Jack, ред. (2010). Назовите реакции для образования карбоциклических колец . Hoboken, NJ: Wiley. стр. 45. ISBN 9780470872208.
- ^ Тидвелл, TT (2008). «Хьюго (Уго) Шифф, основания Шиффа и столетие синтеза β-лактама». Angew. Chem. Int. Ed. 47 (6): 1016–1020. doi :10.1002/anie.200702965. PMID 18022986.
- ^ Фу, Н.; Тидвелл, Т.Т. «Получение β-лактамов путем [2+2] циклоприсоединения кетенов и иминов» Tetrahedron 2008 , 64 , 10465-10496. ([1])
- ^ Георг, Гунда И. (1992). Органическая химия β-лактамов . Нью-Йорк: Верлаг Хеми. ISBN 978-0471187998.
- ^ abcd Коссио, Ф.П.; Арриета, А.; Сьерра, М.Г. (2008). «Механизм реакции кетена-имина (Штаудингера) в ее столетие: все еще нерешенная проблема?». Отчеты о химических исследованиях . 41 (8): 925–936. doi :10.1021/ar800033j. PMID 18662024.
- ^ Х. Штаудингер (1907). «Zur Kenntniss der Ketene. Дифенилкетен». Юстус Либигс Энн. хим. 356 (1–2): 51–123. дои : 10.1002/jlac.19073560106.
- ^ JC Sheehan, EL Buhle, EJ Corey , GD Laubach, JJ Ryan (1950). «Полный синтез 5-фенилпенициллина: метил 5-фенил-(2-карбометоксиэтил)-пенициллин». J. Am. Chem. Soc. 72 (8): 3828–9. doi :10.1021/ja01164a534.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Li; Jie Jack, ред. (2010). Названия реакций для образования карбоциклических колец . Hoboken, NJ: Wiley. стр. 47. ISBN 9780470872208.
- ^ Ци, Хэнчжэнь; Ли, Синьяо; Сюй, Цзяси (декабрь 2010 г.). «Стереоселективный контроль в реакциях Штаудингера с участием монозамещенных кетенов с заместителями-акцепторами электронов: экспериментальное исследование и теоретическое обоснование». Органическая и биомолекулярная химия . 9 (8): 2702–2714. doi :10.1039/C0OB00783H. PMID 21359284. S2CID 37085450.
- ^ Лян, Юн; Цзяо, Лэй; Чжан, Шивэй; Сюй, Цзяси (2005). «Реакции Штаудингера, индуцированные микроволновым и фотооблучением, циклических иминов и кетенов, полученных из α-диазокетонов. Дальнейшее исследование стереохимического процесса». Журнал органической химии . 70 (1): 334–337. doi :10.1021/jo048328o. PMID 15624943.
- ^ abc Цзяо, Лей; Лян, Юн; Сюй, Цзяси (2006). «Происхождение относительной стереоселективности образования β-лактама в реакции Штаудингера». Журнал Американского химического общества . 128 (18): 6060–6069. doi :10.1021/ja056711k. PMID 16669675.
- ^ Аб Лян, Юн; Цзяо, Лей; Чжан, Шивэй; Ю, Чжи-Сян; Сюй, Цзяси (2009). «Новый взгляд на торкоселективность реакции Штаудингера». Журнал Американского химического общества . 131 (4): 1542–1549. дои : 10.1021/ja808046e. ПМИД 19132931.
- ^ Паломо, Клаудио; Айзпуруа, Хесус М.; Ганбоа, Иньяки; Ойарбиде, Микель (1999). «Асимметричный синтез β-лактамов с помощью реакции циклоприсоединения кетена-имина Штаудингера». Европейский журнал органической химии . 1999 (12): 3223–3235. doi :10.1002/(SICI)1099-0690(199912)1999:12<3223::AID-EJOC3223>3.0.CO;2-1.
- ^ Mandler, Michael D.; Truong, Phong M.; Zavalij, Peter Y.; Doyle, Michael P. (2014). «Каталитическое превращение диазокарбонильных соединений в имины». Organic Letters . 16 (3): 740–743. doi :10.1021/ol403427s. PMID 24423056.
- ^ Ян, Чжаньхуэй; Чэнь, Нин; Сюй, Цзяси (2015). «Контролируемая заместителем аннулоселективность и стереоселективность в циклоприсоединениях сульфа-Штаудингера». Журнал органической химии . 80 (7): 3611–3620. doi :10.1021/acs.joc.5b00312. ISSN 0022-3263. PMID 25756543.