Квадратная кислота
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК 3,4-Дигидроксициклобут-3-ен-1,2-дион | |||
| Другие имена Квадратная кислота Циклобутендиовая кислота | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.018.875 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С4Н2О4 | |||
| Молярная масса | 114,056 г·моль −1 | ||
| Появление | белый кристаллический порошок | ||
| Температура плавления | > 300 °C (572 °F; 573 К) | ||
| Кислотность ( pK a ) | п К а1 = 1,5 п К а2 = 3,4 | ||
| Опасности [2] | |||
| Маркировка СГС : | |||
 | |||
| Опасность | |||
| H314 | |||
| P260 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340+P310 , P305+P351+P338 | |||
| точка возгорания | 190 °C (374 °F; 463 К) [3] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
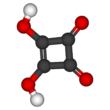
Квадратная кислота , также называемая квадратной кислотой , поскольку ее четыре атома углерода приблизительно образуют квадрат, является двухосновной органической кислотой с химической формулой C4O2 (OH) 2 . [4]
Сопряженным основанием квадратной кислоты является анион квадратной кислоты водорода HC 4 O.−4; а сопряженное основание аниона квадрата водорода — это двухвалентный анион квадрата C 4 O2−4. Это один из оксоуглеродных анионов , которые состоят только из углерода и кислорода.
Скварцевая кислота — реагент для химического синтеза , используемый, например, для создания светочувствительных скварановых красителей и ингибиторов тирозиновых протеинфосфатаз .
Химические свойства
Квадратная кислота представляет собой белый кристаллический порошок. [5] Начало термического разложения зависит от различных термодинамических условий, таких как скорость нагрева.
Структура квадратной кислоты не является идеальным квадратом, так как длины связей углерод-углерод не совсем равны. Высокая кислотность с p K a1 = 1,5 для первого протона и p K a2 = 3,4 для второго объясняется резонансной стабилизацией аниона . [6] Поскольку отрицательные заряды равномерно распределены между каждым атомом кислорода, дианион квадратной кислоты полностью симметричен (в отличие от самой квадратной кислоты) со всеми идентичными длинами связей C−C и всеми идентичными длинами связей C−O.
Производные
Многие реакции квадратной кислоты включают ОН-группы. Молекула ведет себя подобно сильной дикарбоновой кислоте. Она более сильная кислота, чем типичные карбоновые кислоты. [7]
- C4O2 ( OH) 2 → [ C4O3 ( OH ) ] − + H + , pKa1 = 1,5
- [C 4 O 3 (OH)] − → [C 4 O 4 ] 2− + H + , p K a2 = 3,5
Группы ОН лабильны в квадратной кислоте. Образует дихлорид с тионилхлоридом :
- C4O2 ( OH ) 2 + 2SOCl2 → C4O2Cl2 + 2HCl + 2SO2
Хлориды являются хорошими уходящими группами, напоминающими хлорангидриды кислот . Они вытесняются различными нуклеофилами. Таким образом может быть получен дитиоскварат. [8]
Бис(метиловый эфир) получают путем алкилирования триметилортоформиатом . [9]
Дибутилскварат используется для лечения бородавок [10] и очаговой алопеции . [11]
Диэтиловый скварат использовался в качестве промежуточного продукта в синтезе перзинфотеля . [ необходима ссылка ]
Скварамиды получают путем замещения алкокси или хлоридных групп из C4O2X2 ( X = OR, Cl ) . [8] [ 12]
Одна или обе группы кислорода (=O) в анионе квадрата могут быть заменены дицианометиленовой =C(CN) 2 . Образующиеся анионы, такие как 1,2-бис(дицианометилен)скварат и 1,3-бис(дицианометилен)скварат , сохраняют ароматический характер скварата и были названы псевдооксоуглеродными анионами .
Фотолиз квадратной кислоты в твердой аргоновой матрице при 10 К (−263 °C) дает ацетилендиол . [13]
Координационные комплексы
Скваратный дианион ведет себя подобно оксалату , образуя моно- и полиядерные комплексы с ионами жестких металлов. Гидрат квадратного кобальта(II) Co(C 4 O 4 )·2H 2 O (желтый, кубический) может быть получен путем автоклавирования гидроксида кобальта(II) и квадратной кислоты в воде при 200 °C. Вода связана с атомом кобальта , а кристаллическая структура состоит из кубического расположения полых ячеек, стенки которых представляют собой либо шесть анионов квадратного (оставляя пустоту шириной 7 Å), либо несколько молекул воды (оставляя пустоту шириной 5 Å). [14]
Дигидроксид квадратного кобальта(II) Co 3 (OH) 2 (C 4 O 4 ) 2 ·3H 2 O (коричневый) получается вместе с предыдущим соединением. Он имеет столбчатую структуру, включающую каналы, заполненные молекулами воды; их можно удалять и заменять без разрушения кристаллической структуры. Цепи ферромагнитны ; они связаны антиферромагнитно в гидратированной форме, ферромагнитно в безводной форме. [14]
Синтезированы и охарактеризованы мономерные и димерные смешанно-лигандные комплексы скварата меди(II). [15] Приведены данные по инфракрасным, электронным и Q-полосным ЭПР-спектрам, а также магнитной восприимчивости.
Тот же метод дает дигидроксид квадратного железа (II) Fe 2 (OH) 2 (C 4 O 4 ) (светло-коричневый). [14]
Синтез
Первоначальный синтез начинался с этанолиза перфторциклобутена с получением 1,2-диэтокси-3,3,4,4-тетрафтор-1-циклобутен. Гидролиз дает квадратную кислоту. [16] [4]
Хотя это и непрактично, квадратные и родственные анионы, такие как дельтат C 3 O2−3и ацетилендиолят C 2 O2−2могут быть получены путем восстановительной реакции с оксидом углерода с использованием уранорганических комплексов . [17] [18]
Смотрите также
- Ацетилендиол , H 2 (CO) 2 или HO−C≡C−OH
- Дельтиновая кислота , H2 ( CO) 3
- Кроконовая кислота , H2 (CO) 5
- Родизоновая кислота , H2 (CO) 6
- Циклопропенон , C3H2O
- Циклобутен , C4H6
- Скварамид , C 4 O 2 (NH 2 ) 2 , азотистый аналог квадратной кислоты, в котором ОН-группы квадратной кислоты заменены на NH 2 -группы.
- Монилиформин , NaC 4 HO 3 , натриевая соль полукваратной кислоты
Ссылки
- ^ 3,4-Дигидрокси-3-циклобутен-1,2-дион. Sigma-Aldrich
- ^ "SICHERHEITSDATENBLATT". 21 марта 2021 г.
- ^ 3,4-Дигидрокси-3-циклобутен-1,2-дион, 98+%. Alfa Aesar
- ^ ab Роберт Уэст (1980). "История оксоуглеродов". В Роберт Уэст (ред.). Оксоуглероды . Academic Press. стр. 1–14. doi :10.1016/B978-0-12-744580-9.50005-1. ISBN 9780127445809.
- ^ Ли, К.-С.; Квон, Дж.Дж.; О, И.-Х.; Ли, CE (2012). «Полиморфный фазовый переход и термическая стабильность в квадратной кислоте ( H
2С
4О
4)". J. Phys. Chem. Solids . 73 (7): 890–895. doi :10.1016/j.jpcs.2012.02.013. - ^ Уэст, Роберт ; Пауэлл, Дэвид Л. (1963). «Новые ароматические анионы. III. Расчеты молекулярных орбиталей кислородсодержащих анионов». J. Am. Chem. Soc. 85 (17): 2577–2579. doi :10.1021/ja00900a010.
- ^ «Таблицы кислотности гетероатомных органических кислот и карбоновых кислот».
- ^ ab Артур Х. Шмидт (1980). «Реакции на Quadratsäure und Quadratsäure-Derivaten». Синтез . 1980 (12): 961. doi : 10.1055/s-1980-29291. S2CID 101871124.
- ^ Лю, Хуэй; Томука, Крейг С.; Сюй, Саймон Л.; Йеркса, Бенджамин Р.; Салливан, Роберт В.; Сюн, Ифэн; Мур, Гарольд В. (1999). "Диметилскварат и преобразование его в 3-этенил-4-метоксициклобутен-1,2-дион и 2-бутил-6-этенил-5-метокси-1,4-бензохинон". Органические синтезы . 76 : 189. doi :10.15227/orgsyn.076.0189.
- ^ Сильверберг, Нанетт Б.; Лим, Джозеф К.; Паллер, Эми С.; Манчини, Энтони Дж. (2000). «Иммунотерапия скваровой кислотой бородавок у детей». Журнал Американской академии дерматологии . 42 (5): 803–808. doi :10.1067/mjd.2000.103631. PMID 10775858.
- ^ Ёсимасу, Такаши; Фурукава, Фукуми (2016). «Модифицированная иммунотерапия гнездной алопеции». Обзоры аутоиммунитета . 15 (7): 664–667. doi :10.1016/j.autrev.2016.02.021. PMID 26932732.
- ^ Ian Storer, R.; Aciro, Caroline; Jones, Lyn H. (2011). «Squaramides: Physical Properties, Synthesis and Applications». Chem. Soc. Rev. 40 ( 5): 2330–2346. doi :10.1039/c0cs00200c. PMID 21399835.
- ^ Майер, Гюнтер; Рор, Кристина (1995). «Этинедиол: фотохимическое образование и матрично-спектроскопическая идентификация». Liebigs Annalen . 1996 (3): 307–309. doi :10.1002/jlac.199619960303.
- ^ abc Хитоши, Кумагаи; Хидео, Собукава; Мохамедалли, Курмо (2008). «Гидротермальные синтезы, структуры и магнитные свойства координационных каркасов двухвалентных переходных металлов». Журнал материаловедения . 43 (7): 2123–2130. Bibcode : 2008JMatS..43.2123K. doi : 10.1007/s10853-007-2033-8. S2CID 95205908.
- ^ Reinprecht, JT; Miller, JG; Vogel, GC; et al. (1979). "Синтез и характеристика комплексов квадрата меди (II)". Inorg. Chem., 19, 927-931
- ^ Парк, Дж. Д.; Коэн, С. и Лахер, Дж. Р. (1962). «Реакции гидролиза галогенированных циклобутеновых эфиров: синтез дикетоциклобутендиола». J. Am. Chem. Soc. 84 (15): 2919–2922. doi :10.1021/ja00874a015.
- ^ Фрей, Алистер С.; Клок, Ф. Джеффри Н.; Хичкок, Питер Б. (2008). «Механистические исследования восстановительной циклоолигомеризации CO смешанными сэндвичевыми комплексами U(III); молекулярная структура [(U(η-C 8 H 6 {Si′Pr 3 -1,4} 2 )(η-Cp * )] 2 (μ-η 1 :η 1 -C 2 O 2 )». Журнал Американского химического общества . 130 (42): 13816–13817. doi :10.1021/ja8059792. PMID 18817397.
- ^ Summerscales, Owen T.; Frey, Alistair SP; Cloke, F. Geoffrey N.; Hitchcock, Peter B. (2009). «Восстановительное диспропорционирование диоксида углерода в карбонатные и квадратные продукты с использованием смешанного сэндвичевого комплекса U(III)». Chemical Communications (2): 198–200. doi :10.1039/b815576c. PMID 19099067.