Спиротрипростатин В
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (2 S ,3 S ,5a S )-2′-Гидрокси-3-(2-метилпроп-1-ен-1-ил)-5a,6,7,8-тетрагидро-3 H ,5 H ,10 H -спиро[дипирроло[1,2- a :1′,2′- d ]пиразол-2,3′-индол]-5,10-дион | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider |
|
CID PubChem |
|
| |
| |
| Характеристики | |
| С21Н21Н3О3 | |
| Молярная масса | 363,417 г·моль −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Спиротрипростатин B — индольный алкалоид , обнаруженный в грибке Aspergillus fumigatus , который относится к классу природных 2,5-дикетопиперазинов . [1] Было обнаружено, что спиротрипростатин B и несколько других индольных алкалоидов (включая спиротрипростатин A , а также другие трипростатины и циклотрипростатины) обладают антимитотическими свойствами , и как таковые они стали представлять большой интерес в качестве противораковых препаратов . [2] В связи с этим полный синтез этих соединений является основным занятием химиков-органиков, и в химической литературе было опубликовано несколько различных синтезов.
Полный синтез
Первый полный синтез был осуществлен в 2000 году группой Данишефского в Колумбийском университете [3] , а вскоре после этого последовало несколько других синтезов: Уильямсом [4] , Ганесаном [5] , Фуджи [6] , Каррейрой [7] , Хорном [8] , Оверманом [9] и совсем недавно Тростом [10] .
С точки зрения синтеза наиболее сложными структурными особенностями молекулы являются спироциклическое кольцо C3 и соседний пренилзамещенный углерод. Подходы к получению скелета спиротрипростатина B значительно различались.
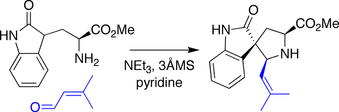
Синтез спиротрипростатина В по Данишефскому
В синтезе Данишефского амин, полученный из триптофана , конденсировался с альдегидом , запуская реакцию типа Манниха , в которой боковой оксиндол действовал как нуклеофил по отношению к промежуточным видам иминия .
Синтез спиротрипростатина Вильямса
Синтез группы Уильямса использовал реакцию сочетания из 3 компонентов. Вторичный амин был объединен с альдегидом для образования промежуточного азометинилида , который подвергся 1,3-диполярному циклоприсоединению с ненасыщенным оксиндола, также присутствующим в реакционной смеси.
Синтез спиротрипростатина B Ганесан
Ганесан использовал биомиметическую стратегию в своем синтезе спиротрипростатина B. Индол обрабатывался N -бромсукцинимидом, чтобы вызвать окислительную перегруппировку, образуя четвертичный стереоцентр диастереоселективным образом .
Синтез спиротрипростатина B Фуджи
В синтезе, разработанном группой Фуджи, стереохимия на спироциклическом углероде была установлена реакцией нитроолефинирования. Оксиндол с боковой пренильной группой реагировал с нитроолефином, несущим хиральную уходящую группу .
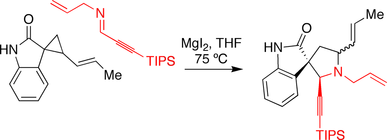
Синтез спиротрипростатина B Каррейры
Группа Каррейры использовала реакцию аннелирования, стимулируемую иодидом магния, в своем подходе к спиротрипростатину B. Оксиндол, содержащий циклопропан , реагировал с имином в присутствии иодида магния, запуская реакцию расширения кольца.
Синтез спиротрипростатина B Хорна
Синтез спиротрипростатина B Хорном также использовал процесс типа Манниха , в котором хлориндол служил пронуклеофилом . Циклизация была вызвана обработкой бокового имина ацилхлоридом, полученным из пролина . Полученные иминийовые виды были атакованы хлориндолом , образуя спироциклическую связь.
Синтез спиротрипростатина В Овермана
Группа Овермана использовала реакцию Хека для получения молекулы. Иодо - анилин с присоединенным алкеном был подвергнут палладиевому катализу . Промежуточные палладий-аллильные виды были перехвачены азотом амидной группы для получения пренильного стереоцентра в той же реакции.
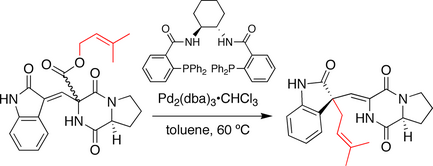
Синтез спиротрипростатина В Трост
В синтезе, разработанном группой Троста, стереохимия на стыке спироциклического кольца устанавливается последовательностью декарбоксилирования-пренилирования, напоминающей реакцию Кэрролла . Здесь прениловый эфир служит как нуклеофилом, так и предшественником электрофила . При обработке хиральным палладиевым катализатором пренильная группа ионизируется и декарбоксилируется. Полученная ионная пара впоследствии рекомбинирует, образуя пренилированный продукт. Примечательно, что происходит миграция двойной связи, и пренильная группа подвергается атаке по оксиндольному углероду.
Ссылки
- ^ "Информация о метаболитах KNApSAcK - C00016255". www.knapsackfamily.com .
- ^ Бортвик AD; и др. (2012). «2,5-Дикетопиперазины: синтез, реакции, медицинская химия и биоактивные натуральные продукты». Chemical Reviews . 112 (7): 3641– 3716. doi :10.1021/cr200398y. PMID 22575049.
- ^ Cui, CB (1996). «Спиротрипростатин B, новый ингибитор клеточного цикла млекопитающих, продуцируемый Aspergillus fumigatus». J. Antibiot . 49 (8): 832– 835. doi : 10.7164/antibiotics.49.832 . PMID 8823522.
- ^ фон Нуссбаум, Ф.; Данишефски, С.Дж. (2000). «Быстрый полный синтез спиротрипростатина B: доказательство его относительной и абсолютной стереохимии». Angew. Chem. Int. Ed . 39 (12): 2175– 2178. doi :10.1002/1521-3773(20000616)39:12<2175::AID-ANIE2175>3.0.CO;2-J. PMID 10941053.
- ^ Sebahar, PR; Williams, RM (2000). «Асимметричный полный синтез (+)- и (−)-спиротрипростатина B». J. Am. Chem. Soc . 122 (23): 5666– 5667. doi :10.1021/ja001133n.
- ^ Ван, Х.; Ганесан, А. (2000). «Биомиметический полный синтез (−)-спиротрипростатина B и связанные с ним исследования». J. Org. Chem . 65 (15): 4685– 4693. doi :10.1021/jo000306o. PMID 10959875.
- ^ Bagul, TD; et al. (2002). «Полный синтез спиротрипростатина B посредством асимметричного нитроолефинирования». Org. Lett . 4 (2): 249– 251. doi :10.1021/ol016999s. PMID 11796062.
- ^ Мейерс, К; Каррейра, Э.М. (2003). «Полный синтез (−)-спиротрипростатина B». Angew. Chem. Int. Ed . 42 (6): 694– 696. doi :10.1002/anie.200390192. PMID 12575009.
- ^ Мияке, Ф.Й. и др. (2004). «Подготовка и синтетическое применение метиловых эфиров 2-галогентриптофана: синтез спиротрипростатина B». Angew. Chem. Int. Ed . 43 (40): 5357– 5360. doi :10.1002/anie.200460419. PMID 15468070.
- ^ Оверман, LE; Розен, MD (2000). «Полный синтез (−)-спиротрипростатина B и трех стереоизомеров». Angew. Chem. Int. Ed . 39 (24): 4596– 4599. doi :10.1002/1521-3773(20001215)39:24<4596::AID-ANIE4596>3.0.CO;2-F. PMID 11169682. S2CID 20673404.
- ^ Trost, BM; Stiles, DT (2007). «Полный синтез спиротрипростатина B посредством диастереоселективного пренилирования». Org. Lett . 9 (15): 2763– 2766. doi :10.1021/ol070971k. PMID 17592853.