Циклопентадиенид натрия
 | |||
 | |||
| |||
 Циклопентадиенидный анион | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Циклопентадиенид натрия | |||
| Другие имена Циклопентадиенилид натрия, циклопентадиенилнатрий | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ChemSpider | |||
| Информационная карта ECHA | 100.023.306 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С5Н5Na | |||
| Молярная масса | 88,085 г·моль −1 | ||
| Появление | бесцветное твердое вещество | ||
| Плотность | 1,113 г/см 3 | ||
| разложение | |||
| Растворимость | ТГФ | ||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | легковоспламеняющийся | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
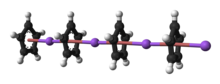
Циклопентадиенид натрия — это натрийорганическое соединение с формулой C5H5Na . Соединение часто обозначается аббревиатурой NaCp, где Cp− — анион циклопентадиенида. [1] Циклопентадиенид натрия — бесцветное твердое вещество, хотя образцы часто имеют розовый цвет из-за следов окисленных примесей . [ 2 ]
Подготовка
Циклопентадиенид натрия коммерчески доступен в виде раствора в ТГФ . Его получают обработкой циклопентадиена натрием : [3]
- 2 Na + 2 C 5 H 6 → 2 NaC 5 H 5 + H 2
Преобразование может быть проведено путем нагревания суспензии расплавленного натрия в дициклопентадиене . [2] Раньше натрий поставлялся в виде «натриевой проволоки» или «натриевого песка», мелкодисперсного натрия, полученного путем плавления натрия в кипящем ксилоле и быстрого перемешивания. [4] [5] Гидрид натрия является удобным основанием: [6]
- NaH + 2C5H6 → NaC5H5 + H2
В ранних работах в качестве оснований использовались реактивы Гриньяра . При p K a 15 циклопентадиен может быть депротонирован многими реагентами.
Приложения
Циклопентадиенид натрия является распространенным реагентом для получения металлоценов . Например, получение ферроцена [4] и дихлорида цирконоцена : [7]
- 2 NaC 5 H 5 + FeCl 2 → Fe(C 5 H 5 ) 2 + 2 NaCl
- ZrCl4 (тгф) 2 + 2 NaCp → (C5H5 ) 2ZrCl2 + 2 NaCl + 2 ТГФ
Циклопентадиенид натрия также используется для получения замещенных производных циклопентадиенила, таких как производные эфира и формила: [8]
- NaC 5 H 5 + O=C(OEt) 2 → NaC 5 H 4 CO 2 Et + NaOEt
Эти соединения используются для получения замещенных металлоценов, таких как 1,1'-ферроцендикарбоновая кислота . [9]
Структура
Природа NaCp сильно зависит от его среды, и для целей планирования синтезов реагент часто представляют в виде соли Na+
С
5ЧАС−
5. Кристаллический NaCp без растворителя, который встречается редко, представляет собой «полипалубный» сэндвич -комплекс , состоящий из бесконечной цепи чередующихся центров Na +, зажатых между лигандами μ - η5 : η5 - C5H5 . [10] В качестве раствора в донорных растворителях NaCp сильно сольватирован, особенно в щелочном металле, о чем свидетельствует изолируемость аддукта Na ( tmeda ) Cp . [11]
В отличие от циклопентадиенидов щелочных металлов, было обнаружено, что циклопентадиенид тетрабутиламмония (Bu 4 N + C 5 H 5 − ) поддерживается исключительно ионной связью, и его структура является репрезентативной для структуры аниона циклопентадиенида (C 5 H 5 − , Cp − ) в твердом состоянии. Однако анион несколько отклоняется от плоского правильного пятиугольника с длинами связей C–C в диапазоне 138,0–140,1 пм и углами связей C–C–C в диапазоне 107,5–108,8°. [12]
Смотрите также
Ссылки
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005). Кембридж (Великобритания): RSC – IUPAC . ISBN 0-85404-438-8 . стр. 262. Электронная версия.
- ^ ab Tarun K. Panda, Michael T. Gamer, Peter W. Roesky "Улучшенный синтез циклопентадиенида натрия и калия" Organometallics, 2003, 22, 877–878. doi :10.1021/om0207865
- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри (1988), Advanced Inorganic Chemistry (5-е изд.), Нью-Йорк: Wiley-Interscience, стр. 139, ISBN 0-471-84997-9
- ^ ab Wilkinson, Geoffrey (1963). "Ферроцен". Органические синтезы; Собрание томов , т. 4, стр. 473.
- ^ Партридж, Джон Дж.; Чадха, Нареш К.; Ускокович, Милан Р. (1990). «Асимметричное гидроборирование 5-замещенных циклопентадиенов: синтез метил (1R,5R)-5-гидрокси-2-циклопентен-1-ацетата». Органические синтезы
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ); Собрание томов , т. 7, стр. 339. - ^ Girolami, GS ; Rauchfuss, TB & Angelici, RJ (1999). Синтез и техника в неорганической химии . CA: University Science Books: Mill Valley. ISBN 0935702482.
- ^ Уилкинсон, Г.; Бирмингем, Дж. Г. (1954). «Бис-циклопентадиенильные соединения Ti, Zr, V, Nb и Ta». J. Am. Chem. Soc. 76 (17): 4281–84. doi :10.1021/ja01646a008.
- ^ Macomber, DW; Hart, WP; Rausch, MD (1982). «Функционально замещенные циклопентадиенильные металлические соединения». Adv. Organomet. Chem . Advances in Organometallic Chemistry. 21 : 1–55. doi :10.1016/S0065-3055(08)60377-9. ISBN 9780120311217.
- ^ Петров, Алекс Р.; Джесс, Кристоф; Фрейтаг, Маттиас; Джонс, Питер Г.; Тамм, Маттиас (2013). «Масштабное получение 1,1′-ферроцендикарбоновой кислоты, ключевого соединения для синтеза 1,1′-дизамещенных производных ферроцена». Organometallics . 32 (20): 5946–5954. doi :10.1021/om4004972.
- ^ Роберт Э. Диннебир; Ульрих Беренс и Фальк Ольбрих (1997). «Твердотельные структуры циклопентадиениллития, -натрия и -калия. Определение методом порошковой дифракции высокого разрешения». Organometallics . 16 (17): 3855–3858. doi :10.1021/om9700122.
- ^ Эльшенбройх, К. (2006). Металлоорганические соединения . Wiley-VCH: Вайнхайм. ISBN 978-3-527-29390-2.
- ^ Ритц, Манфред Т.; Хютте, Стефан; Годдард, Ричард (1 марта 1995 г.). «Тетрабутиламмониевые соли 2-нитропропана, циклопентадиена и 9-этилфлуорена: кристаллические структуры и использование в анионной полимеризации». Zeitschrift für Naturforschung B . 50 (3): 415–422. дои : 10.1515/znb-1995-0316 . ISSN 1865-7117. S2CID 45791403.




