Дисульфид кремния
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК сульфид кремния(IV) | |
| Другие имена дисульфид кремния | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
| Информационная карта ECHA | 100.033.935 |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| SiS 2 | |
| Молярная масса | 92,218 г/моль |
| Появление | Иголки белые (иногда встречаются серые или коричневые). Во влажном воздухе запах тухлых яиц. |
| Плотность | 1,853 г/см 3 |
| Температура плавления | 1090 °C (1990 °F; 1360 K) возгоняется |
| Разлагается | |
| Структура | |
| Орторомбическая , oI12 | |
| Ибам, №72 [1] | |
| Тетраэдрический | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы | диоксид кремния |
Другие катионы | сероуглерод дисульфид германия сульфид олова(IV) сульфид свинца(IV) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
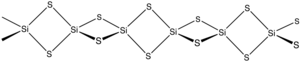
Дисульфид кремния — неорганическое соединение с формулой SiS2 . Как и диоксид кремния , этот материал является полимерным , но он имеет одномерную структуру, существенно отличающуюся от обычных форм SiO2 .
Синтез, структура и свойства
Материал образуется при нагревании кремния и серы или в результате реакции обмена между SiO 2 и Al 2 S 3 . Материал состоит из цепочек тетраэдров , соединенных общими ребрами , -Si(μ-S) 2 Si(μ-S) 2 -. [2]
Как и другие соединения кремния и серы (например, бис(триметилсилил)сульфид ), SiS 2 легко гидролизуется с выделением H 2 S. Сообщается, что в жидком аммиаке он образует имид Si(NH) 2 и NH 4 SH, [3], но в недавнем отчете было идентифицировано кристаллическое (NH 4 ) 2 [SiS 3 (NH 3 )]·2NH 3 как продукт, содержащий тетраэдрический тиосиликатный анион, SiS 3 (NH 3 ) 2- . [4]
Реакция с этанолом дает алкоксид тетраэтилортосиликат и H 2 S. [3] С объемным трет-бутанолом алкоголиз дает трис(трет-бутокси)силантиол : [5]
- 3 (CH3 ) 3COH + SiS2 → [( CH3 ) 3CO ] 3SiSH + H2S
Реакция с сульфидом натрия , сульфидом магния и сульфидом алюминия дает тиосиликаты . [3]
Утверждается, что SiS 2 встречается в некоторых межзвездных объектах. [6]
Ссылки
- ^ Вайс, А.; Вайс, А. (1954). «Убер халькогенид кремния. VI. Zur Kenntnis der faserigen Модификация диоксида кремния». Zeitschrift für Anorganische und Allgemeine Chemie . 276 ( 1–2 ): 95–112 . doi :10.1002/zaac.19542760110.
- ^ Холлеман, А. Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Academic Press. ISBN 0-12-352651-5.В этой книге из-за ошибки печати указано, что r SiSi составляет 214 пикометров , хотя на самом деле это расстояние соответствует r SiS .
- ^ abc Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press . стр. 359. ISBN 978-0-08-022057-4.
- ^ Мейер, Мартин; Корбер, Николаус (2009). «Первый тиосиликат из раствора: синтез и кристаллическая структура (NH4)2[SiS3(NH3)]·2NH3». Dalton Transactions (9): 1506– 1508. doi :10.1039/b818856d. ISSN 1477-9226. PMID 19421590.
- ^ Р. Пенькос, В. Войновский (1962). «Untersuchungen über die Alkoholyse des SiS2. II. Darstellung von Trialkoxysilanthiolen und Tetraalkoxycyclodisilthianen aus den tertiären Alkoholen». З. Анорг. Аллг. Хим . 318 ( 3–4 ): 212–216 . doi :10.1002/zaac.19623180310.
- ^ Goebel, JH (1993). "SiS2 в околозвездных оболочках" (PDF) . Астрономия и астрофизика . 278 (1): 226– 230. Bibcode : 1993A&A...278..226G.




